脂肪基质血管组分对膝骨关节炎模型大鼠疼痛及软骨修复的研究
2021-07-21杨锦荧楼袁美葛彦志陈祖祥单乐天陆海山贾明
杨锦荧 楼袁美 葛彦志 陈祖祥 单乐天 陆海山 贾明
膝骨关节炎(KOA)是以膝内侧疼痛、行走活动时膝痛加重、活动受限、关节畸形等为主要表现,并伴有软骨损伤、骨赘形成等临床症状的常见骨科疾病[1]。流行病学显示,55岁以上人群中约60%有KOA表现,65岁以上老年人KOA的发病率可达85%[2]。脂肪基质血管组分(SVF)是从脂肪组织中去除成熟脂肪细胞后剩余的水相组分,含有多种具有修复功能的细胞以及细胞因子,包括脂肪源性干细胞(ADSCs)、内皮祖细胞、内皮细胞、巨噬细胞、平滑肌细胞、淋巴细胞、周细胞、造血干细胞和脂肪前体细胞等[3]。其中,ADSCs是SVF的重要组成部分,具有多向分化潜能,有较强的血管再生能力、免疫调节能力、抗炎能力、成骨和软骨形成能力[4-5],具有较高的临床应用价值。已有研究证明活体关节腔内注射SVF辅助治疗KOA,能促进软骨增生,起到修复和治疗KOA的作用[6]。本研究通过观察不同浓度的SVF干预KOA大鼠疼痛模型,探讨其对KOA关节疼痛和软骨退变的治疗效果,为临床SVF的应用提供理论依据。
1 材料与方法
1.1 实验动物 雄性SPF级SD大鼠25只,体质量(200±20)g,购自上海斯莱克实验动物有限公司,实验动物合格证号:SCKK(沪)2007-0005,于浙江中医药大学动物实验中心进行实验。实验方案通过医学动物实验伦理委员会批准。
1.2 试剂及仪器 胎牛血清(FBS)、磷酸缓冲溶液(PBS)、Ⅱ型胶原酶、生理盐水、碘乙酸(美国Sigma公司)、手术剪刀、注射针、戊巴比妥钠、10%水合氯醛、4%多聚甲醛溶液、EDTA脱钙液(中国Solarbio公司)、YLS-3E电子压痛仪(安徽省淮北正华生物仪器设备有限公司)。
1.3 实验方法 (1)SVF制备及质量控制:利用胶原酶消化法制备SVF[7]。将5只SD大鼠处死后,无菌条件下取双侧腹股沟脂肪组织,PBS清洗3次,去除肉眼可见的筋膜后剪碎,加5倍体积0.2%的Ⅱ型胶原酶于37 ℃恒温箱内磁力搅拌50~60 min,适量10% FBS终止消化,离心,弃上清液,PBS清洗,重复3次。最后离心所得沉淀物即为SVF,用PBS配成低(1.6×104个 /mL)、中(3.2×104个 /mL)、高(6.4×104个/mL)三个浓度,低温保存备用。(2)大鼠分组、造模及干预:将25只SD大鼠随机分为正常组、模型组、SVF低浓度组、SVF中浓度组、SVF高浓度组,每组各5只。模型组、SVF低浓度组、SVF中浓度组和SVF高浓度组大鼠的双侧膝关节腔内各注射20 mg/ml碘乙酸50 μl复制KOA模型,正常组大鼠注射等量生理盐水。1周后分别向SVF低、中、高浓度组大鼠双侧后肢膝关节腔各注射50 μl低、中、高浓度SVF,正常组和模型组大鼠双侧膝关节腔注射等量生理盐水,1次/周,连续4次。(3)压痛阈值测定:使用YLS-3E电子压痛仪检测大鼠的压痛阈值。将大鼠放置于固鼠笼中,用扁型头对大鼠双侧后足背近节趾骨底连线进行施压,当大鼠因压痛而出现嘶叫或挣扎时显示的压力值为大鼠的压痛阈值。实验开始前先测定基础阈值,再分别于模型复制后第2、4周检测痛阈。(4)膝关节软骨组织病理学观察:最后1次痛阈测试结束后,10%水合氯醛麻醉处死大鼠并取5组大鼠双侧膝关节于4%多聚甲醛固定48 h,用EDTA脱钙8周,酒精逐级脱水,石蜡包埋后用切片机将胫骨外侧和股骨外侧髁软骨下骨松质沿下肢纵轴方向切片,切片厚度为5 μm。切片样本进行常规脱蜡复水,经清水冲洗后进行HE染色和SO染色、封片。光镜下观察组织的病理学改变,并按照OARSI软骨组织学评分标准[8]进行评分。
1.4 统计学方法 采用DPS 9.5更新版统计软件。以()表示。5组大鼠的痛阈值检测和OARSI评分均使用单因素方差分析,再采用LSD比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 五组压痛阈值检测结果比较 模型复制后第2周,模型组和SVF低、中、高浓度组的压痛阈值相较于正常组均显著降低,差异均有统计学意义(P<0.01);模型组和SVF低、中、高浓度组之间压痛阈值比较,差异均无统计学意义(P>0.05)。模型复制后第4周,模型组的压痛阈值低于正常组,差异有统计学意义(P<0.01);SVF低、中、高浓度组的压痛阈值与模型组比较均显著提高,差异均有统计学意义(P<0.01);SVF高浓度组的压痛阈值高于SVF低浓度组,差异有统计学意义(P<0.05)。见图 1。

图1 各组压痛阈值检测结果比较
2.2 五组大鼠膝关节软骨组织SO染色病理结果比较 与正常组比较,模型组大鼠膝关节软骨表层纤维化明显,软骨层明显变薄,软骨细胞重度肥大且严重丢失,软骨下骨呈现纤维化退变。低、中、高浓度的SVF对KOA模型大鼠关节软骨均有改善作用,其中SVF低浓度组软骨表面部分缺损,软骨层轻度变薄,少量软骨细胞轻度肥大,软骨下骨轻度纤维化退变;SVF中浓度组软骨表层纤维化,软骨层变薄,软骨细胞部分丢失,轻度软骨细胞肥大;SVF高浓度组软骨表层纤维化,软骨层变薄,软骨细胞部分丢失,软骨细胞中度肥大。见图2。

图2 各组大鼠膝关节软骨组织SO染色病理结果
2.3 五组大鼠膝关节软骨组织HE染色病理结果比较 与正常组比较,模型组大鼠膝关节软骨表面缺损明显,缺损处软骨细胞丢失严重,有大量重度肥大的软骨细胞,软骨下骨呈现纤维化退变。SVF低、中、高浓度组大鼠膝关节软骨与模型组比较,软骨形态明显改善。SVF低浓度组可见软骨表面轻度缺失,软骨细胞部分丢失,可见软骨细胞轻度肥大,软骨下骨部分纤维化;SVF中浓度组可见软骨表面平整,部分软骨细胞丢失,少量软骨细胞轻度肥大,软骨下骨纤维化;SVF高浓度组可见软骨表面平整,大量软骨细胞存活,少量软骨细胞肥大,部分软骨下骨纤维化。见图3。
2.4 五组大鼠膝关节软骨OARSI评分比较 模型组OARSI评分明显高于正常组,差异有统计学意义(P<0.01);SVF低、中、高浓度组的OARSI评分与模型组相较均显著下降,差异均有统计学意义(P<0.01),但SVF低、中、高浓度组之间比较,差异均无统计学意义(P>0.05)。见图 3。
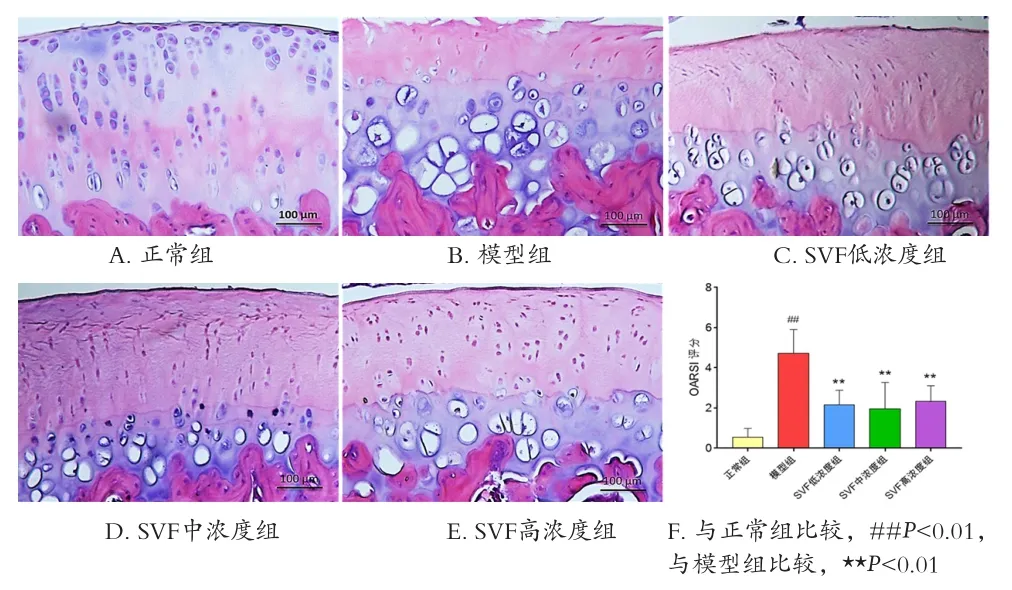
图3 五组大鼠膝关节软骨组织HE染色病理结果和OARSI评分
3 讨论
KOA起病于关节软骨,关节软骨缺乏血管和神经的支配,再生和自我修复能力有限,损伤后难以自我修复,继而逐渐侵蚀至软骨下骨及周围组织,从而引发膝关节部位疼痛不适、活动障碍和畸形[9-10]。SVF来源于脂肪组织,含有多种具有修复功能的细胞以及细胞因子,其中的主要成分ADSCs可分化为软骨细胞,促进软骨修复,有效抑制骨关节炎进展[11-12],此外,SVF中所含的细胞外基质具有支持营养作用,可加快组织重塑[13-14]。与ADSCs相较,SVF同样具有分化软骨细胞及成骨细胞的能力,且所含成分更多,拥有更强的治疗能力,去除脂肪组织中的成熟脂肪细胞即制备得到,在手术室便可完成,不需体外扩增,节省体外扩增时间,并避免了体外培养带来的污染等问题[15],因此SVF相较于ADSCs在治疗KOA方面有着一定优势。
碘乙酸主要是通过破坏关节软骨和周围滑膜韧带,改变关节腔原有的稳态[16],引起软骨基质的退行性改变、软骨细胞的破坏凋亡、滑膜炎性改变等造成KOA 模型[17]。POMONIS等[18]用碘乙酸复制 KOA 动物模型,认为碘乙酸与KOA疼痛相关,碘乙酸诱发的大鼠KOA具有较好的均一性和可比性。研究发现,ADSCs关节腔注射给药每周一次,持续4周,能修复受损的关节软骨,恢复关节功能[19]。每周关节腔注射给药一次,持续4周能达到较好的治疗效果,故作为关节腔给药的常用频次。
本研究疼痛阈值检测结果表明,SVF可促进关节软骨的修复,并有效提高KOA疼痛阈值,低浓度的SVF就可以达到良好的效果,且治疗效果与治疗浓度呈一定程度的正相关。关节组织病理结果表明,关节腔注射SVF具有减轻关节疼痛,促进关节软骨增殖修复等作用。实验中没有明显不良反应的发生,证明了SVF治疗的有效性和安全性。本研究主要不足之处为尚处于动物实验阶段,对SVF缓解疼痛、促进软骨细胞再生和(或)软骨祖细胞原位再生、受损关节软骨修复过程和具体机制尚不清楚。KOA的发生发展受多种因素影响,SVF不仅能够预防、治疗KOA,还可以阻止受损关节的进一步发展,甚至逆转KOA的发病机制,使之恢复正常,仍需要大量的基础实验和临床探索研究验证。
综上,SVF能有效缓解KOA疼痛,促进关节修复,低剂量就能有明显效果,具有获取方便、低剂量、安全、有效等优点,有进一步深入研究的潜在价值。
