短短芽孢杆菌JH3抗菌蛋白的分离纯化及其抗菌性能
2021-07-20闵建红龚国利
王 洁, 田 露, 闵建红, 李 慧, 龚国利
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
芽孢杆菌大多能产生小分子量的抗菌肽或大分子量的抗菌蛋白.根据其合成途径,主要分为两类:一类是由核糖体途径合成的抗菌物质,如:细菌素、类细菌素、抗菌蛋白等,其中芽孢杆菌分泌的细菌素(枯草菌素(Subtilin)、枯草杆菌蛋白酶(Subtilosin)[1]以及羊毛硫抗生素(Lantibiotics)[2])研究得较为深入;另一类是由非核糖体途径合成的分子量在300~3 000 Da之间的低分子肽类活性物质,如:伊枯草菌素(Iturin)[3]、表面活性素(Surfcatin)[4]、丰原素(Fengycin)[5]和杆菌霉素(Bacillomycin)[6].
短短芽孢杆菌(Brevibacillusbrevis)是一种需氧性的革兰氏阳性(G+)杆菌,主要分布在土壤、淤泥、岩石、灰尘等生态环境中[7].自短杆菌肽S(Gramicidin S,GS)被发现以来,许多研究学者将B.brevis看作是一种能产生多种抗菌物质的拮抗菌,展开了越来越多的相关研究[8].杨廷雅等[9]分离得到一株抑芒果炭疽病菌的菌株B.brevisHAB-5,经分离纯化后,发现该菌株主要抑菌活性物质是分子量为14.4 kDa的抗菌蛋白;Sheng Li等[10]从土壤中分离到了一株产几丁质内切酶的短短芽孢杆菌No.G1,该酶有超高的热稳定性,能够有效防治蔬菜中的病原霉菌;另有研究者发现短短芽孢杆菌Vm4菌株能产生阳离子肽Edeines,该肽具有广谱的抗菌功能.
本研究对B.brevisJH3所产的抗菌蛋白进行了分离纯化与鉴定,并测定了其抑菌谱,发现该蛋白具有广谱抑菌活性,可抑制多种食源性致病菌和植物病害真菌的生长.本研究将为该抗菌蛋白在更多领域的应用提供理论依据.
1 材料和方法
1.1 材料
1.1.1 菌株
(1)拮抗菌株:短短芽孢杆菌(B.brevis)菌株.
(2)细菌指示菌:蜡样芽孢杆菌(Bacilluscereus)、大肠杆菌(Escherichiacoli)、藤黄微球菌(Micrococcusluteus)、金黄色葡萄球菌(Staphylococcusaureus)、耐甲氧西林金黄色葡萄球菌(MRSA)、铜绿假单胞菌(Pseudomonasaeruginosa)、枯草芽孢杆菌(Bacillussubtilis)、宋内氏志贺氏菌(Shigellasonnei)、产气大肠杆菌(Enterobacteraerogenes)、斯氏李斯特菌(Listeriaseeligeri).
(3)真菌指示菌:苹果树腐烂病菌(Valsamali)、小麦赤霉菌(Fusariumgraminearum)、番茄灰霉菌(Botrytiscinerea)、马铃薯干腐病菌(Fusariumsolani)、水稻瘤矮病毒(Rice Gall Dwarf Virus,RGDV).
1.1.2 主要试剂与仪器
(1)主要试剂
聚乙二醇20000(天津市科密欧化学试剂有限公司);Tris-base、标准分子量蛋白(上海生工生物工程有限公司);滤膜、透析袋、DEAE纤维素及葡聚糖凝胶(北京瑞达恒辉科技发展有限公司).
(2)主要仪器
TGL-16M高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);FD-1A-80冷冻干燥机(上海比朗仪器制造有限公司);EASY-nLC1200高效液相色谱仪、Q-Exactive质谱仪和Thermo Multiskan GO酶标仪(赛默飞世尔科技有限公司);Mini-PROTEAN Tetra TM Bio-rad蛋白电泳仪(北京赛百奥科技有限公司).
1.1.3 试验培养基
NB培养基:牛肉膏5 g/L,蛋白胨10 g/L,NaCl 5 g/L,pH 7.2;NA培养基:牛肉膏5 g/L,蛋白胨10 g/L,NaCl 5 g/L,琼脂15 g/L,pH 7.2;发酵培养基:糊精15 g/L,Tween-20 0.99%,蛋白胨23.06 g/L,CaCl21.5g/L,pH 7.5;改良马丁培养基:蛋白胨5 g/L,酵母浸粉2 g/L,葡萄糖20 g/L,磷酸氢二钾1 g/L,硫酸镁0.5 g/L,pH 6.4±0.2.
1.2 实验方法
1.2.1 抗菌蛋白粗提液的制备
将短短芽孢杆菌菌株种子液按8%接种量接种于发酵培养基中,30 ℃,200 rpm振荡培养70 h后,4 ℃,12 000 rpm离心30 min,除去菌体.采用硫酸铵分级沉淀法提取粗蛋白[11].在上清液中添加硫酸铵至饱和度分别为20%、30%、40%、50%、60%、70%和80%,4 ℃下静置过夜后,4 ℃,12 000 rpm离心20 min,分别收集沉淀和上清液.沉淀溶于0.01 mol/L pH 7.6的Tris-HCl缓冲液后,透析脱盐得粗蛋白.以蜡样芽孢杆菌为指示菌,分别测定不同饱和度硫酸铵沉淀下来的粗蛋白抑菌活性,确定最佳硫酸铵饱和度.
1.2.2 抗菌蛋白的分离纯化
(1)DEAE-52阴离子交换层析:分别用浓度为0.05 mol/L、0.1 mol/L、0.2 mol/L、0.3 mol/L、0.4 mol/L、0.5 mol/L、0.7 mol/L、0.9 mol/L和1.0 mol/L的NaCl溶液对最佳硫酸铵饱和度的沉淀进行洗脱,流速以0.5 mL/min恒速进行.收集各个洗脱峰,透析脱盐后浓缩.浓缩后的样液冷冻干燥后做抑菌实验,选取最大抑菌活性峰.
(2)葡聚糖凝胶层析:Sephadex G-100凝胶溶胀后装柱,用Tris-HCl缓冲液浸泡过夜备用.将离子柱层析得到的冻干浓缩样品配制成浓度为10 mg/mL的溶液,取2 mL上样等梯度洗脱3个以上柱体积,流速0.3 mL/min,每10 min收集一管,280 nm波长处检测各个洗脱组分,经透析脱盐和冻干浓缩后检测抑菌活性,选出抑菌活性最强的组分.
1.2.3 抗菌蛋白纯度鉴定和分子量测定
采用Bio-Rad Mini-PROTEAN Tetra型电泳槽对样品进行SDS-聚丙烯酰胺凝胶电泳后,用染色液在40 rpm摇床中染色1 h,清洗凝胶后用脱色液脱色处理直至蛋白质区带清晰.利用凝胶成像系统拍照后,凝胶样品可保存于5%的乙酸及dd H2O中[12,13].
1.2.4 抗菌蛋白的液质联用(HPLC-MS/MS)分析
将制得的考马斯亮蓝染色的单一条带切下,参考胶内酶解[14]的方法酶解蛋白.提取肽段干燥后采用液质联用(HPLC-MS/MS)进行分析鉴定.蛋白条带经过脱色、酶解和冻干后,先用Nano-HPLC液相色谱分离,后用Q-Exactive质谱仪(Thermo Scientific)来分析鉴定.质谱数据处理采用Proteome Discoverer 2.3软件(Thermo Scientific)进行,选择Uniprot-Brevibacillus+brevis数据库进行搜索.将质谱原始数据提交至Sequest服务器,由Uniprot-Brevibacillus+brevis数据库和原始数据通过Proteome Discoverer鉴定蛋白信息.
1.2.5 抗菌蛋白抑菌谱测定
采用滤纸片法测定抗菌蛋白对常见的食源性致病菌和农作物病害真菌的抑菌活性.将细菌、真菌菌悬液均匀涂布于NA培养基(真菌为改良马丁培养基)上,得到指示菌平板,在平板上放无菌滤纸片,每个滤纸片上样量为20μL,以无菌水作对照.将细菌37 ℃培养24 h,真菌28 ℃培养48 h,测定抑菌活性.
2 结果和讨论
2.1 不同饱和度硫酸铵的盐析效果
对发酵液分级盐析后的粗蛋白的抑菌活性进行测定,以蜡样芽孢杆菌为指示菌.结果发现,不同饱和度硫酸铵盐析后粗蛋白的抑菌活性差异较大,当硫酸铵饱和度为30%时其抑菌活性最强(如图1所示).因此,为达到最佳盐析效果,选取饱和度为30%的硫酸铵进行后续实验.

图1 硫酸铵分级沉淀JH3菌株培养液的蛋白对蜡样芽孢杆菌的抑菌活性
2.2 抗菌蛋白的分离纯化
将饱和度为30%的硫酸铵沉淀和透析得到的粗蛋白进行DEAE-52离子交换层析,得到6个蛋白洗脱峰(如图2所示).经抑菌活性检测,发现6个蛋白洗脱峰中只有第2个峰所代表的组分具有抑菌作用.因此,进一步将峰2的样品大量收集后经Sephadex G-100凝胶过滤层析,获得峰2-1和峰2-2两个蛋白吸收峰(如图3所示).经抑菌活性测定后显示峰2-2代表的组分具有强抑菌活性(如图4所示),据此可推测短短芽孢杆菌B.brevisJH3所产具有广谱抗菌活性的抗菌蛋白为峰2-2所代表的组分.

图2 抗菌蛋白的DEAE-52离子交换层析纯化结果

图3 抗菌蛋白的Sephadex G-100洗脱曲线

a:Sephadex G-100峰2-1;b:Sephadex G-100峰2-2
2.3 抗菌蛋白的纯度鉴定和分子量测定
聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,简称PAGE),是以聚丙烯酰胺凝胶作为支持介质的一种常用电泳技术,用于分离蛋白质和寡核苷酸.因此,本实验利用SDS-PAGE对上一步浓缩冷冻干燥后的活性峰2-2代表的组分进行电泳检测,结果仅出现一条单一条带,分子量约为32 kDa,可初步证明该抗菌蛋白为单一组分(如图5所示).
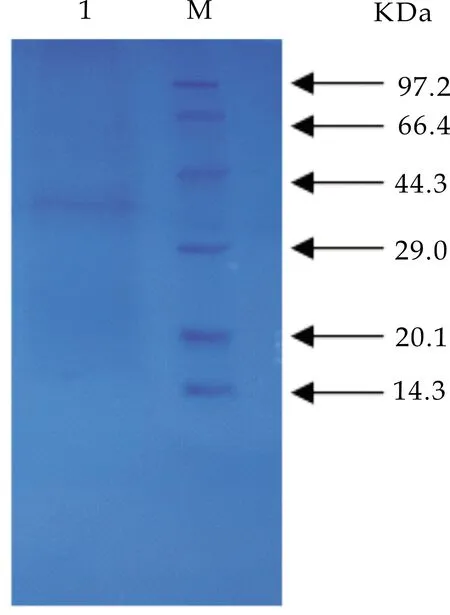
图5 短短芽孢杆菌JH3抗菌蛋白的SDS-PAGE电泳图
2.4 抗菌蛋白的HPLC-MS/MS质谱分析
为了进一步对该抗菌蛋白进行鉴定,将电泳得到的单一条带酶解后,采用HPLC-MS/MS对该条带组分进行分析,将获得的氨基酸序列信息在Uniprot数据库进行比对,最终获得了10条具有代表性的肽段序列(如表1所示).

表1 肽段序列信息
根据匹配蛋白登录号,对获得的10个蛋白进行详细分析,从中选取了3个分子量接近32 kDa的蛋白质,分别为延伸因子Tu蛋白、琥珀酸-CoA连接酶亚基α和鞭毛蛋白(如表2所示).然而目前未见有关延伸因子Tu蛋白和琥珀酸-CoA连接酶亚基α具有抑菌活性的相关报道.鞭毛蛋白的抑菌活性研究也相对较少,胡梁斌等[15]从油菜菌核病菌感染的油菜茎秆上分离到一株广谱拮抗枯草芽孢杆菌,同时克隆了该菌B-FS01鞭毛蛋白FCD基因片段,并证明其对农作物病原真菌,特别是对小麦赤霉病菌有较好的拮抗效果.据此,可推测本研究中具有抗菌活性的蛋白为鞭毛蛋白.

表2 延伸因子Tu蛋白、琥珀酸-CoA连接酶亚基α和鞭毛蛋白信息
2.5 抗菌蛋白的抑菌谱测定
为了检测该抗菌蛋白的抑菌谱,本实验以15种病原菌为指示菌株,采用滤纸片法进行测定.结果显示该蛋白具有广谱的抑菌活性,对多种病原菌都具有明显的抑菌效果(如表3所示),包括革兰氏阳性菌:金黄色葡萄球菌、斯氏李斯特菌和藤黄微球菌,革兰氏阴性菌:宋内氏志贺氏菌、产气大肠杆菌和大肠杆菌在内的多种病原菌.且对细菌类的蜡样芽孢杆菌和真菌类的番茄灰霉菌的抑制效果最好.由此可以看出,B.brevisJH3产生的抗菌蛋白具有广谱的抑菌活性,对多种食源性致病菌和常见的植物病害真菌都有较好的抑菌效果.

表3 抗菌蛋白的抑菌谱
3 结论
本研究采用常规的蛋白分离纯化方法对短短芽孢杆菌JH3的抗菌蛋白进行了分离纯化,并得到分子量为32 kDa的抗菌蛋白.通过质谱对其进行鉴定,初步鉴定为鞭毛蛋白.进一步检测了该抗菌蛋白的抑菌谱,发现其抗菌活性显著,且具有广谱性,对多种食源性致病菌和植物病害真菌都有较好的抑制作用.该抗菌蛋白有望应用于农作物真菌病害的生防试剂,也可作为饲料添加剂或食品防腐剂应用于畜牧业和食品工业.
