IAA 高产菌-农杆菌(Agrobacterium)对小球藻生长代谢的影响
2021-07-20张安龙孙文昕苏琰儒陈佳琛刘珂轶
张安龙, 孙文昕, 苏琰儒, 陈佳琛, 刘珂轶, 张 波*
(1.陕西科技大学 环境科学与工程学院,陕西 西安 710021;2.山西大同大学 医学院,山西 大同 037000)
0 引言
近年来,通过构建藻-菌共生体系以提高微藻生物量和废水处理效率受到了广泛的关注.研究表明,土壤、废水等环境中存在着多种功能菌能与微藻形成稳定的共生体系,微藻的生物量积累能力、含油量和叶绿素含量都可得到显著提高.现有的研究大多集中在特定外源菌群对微藻生长的影响,对于微藻培养体系自然形成的复杂微生态系统中大量细菌对微藻培养的影响缺乏深入的认识.
吲哚-3-乙酸(Indole-3-acetic acid,IAA)作为植物体内普遍存在的内源生长素参与调节植物生命活动的诸多方面[1,2](如调节细胞分裂、伸长与分化、开花、落叶、果实成熟、营养分布等).自然界中不仅植物可以合成IAA,许多微生物同样具有分泌IAA的能力,在参与植物与细菌的互作,调节植物根际微生态环境发挥着重要的作用.
近年的研究发现IAA对微藻的生长亦产生重要影响.Yu等[3]研究表明20 mg/L的生长素可促进栅藻生物质产率增加59.3%,并发现生长素可导致微藻细胞膜上质子泵的活化,促进H+外排,致使培养基pH降低,维持微藻在适宜的pH范围生长.近年的研究显示,低浓度的IAA可以提高微藻光合效率,显著增加微藻生物量,同时对细胞内脂肪酸、色素积累有一定促进作用[4-7].另一方面,生长素可促进细胞内RNA和蛋白质合成,为细胞合成提供所需原料.韩松芳通过代谢组学的方法证实了在IAA作用下,斜生栅藻细胞内TCA循环、磷酸戊糖途径与嘌呤代谢途径活力增强,为斜生栅藻的生长分裂提供更多的能量与必要的物质准备[8].
最新的研究发现,微藻培养体系自然形成的微生态系统中存在着大量IAA产生菌,这些细菌与微藻共培养是提高微藻产量的有效途径.Amin等[9]在NATURE上发文报道了Sulfitobacter可以产生IAA促进硅藻的分裂,同时硅藻也会产生IAA合成的前体物质(色氨酸)提高细菌的IAA分泌能力.Guo-Hua Dao研究从微藻Scenedesmus sp.培养体系中分离26株微藻促生菌,其中10株具有产IAA能力,提出植物激素分泌菌和微藻构建共生体系将成为重要的微藻增产方式[10].
微藻培养体系中IAA的存在会对微藻的生长代谢产生重要影响,已有研究证实在各类非生物胁迫下(氮缺乏、高光、高氨氮等),微藻细胞内过量的活性氧(ROS)积累,IAA可以增强微藻细胞内抗氧化酶活性和抗氧化表达,与ROS相互作用清除体内自由基,使得细胞处于氧化还原平衡状态,进而缓解氧化应激能力和降低氧化性损伤,促进微藻细胞分裂和油脂积累,稳定和提高微藻生物量[11].之前的研究已经证明在藻类环境中普遍存在IAA分泌菌,但研究其对微藻抗氧化系统的影响以及从转录组学的分析鲜有报道.因此,本研究以一株分离自小球藻培养体系中的IAA高产菌-农杆菌(Agrobacterium)为研究对象,从生物量积累-抗氧化系统响应-转录组学不同层次揭示了农杆菌(Agrobacterium)对藻细胞生长代谢的影响机制.
1 实验部分
1.1 微藻与细菌培养
小球藻(Genbank:MT605427)分离自陕西科技大学人工湖.取灭菌后的BG11培养基150 mL 置于250 mL锥形瓶中,接种微藻悬液至初始OD540为0.2.将小球藻培养液于光强4 000 lx,温度28±2℃,光暗周期为14 L:10 D条件下培养7天.
农杆菌Agrobacterium(Genbank:MW295829)分离自小球藻BG11培养基体系,其30 h的IAA产量可以达到34.18 mg/L[12].菌液接种于LB液体培养基中,并置于摇床(温度28 ℃,转速150 rpm)培养24 h.菌液OD600达到1.0时,经10 000 rpm离心5 min,取1 mL上清于150 mL微藻培养体系中,用于检测农杆菌对微藻生长的影响.
1.2 药品和试剂
蛋白胨、牛肉膏、氯化钠等药品(分析纯),购自天津市科密欧化学试剂有限公司;考马斯亮蓝G-250(分析纯),购自天津市科密欧化学试剂有限公司;牛血清蛋白(分析纯),购自西安沃尔森生物技术有限公司;超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量测定测试盒,均购自苏州科铭生物技术有限公司.
1.3 微藻生长的测定
取10 mL微藻悬液4 ℃,1 400 rpm离心10 min,藻细胞用磷酸缓冲液(PBS)洗涤两次.将细胞重悬于2 mL浓度为80%的丙酮溶液中,在4 ℃黑暗条件下悬浮1 h.然后,再次离心(4 ℃,12 000 rpm 10 min),取上清分别在645 nm和663 nm波长处测定吸光度,通过公式(1)计算样品中叶绿素a浓度:
(1)
式(1)中:Chla(mg/L)为叶绿素a浓度;ABS663和ABS645分别为上清液在663 nm和645 nm波长处的吸光度.
比生长率(SGR,d-1)由微藻叶绿素的浓度和培养时间通过公式(2)确定:
μ=(lnNt-lnN0)/t
(2)
式(2)中:N0为初始日叶绿素a浓度,Nt为第t天[13]测得的叶绿素a浓度;t为培养时间.
1.4 可溶性糖和蛋白的测定
取20 mL藻液离心,藻泥加入50 mL PBS缓冲液,混匀后低温超声20 min,并于-80 ℃冻融循环3次,离心后上清液用于测定可溶性糖和蛋白的含量.可溶性糖和蛋白含量的测定分别采用硫酸蒽酮法[14]和考马斯亮蓝法[15].
1.5 微藻抗氧化酶活性以及丙二醛含量的测定
取20 mL藻液,在4 ℃、10 000 rpm条件下离心10 min后弃上清.藻泥加入1 mL 0.02 M PBS缓冲液,冰水浴条件下超声30 min待藻细胞充分破碎后,再次于10 000 rpm离心10 min,上清液即为微藻粗酶液.用超氧化物歧化酶(SOD)和丙二醛(MDA)试剂盒对SOD活性以及MDA含量进行测定.
1.6 微藻转录组测序及分析
为探究农杆菌通过IAA分泌作用对微藻生长代谢的影响,分别设置单一小球藻培养体系,添加0.2 mg/L IAA小球藻培养体系以及添加1 mL农杆菌上清的小球藻培养体系共三个微藻培养体系进行微藻转录水平的测序以及表达差异分析.取对数生长期的微藻培养物样品,收集后送北京诺禾致源生物信息科技有限公司提取mRNA,经反转录和PCR,用AMPure XP beads纯化PCR产物,得到最终的文库,库检合格后进行Illumina HiSeqTM双端测序.通过CASAVA碱基识别分析得到的原始数据(raw reads),以FASTQ文件格式存储(Cock et al,2010).将这些序列信息进行质量评估,通过Trimmomatic进行质量剪切,得到可用序列(clean reads),用Trinity对其进行混合拼接(Grabherr et al,2011),将测序所得的序列拼接成转录本,用Corset程序进行层次聚类(Davidson et al,2014),得到FASTA格式文件.采用NCBI Blast+将转录本与NR、KEGG、KOG、Swissprot、TrEMBL等多个数据库进行比对,得到其功能注释信息(Camacho et al,2009).根据转录本与Swissprot、TrEMBL的注释结果得到GO功能注释信息.基于差异分析结果,绘制韦恩图、GO注释分类图等.
2 结果与讨论
2.1 农杆菌对小球藻生长的影响
为了确定农杆菌对小球藻生长的影响,将经含色氨酸和不含色氨酸的农杆菌培养物离心,取1 mL上清液加入到微藻培养体系,其中IAA浓度可达到0.25 mg/L和0.02 mg/L,每天测定共培养体系中小球藻细胞的叶绿素a的浓度,并计算小球藻培养1周时的比生长速率.
如图1(a)所示,在添加农杆菌上清液(含或不含色氨酸)作用下,小球藻的叶绿素a含量分别为2.47 mg/L和2.01 mg/L,达到纯藻体系的1.73倍和1.41倍.因此,作为IAA合成前体,色氨酸的加入可以进一步提高细菌产生IAA,进而间接促进小球藻的生长.可以推断,农杆菌对小球藻生长的促进作用确实是由于细菌分泌的IAA对微藻培养体系的影响.
如图 1(b)所示,与添加相当浓度水平的外源IAA相比,农杆菌对小球藻的生长具有更高的促进作用.对于细菌的促藻效应而言,IAA的作用并不是孤立存在的,与此同时,藻菌之间的营养互作,信号交流等都在同时相互作用与影响[16].因此,利用IAA分泌菌构建藻菌共生体系比直接应用外源IAA更能有效地提高微藻生物量积累效率[12].此外,与单一微藻培养体系相比,藻菌共生体系具有丰富的物种多样性,更有利于微藻培养体系的稳定和持续运行.
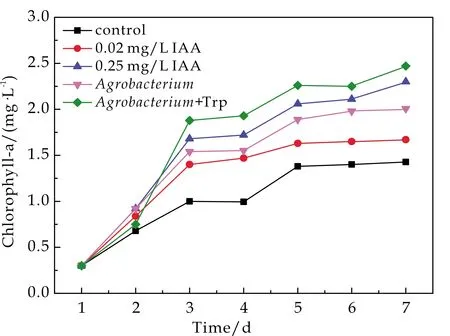
(a)小球藻叶绿素a含量
2.2 农杆菌对小球藻可溶性糖和蛋白含量的影响
微藻中的多糖和蛋白质具有抗氧化、抗病毒和抗衰老等生物学作用,且在免疫学、细胞生物学和分子生物学等方面具有广泛的前景[17].微藻中的多糖和蛋白质等生物大分子可以调控藻细胞的生理生化特性,与微藻的生物膜形成、生物量积累以及絮凝等密切相关[18,19].
图2显示了0.02 mg/L IAA以及农杆菌对小球藻可溶性糖和蛋白含量的影响.随着培养时长的增加,小球藻可溶性糖和蛋白的含量均呈上升趋势.在农杆菌作用下,小球藻可溶性糖和蛋白含量分别达到纯藻的1.34倍和1.43倍,而添加0.02 mg/L IAA仅能分别提高1.25倍和1.17倍.农杆菌与小球藻共培养体系中既存在IAA,也有其他植物激素和群体感应信号分子等物质,对小球藻的可溶性多糖和蛋白质等生物大分子具有一定的影响[20].因此,农杆菌比外源IAA更能提高微藻可溶性糖和蛋白的含量.IAA可促进微藻在生长过程中合成多糖和蛋白质等生物大分子,它们更有利于细胞生长和能量储存,在外界刺激中保护细胞免受有毒有害物质侵入[19],提高微藻细胞的生命活动,有益于微藻生长.
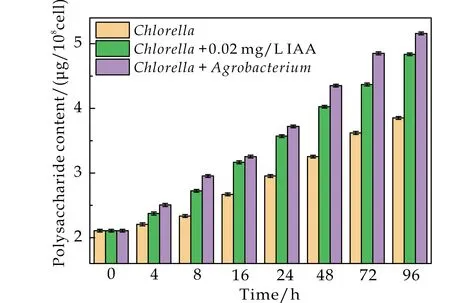
(a)小球藻可溶性糖含量
2.3 农杆菌对小球藻抗氧化系统的影响
超氧化物歧化酶(SOD)是生物体内存在的一种重要的抗氧化酶,它能够调节氧化和抗氧化系统,修复受损细胞和复原自由基,在微藻中起到至关重要的作用[21-23].此外,丙二醛(MDA)也可反应机体的抗氧化能力以及过氧化速率,引起蛋白质和核酸等生物大分子交联聚合,进而发生细胞代谢和功能障碍,甚至导致细胞损伤和死亡[24].
如图 3 所示,在IAA和农杆菌作用下,随着小球藻培养时长的增加,SOD活性呈先上升后下降的趋势,而MDA含量呈先下降后上升的趋势.在48 h小球藻的SOD活性达到最高,而MDA含量最低,表明IAA激活了小球藻细胞的防御性反应,减轻氧化应激的能力,增加抗氧化酶活性,显著降低MDA含量,促进了小球藻细胞的生长[20,22].IAA 可调节微藻细胞中多种生理生化过程,缓解藻细胞应激能力,减轻氧化损伤和提高抗氧化酶活性,对微藻的生长具有极好地促进作用[25].此外,与添加相当浓度水平的外源IAA相比,农杆菌对小球藻SOD活性和MDA含量的影响更加显著.在藻菌共生体系中,不仅有IAA对藻细胞的作用,同时存在萘乙酸(NAA)、吲哚丁酸(IBA)和赤霉素(GA)等植物激素可调节藻细胞内ROS水平、脂质合成相关基因表达和酶活性,增加抗氧化酶活性,进而促进藻细胞生物量生产效率和脂质合成速率[12].
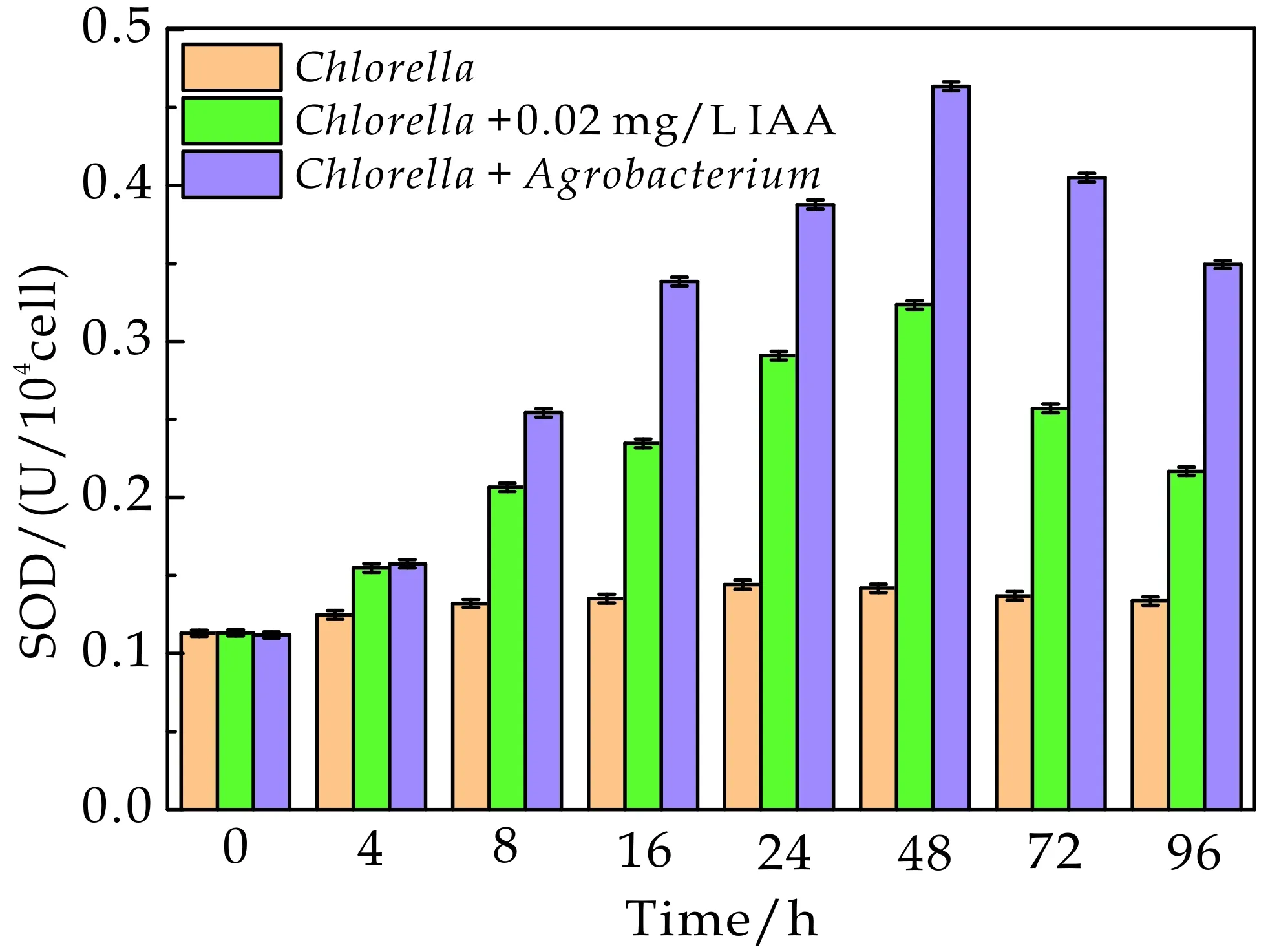
(a)小球藻超氧化物歧化酶活性
2.4 转录组分析
2.4.1 数据评价
单一小球藻培养体系,添加 0.2 mg/L IAA小球藻培养体系以及添加1 mL农杆菌上清的小球藻培养体系共三个微藻培养体系分别记作CK、IAA和Bact,取以上三个体系对数生长期的微藻培养物样品,提取mRNA,经反转录和PCR,用AMPure XP beads纯化PCR产物,得到最终的文库,库检合格后进行Illumina HiSeqTM双端测序.将这些序列信息通过FastQC进行质量评估,通过Trimmomatic进行质量剪切,得到可用序列(clean reads),用Trinity对其高质量序列进行混合拼接,获得了Unigene(Grabherr et al,2011).
以上三个体系的测序概况见表1所示.CK、IAA和Bact分别获得的Total Reads Count为61708288、49505344、54366650.Q10(质量值大于等于10的碱基所占百分比)的比例分别为99.29%、99.25%、98.94%,Q20(质量值大于等于20的碱基所占百分比)的比例分别为 97.72%、97.58%、96.66%,Q30(质量值大于等于 30 的碱基所占百分比)的比例均大于 91%,表明测序质量较高,测序结果可靠,可用于后续的生物信息学分析[26].
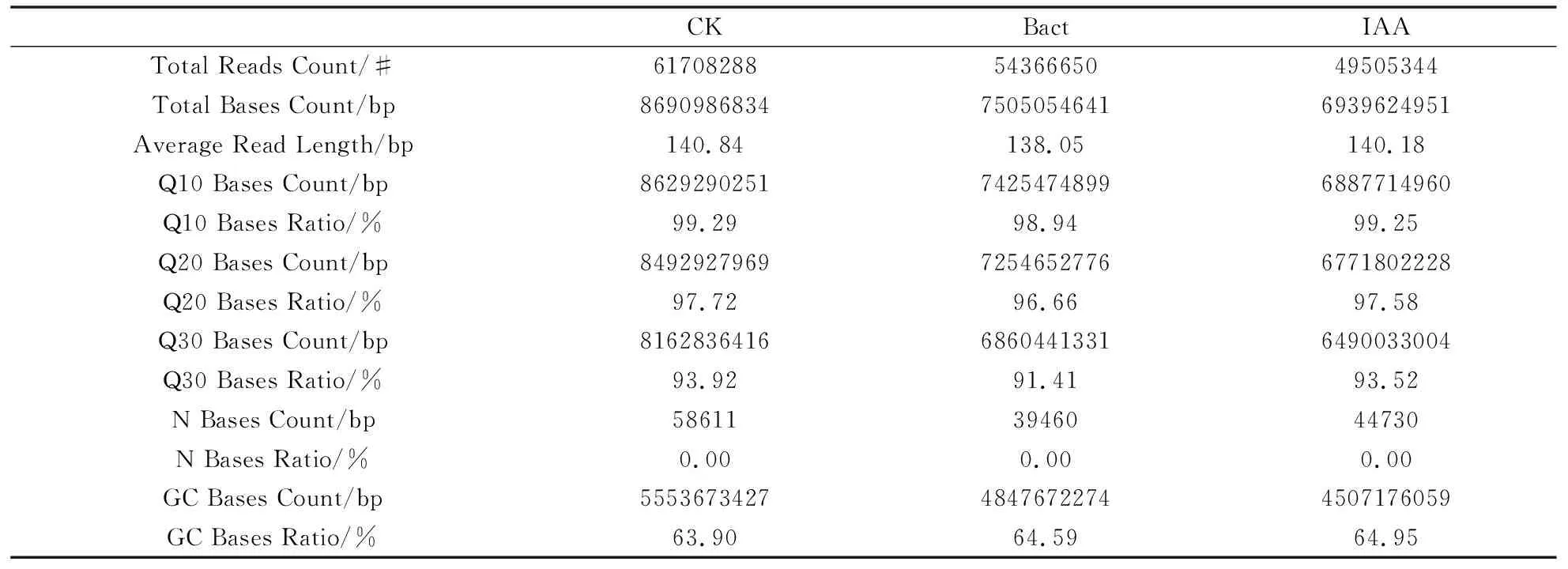
表1 样本QC数据信息统计
2.4.2 功能注释
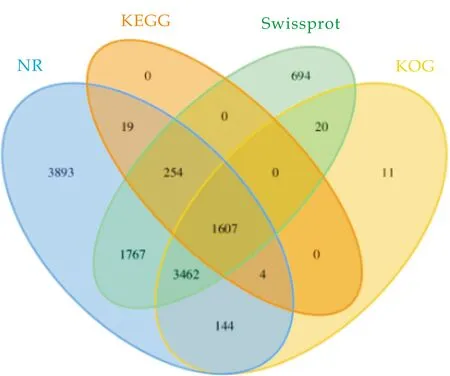
将CK、IAA和Bact高质量的测序数据与拼接所得的Unigenes使用Blastx分别与NR、KEGG、Swissprot、KOG等多个数据库进行比对,以获得相应的功能注释信息,各数据库注释结果用Venn图(Camacho et al,2009).
如图4(a)所示,不同颜色的圆圈代表不同数据库,各圆圈中的数字代表注释到该库的基因数量,圆圈的交叉区域表示同时在两个库中注释到的基因个数[27].NR、KEGG、Swissprot、KOG等数据库中注释到的基因分别为11 150、1 884、7 804和5 248个,注释比率分别为53.13%、8.98%、36.18%和25.01%,且共有1 607个基因同时被以上数据库注释到.
对以上三个体系的unigene进行GO功能分类注释如图4(b)所示,GO注释主要包括分子功能(molecular function,F)、生物学过程(biological process,P)和基因的细胞组分(cellular component,C)三大类[28-30],其中细胞组分包含的unigene最多,共有30 694个.分子功能和生物过程共有12 808和26 106个unigene.在分子功能(molecular function)中催化活性(catalytic activity)、连接(binding)和转运活性(transporter activity)的unigene最多,分别为5 496、5 395和800,且比例分别为42.9%、42.1%和6.2%.在生物过程(Biological process)中细胞过程(cellular process)和代谢过程(metabolic process)的unigene最多,分别为5 720和5 174,且比例分别为21.9%和19.8%.在细胞组分(Cellular component)中细胞(cell)、细胞组分(cell part)、细胞器(organelle)和膜(membrane)的unigene最多,分别为6 478、6 461、4 672和3 619,且比例分别为21.1%、21.0%、15.2%和11.8%[31].
(a)基因功能注释信息统计图
2.4.3 差异基因表达
以单一小球藻培养体系为对照组(CK),如图 5 所示,比较添加 0.2 mg/L IAA小球藻培养体系(IAA)以及添加1 mL农杆菌上清的小球藻培养体系(Bact)的差异表达基因.
由图5(a)可知,差异表达基因根据表达水平情况分上调表达基因(Up-regulated gene)和下调表达基因(Down-regulated gene)(红色代表上调的基因数目;绿色代表下调的基因数目)[32].IAA和Bact显著上调unigene分别有1 394和1 115个,有246和 966个显著下调基因.整体来看,Bact注释到差异基因更多且大多unigene表现为上调.
如图5(b)所示,不同颜色的圆圈交叉处数目表示共有基因数目,同一圆圈内部所有数目之和表示该对比总差异基因个数[27].与 CK 相比,IAA和Bact特有的差异基因分别为692和1 133个,且两者共同的差异基因有948个.差异基因功能富集分析显示,其中生物过程和分子功能基因表达差异显著,其主要生物学功能与细胞过程(cellular process)、代谢过程(metabolic process)催化活性(catalytic activity)和连接(binding)有关[33].整体来看,Bact注释到的差异基因比IAA多,因为相较于在微藻体系中直接加入外源IAA,在藻菌共生体系中,微藻与细菌通过基因交换、信号转导和营养互作的方式相互作用,共生环境更加复杂[34].在藻菌共生体系中,细菌对微藻不仅存在IAA的作用,营养物质、群体感应信号分子等其他的一些物质也发挥着重要的作用,进而可以推测出IAA分泌菌比添加外源IAA对微藻生长有更好的促进作用[35].
3 结论
与添加相当浓度的外源IAA相比,农杆菌对小球藻的生长具有显著的促进作用;农杆菌也可增加小球藻可溶性糖和蛋白的含量,分别达到纯藻体系的1.34倍和1.43倍.此外,在农杆菌作用下小球藻培养48 h,其SOD活性达到最高,而MDA的含量最低.转录组学分析结果显示:对基因进行GO功能分类注释,细胞组分包含的unigene最多.与纯藻体系相比,添加细菌体系和添加外源IAA体系显著下调unigene分别有246和966个,显著上调unigene分别有1 394和1 115个,且有948个共同的差异基因.富集分析显示,差异基因主要富集在生物过程中的细胞过程(cellular process)、代谢过程(metabolic process)以及分子功能中的催化活性(catalytic activity)、连接(binding)过程.
