LINC00607通过抑制miR-372影响A549/DDP细胞的增殖和凋亡
2021-07-19杨汶川
杨汶川,韩 东,杨 帆
(临沂市第三人民医院,山东 临沂 276004)
肺癌(lung cancer)是对人类健康和生命威胁最大的恶性肿瘤之一。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的85%,以顺铂(dichlorodiammine platinum,DDP)为基础的联合化学药物治疗(简称化疗)是晚期NSCLC的重要治疗手段[1]。然而,顺铂耐药是影响化疗效果、导致治疗失败的主要原因。因此,了解NSCLC细胞的化疗耐药机制,制定有效治疗方案、提高生存率至关重要。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200 bp的非编码RNA,具有多种功能和复杂的调控机制,参与了包括所有细胞增殖、凋亡和化疗耐药在内的多种生理或病理过程。LINC00607(long intergenic non-coding RNA00607)位于染色体2q35位点,肝癌中LINC00607表达降低,上调其表达可抑制肝癌细胞增殖,增加细胞凋亡和对阿霉素、5-氟嘧啶的敏感性[2]。肺腺癌中LINC00607表达下调可能与肺癌进展有关[3]。miR-372属于miR-371~373簇,研究显示miR-372上调与胃癌细胞DPP耐药有关,下调miR-372可抑制耐药胃癌细胞增殖,促进细胞凋亡,降低DDP耐药性[4]。序列分析发现miR-372是LINC00607的潜在靶序列,miR-372已被证实与NSCLC细胞的异常增殖和转移有关[5]。本研究通过分析NSCLC组织、人肺腺癌顺铂耐药细胞系A549/DDP中LINC00607、miR-372表达水平,探讨恢复其表达对A549/DDP细胞增殖和凋亡的影响,以期为临床DDP耐药NSCLC的治疗提供新的靶点。
1 材料与方法
1.1 实验材料
1.1.1 细胞及试剂:人肺腺癌细胞系A549和顺铂耐药细胞系A549/DDP(中国典型培养物保藏中心);DDP(Sigma-Aldrich公司);RPMI-1640培养基、胎牛血清(Gibco公司);LipofectamineTM2000、cDNA第一链合成试剂盒、Trizol试剂盒和SYBR Green Masker Mix(Invitrogen公司);miRNA反转录试剂盒(GeneCopoeia公司);miR-372模拟物(miR-372 mimics)及其阴性对照(miR-NC)、LINC00607过表达载体(pcDNA3.1-LINC00607)及其阴性对照(pcDNA3.1)、双荧光素酶报告载体(上海吉玛制药公司);放射免疫沉淀测定(radioimmunoprecipitation assay,RIPA)裂解缓冲液、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒、膜联蛋白V-异硫氢光荧光素(annexin V-FITC)细胞凋亡检测试剂盒(上海碧云天生物科技公司);兔源Ki67抗体、兔源裂解的半胱氨酸天冬氨酸蛋白酶3(cleaved-caspase-3)抗体、兔源磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydro-genase,GAPDH)抗体(上海艾博抗生物技术公司)。
1.1.2 组织来源:收集2016年1月至2018年1月于山东省临沂市第三人民医院确诊并进行手术切除的24例NSCLC组织和相应癌旁组织(距离癌灶大于5 cm)。其中男性15例,女性9例。患者年龄35~78岁,中位年龄67岁。所有患者术前未接受放射治疗或化疗。研究经本院伦理委员会批准(伦理审批号:20160003),所有患者均签署知情同意书。
1.2 实验方法
1.2.1 细胞的分组和处理:A549细胞、A549/DDP细胞采用含10%的胎牛血清的RPMI-1640培养基于37 ℃、含5% CO2的细胞培养箱中培养,其中A549/DDP细胞培养液中间断添加终浓度为1 μg/mL的DDP以维持细胞的耐药性。实验前48 h更换为不含DDP细胞培养基。将对数期A549/DDP细胞接种6孔板,利用LipofectamineTM2000待细胞50%汇合时更换不含血清培养基进行细胞转染。根据转染物不同,将A549/DDP细胞分为pcDNA3.1组(转染pcDNA3.1)、pcDNA3.1-LINC00607组(转染pcDNA3.1-LINC00607)、(pcDNA3.1-LINC00607+miR-NC)组(共转染pcDNA3.1-LINC00607和miR-NC)、和(pcDNA3.1-LINC00607+miR-372)组(共转染pcDNA3.1-LINC00607和miR-372 mimics)。
1.2.2 实时荧光定量PCR(RT-qPCR)检测LINC00607和miR-372表达:按照Trizol使用说明书提取肺癌组织、癌旁组织、A549细胞、A549/DDP细胞的总RNA,利用cDNA第一链合成试剂盒、miRNA反转录试剂盒合成cDNA,利用SYBR Green Masker Mix试剂2-ΔΔCt法检测LINC00607和miR-372的相对表达水平。引物序列:LINC00607上游5′-ATGC CCTCTGTGCTGAAACT-3′,下游5′-TAATGGTGGTGG TGGAAACC-3′;GAPDH上游5′-CAGGAGGCATTG CTGATGAT-3′,下游5′-GAAGGCTGGGGCTCATTT-3′;miR-372上游5′-TCGACAAAGTGCTGCGACATT T-3′,下游5′-CTCAACTGGTGTCGTGGAGTCGGC-3′;U6上游5′-AAAGCAAATCATCGGACGACC-3′,下游5′-GTACAACACATTGTTTCCTCGGA-3′。
1.2.3 MTT法检测细胞活力:按照1×104个/孔,将各转染组A549/DDP细胞接种96孔板,每孔100 μL,培养48 h后,按每20 μL加入MTT(5 g/L)继续培养4 h,吸尽上清液,按每孔150 μL加入二甲基亚枫(DMSO)于摇床上振荡10 min,空白孔调零后,酶标仪检测450 nm处吸光度(A)值。细胞存活率=(A实验组/A对照组)×100%
1.2.4 集落形成实验检测集落形成数:按照2×102个/孔,每孔5 mL将各转染组A549/DDP细胞接种到直径为60 mm的平板,轻轻晃动平板使细胞分散均匀。常规培养,每3 d换液1次,当出现的肉眼可见的集落时,弃去细胞培养液,进行多聚甲醛固定、结晶紫染色。流水传给你去染液,干燥后,计数细胞克隆形成数。
1.2.5 流式细胞测量术检测细胞凋亡:收集5×105个各转染组A549/DDP细胞重悬于500 μL的1×结合缓冲液中,依次加入annexin V-FITC和碘化丙啶(propidium iodide,PI)各5 μL,避光反应15 min后混匀,流式细胞测量术检测细胞凋亡。
1.2.6 蛋白质印迹检测cleaved-caspase-3和Ki67蛋白表达:用RIPA裂解缓冲液提取各转染组A549/DDP细胞总蛋白,BCA法进行蛋白定量。按照每组30 μg蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),常规湿法将电泳分离的细胞蛋白转移PVDF膜。5%脱脂牛奶室温下封闭膜1 h,将膜与一抗(1∶500)在4 ℃下孵育过夜,洗膜后与二抗(1∶2 000)在室温下孵育2 h。加入化学发光显色试剂暗室显色后,以GAPDH为内参,图形处理软件分析目的蛋白相对表达水平。
1.2.7 双荧光素酶报告基因实验:将含有miR-372结合位点的LINC00607野生(WT)序列或含有miR-372结合位点的LINC00607突变(MUT)序列克隆到双荧光素酶报告基因载体中,构建双荧光素酶报告质粒载体WT-LINC00607和MUT-LINC00607。将WT-LINC00607、MUT-LINC00607分别与miR-372 mimics、miR-NC分别共转染到A549/DDP细胞,转染48 h,测定各组A549/DDP细胞相对荧光素酶活性。
1.3 统计学分析

2 结果
2.1 LINC00607和miR-372在肺癌组织中的表达
与癌旁组织比较,肺癌组织中LINC00607表达显著降低,miR-372表达显著升高(P<0.05)(表1)。

表1 LINC00607和miR-372在肺癌组织中的表达
2.2 LINC00607和miR-372在A549和A549/DDP细胞中的表达
与A549细胞比较,A549/DDP细胞中LINC00607表达显著降低,miR-372的表达显著升高(P<0.05)(表2)。
表2 LINC00607和miR-372在A549细胞和A549/DDP细胞中的表达
2.3 LINC00607对A549/DDP细胞增殖及凋亡的影响
与pcDNA3.1组比较,pcDNA3.1-LINC00607组A549/DDP细胞LINC00607表达显著升高,而miR-372表达显著降低,细胞存活率、集落形成数、Ki67蛋白表达显著降低,而凋亡率、cleaved-caspase-3蛋白表达显著升高(P<0.05)(图1,表3)。

表3 LINC00607对A549/DDP细胞增殖和凋亡的影响

图1 LINC00607对A549/DDP细胞凋亡(A)及cleaved-caspase-3、Ki67蛋白表达(B)的影响
2.4 LINC00607靶向miR-372
序列分析发现LINC00607与miR-372之间存在理论结合位点(图2)。双荧光素酶报告实验显示,miR-372 mimics和WT-LINC00607共转染组A549/DDP细胞的相对荧光素酶活性与miR-NC和WT-LINC00607共转染组比较显著降低(P<0.05);miR-372 mimics和MUT-LINC00607共转染组A549/DDP细胞的相对荧光素酶活性与miR-NC和MUT-LINC00607共转染组比较无显著变化(表4)。

表4 双荧光素酶报告实验

图2 LINC00607靶向miR-372
2.5 miR-372对LINC00607作用的A549/DDP细胞增殖凋亡的影响
与(pcDNA3.1-LINC00607+miR-NC)组比较,(pcDNA3.1-LINC00607+miR-372)组A549/DDP细胞miR-372表达显著升高,细胞存活率、集落形成数、Ki67蛋白表达显著升高,凋亡率、cleaved-caspase-3蛋白表达显著降低(P<0.05)(图3,表5)。
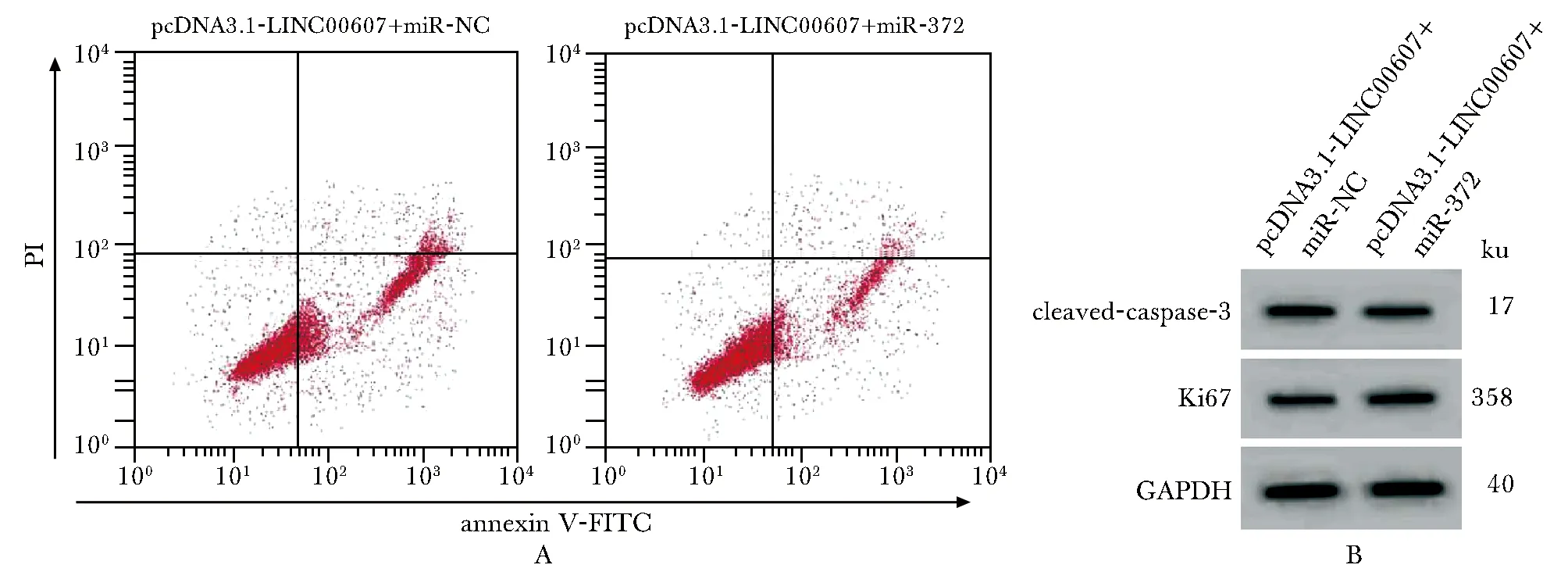
图3 miR-372对LINC00607作用的A549/DDP细胞凋亡(A)及cleaved-caspase-3、Ki67蛋白表达(B)的影响

表5 miR-372对LINC00607作用的A549/DDP细胞增殖凋亡的影响
3 讨论
DDP通过诱导DNA损伤、干扰DNA修复发挥抗肿瘤作用,广泛用于NSCLC、胃癌、卵巢癌等肿瘤的治疗。近年研究发现,lncRNA的异常表达与NSCLC的DDP耐药有关,如lncRNA AK001796、X染色体失活基因(X chromosome inactivation,XIST)在A549/DDP细胞中表达增加,恢复lncRNA表达水平通过降低细胞活力、抑制上皮间充质转化、阻滞细胞周期、诱导凋亡可提高其对DDP的敏感性[6-7]。LINC00607已被证实在肺腺癌组织中表达下调,且LINC00607低表达与肝癌术后复发、化疗耐药相关[2-3, 8]。因此,LINC00607在NSCLC细胞DDP耐药中的作用值得探讨。
本研发现NSCLC组织中LINC00607表达显著降低,A549/DDP细胞中LINC00607表达较A549细胞显著降低,说明LINC00607低表达可能与NSCLC细胞DDP耐药有关。转染pcDNA3.1-LINC00607上调LINC00607表达显著抑制A549/DDP细胞增殖,促进细胞凋亡。Ki67是与细胞分裂有关的核抗原,其表达水平高提示细胞增殖活跃、恶性程度较高,Ki67表达水平影响临床治疗疗效[9]。Cleaved-caspase-3是细胞凋亡的最终执行者,其活化可直接降解细胞内的结构蛋白和功能蛋白,导致细胞不可逆凋亡[10-11]。本研究发现,上调LINC00607表达显著抑制Ki67蛋白表达,促进cleaved-caspase-3表达,与功能分析结果一致,表明上调LINC00607可抑制A549/DDP细胞增殖,诱导细胞凋亡,具有抑癌作用。
多项研究表明,lncRNA通过与miRNA相互作用参与调控NSCLC细胞增殖、凋亡、耐药等生命进程。例如,敲减lncRNA XIST通过上调miR-144-3p可减少A549/DDP细胞增殖,诱导细胞凋亡,抑制耐药基因的表达,调控NSCLC细胞的化学药物敏感性[12]。miR-372已被证实参与多种肿瘤进展。研究显示,miR-372高表达促进NSCLC细胞增殖,增加侵袭潜能[13]。此外,沉默miR-372通过上调ZBTB7A激活TRAIL-R2还可以使口腔鳞状细胞癌对DDP敏感[14]。然而,LINC00607是否通过调控miR-372表达参与NSCLC细胞DDP耐药尚未被研究。本研究发现NSCLC组织中miR-372表达升高,A549/DDP细胞中miR-372表达显著高于A549细胞。进一步研究发现,miR-372是LINC00607的靶基因,且上调LINC00607能够降低miR-372表达水平。此外,上调miR-372表达还能够逆转上调LINC00607对A549/DDP细胞增殖和凋亡的影响,这进一步说明LINC00607通过下调miR-372参与调控NSCLC的DDP敏感性。
综上所述,LINC00607通过下调miR-372表达可抑制A549/DDP细胞增殖,诱导细胞凋亡,与NSCLC的顺铂耐药有关。LINC00607/miR-372分子轴有望成为NSCLC细胞DDP增敏靶点。
