IDH1调控干扰素通路相关基因IFIT3的表达
2021-07-19唐婉军彭小忠
唐婉军,彭小忠,2*,韩 为*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系 医学分子生物学 国家重点实验室 医学灵长类研究中心 神经科学中心, 北京 100005; 2.中国医学科学院 医学生物学研究所,云南 昆明 650118)
胶质瘤(glioma)是最常见的原发性中枢神经系统肿瘤。在胶质瘤中,异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)是最重要的分子标志物之一。胶质母细胞瘤(glioblastoma multiforme,GBM)属于恶性程度最高的胶质瘤,其中IDH1野生型较为常见,而IDH1突变型仅占10%[1]。与IDH1突变型患者相比,IDH1野生型患者预后较差,放射化学药物治疗(简称放化疗)效果不佳[1-2]。以往针对IDH1的研究多关注该催化酶发生突变后在代谢和基因调控中的作用[3],而野生型IDH1表达失调对基因表达的影响尚不清楚。IDH1在胶质瘤中的关键地位决定了对其进行广泛而深入研究的必要性。
RNA结合蛋白(RNA binding proteins, RBPs)通过RNA结合结构域与目的RNA相结合[4],在基因表达调控中发挥重要作用。RBPs广泛参与多种细胞生物过程,如中间代谢、抗病毒反应、信号传导和蛋白质代谢等,并且RBP-RNA相互作用网络的失调在肿瘤和神经退行性疾病中可作为一种驱动因素[5]。本研究旨在探究IDH1表达失调能否影响RBPs的表达,为进一步理解IDH1在胶质瘤中的关键作用提供更广阔的思路。
1 材料与方法
1.1 材料
1.1.1 细胞系:人神经胶质瘤细胞系LN229(ATCC)。
1.1.2 主要试剂:Trizol (Ambion 公司);RNA纯化试剂盒(Qiagen公司);反转录试剂盒(Vazyme公司);SYBR (TaKaRa公司);IDH1抗体(Abcam公司),IDH1R132H(Dianova公司),β-actin 抗体(Sigma-Aldrich 公司),慢病毒及感染试剂(上海吉凯基因有限公司)。
1.2 方法
1.2.1 慢病毒感染构建IDH1敲低、过表达和R132H突变的细胞株: 慢病毒载体构建和包装均委托上海吉凯基因有限公司。慢病毒感染细胞12~16 h后更换新鲜培养基, 后检测荧光蛋白表达情况。然后使用病毒载体携带其抗性基因的抗生素筛选细胞72 h左右,此时空白对照组细胞应全部死亡。提取各组细胞蛋白和RNA检测IDH1的表达水平以确认慢病毒感染效果。
1.2.2 RT-qPCR检测目的基因的表达:收取细胞后利用RNA纯化试剂盒提取细胞总RNA。使用反转录试剂盒将RNA反转录为cDNA。使用SYBR预混试剂及定量PCR仪进行实时荧光定量。每个样品设置3~4个复孔,以GAPDH作为内参计算样品的相对表达量。针对9个候选基因分别设计引物,并确认引物特异性。进行RT-qPCR检测候选基因在IDH1敲低、过表达和R132H突变的细胞株中的表达水平。
1.2.3 RNA-seq:将IDH1敲低组和对照组LN229细胞在6 cm细胞培养皿中培养,每组设置3个重复。待细胞汇合至70%左右,每个6 cm皿加入1 mL Trizol 收取细胞,送北京博奥晶典生物技术有限公司进行建库及高通量测序。
1.2.4 数据分析:利用limma进行差异表达基因分析,差异基因筛选标准为:|log2FC|≥1且P<0.05。利用KOBAS软件进行差异表达基因富集通路分析。比对RBPs数据库[6]选出候选RBPs后,使用String数据库(http://string-db.org/)对候选RBPs间的相互作用进行预测分析。
1.3 统计学分析

2 结果
2.1 IDH1敲低组和对照组LN229细胞株的构建及RNA-seq样品相关性分析
RT-qPCR和Western blot结果显示:与对照组(sh-control)相比,IDH1敲低组(shIDH1-1和shIDH1-2)的IDH1RNA(图1A)和蛋白(图1B)水平显著降低,表明成功构建IDH1敲低的细胞株。同时,用于转录组测序的IDH1敲低组和对照组细胞样品,3个生物学重复样本间相关性系数r≥0.96(图1C)。

A, B.IDH1 expression was validated by Western blot and n=3),*P<0.001 compared with the control (sh-control) group; C.Heat map demonstrated the correlation between samples(n=3)
2.2 RNA-seq分析结果
聚类分析显示样本被分为对照组和IDH1敲低组两个群体,每个群体内3个重复样本间具有相似的表达特征,并且基因表达成簇分布(图2A)。与对照组细胞相比,IDH1敲低组共检测到259个差异表达基因(differentially expressed genes,DEGs)(图2B)。对这些差异表达基因进行通路富集分析后发现,差异表达基因显著富集在干扰素等相关通路(图2C)。

A.heat map for expression profile in the IDH1 knockdown and the control group; B.identification of DEGs after IDH1 knockdown, red dots represent upregulated genes and blue dots represent downregulated genes,|log2fold-change|≥1 and P<0.05; C.pathway enrichment of DEGs after IDH1 knockdown
2.3 候选RBPs筛选及其蛋白间相互作用分析
通过比对RBP数据库,将差异表达基因与RBP数据库取交集后得到14个差异表达RBPs(图3A)。进一步对其进行蛋白间相互作用分析(图3B)后,挑选出9个枢纽RBPs(表1)做进一步验证。与对照组相比,这9个候选RBPs的RNA水平在IDH1敲低的LN229细胞株中显著升高(P<0.001)(图3C)。

表1 IDH1调控的候选RBPs列表
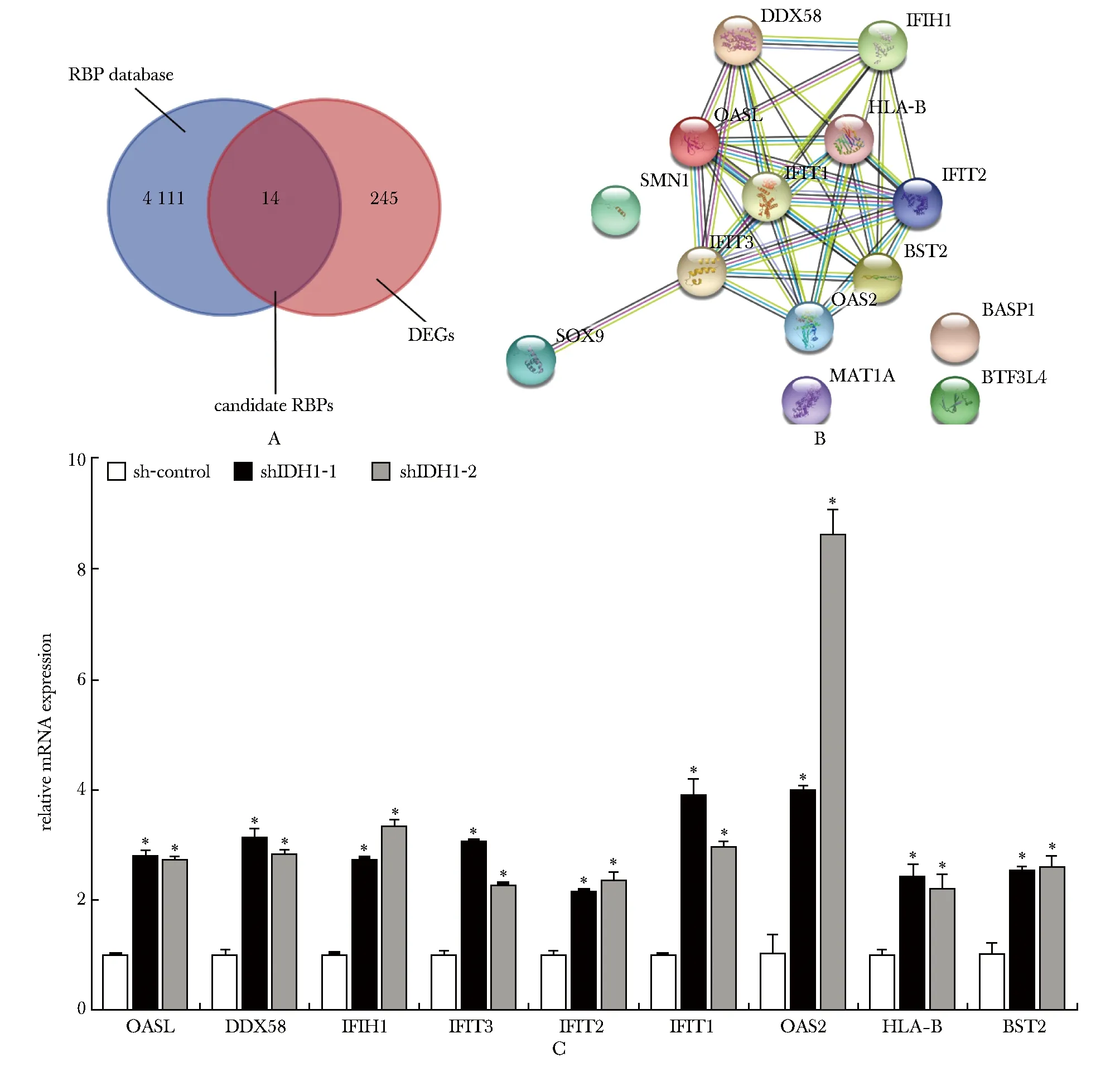
A.screening IDH1-regulated RBPs; B.protein-protein interaction analysis of candidate RBPs; C.validation of chosen RBPs by RT-qPCR in IDH1 knockdown cell line LN229; *P<0.001 compared with the control (sh-control) group
2.4 过表达IDH1R132H突变型及野生型的LN229细胞株构建和候选RBPs表达验证
RT-qPCR和Western blot结果显示:与对照组(IDH1WT)相比,IDH1过表达组(IDH1OE)的IDH1RNA(图4A)和蛋白(图4B)表达显著升高,表明成功构建IDH1OE的细胞株。用IDH1R132H特异性抗体检测结果显示,成功构建IDH1R132H细胞株(图4B)。与IDH1WT相比,在IDH1R132H细胞株中,DDX58、IFIH1、IFIT2和OAS2的RNA表达显著升高(P<0.05)(图4C)。而在IDH1OE细胞株中,IFIT3的RNA表达水平显著降低(P<0.01)(图4C)。

A, B.IDH1 expression was demonstrated by Western blot and RT-qPCR, *P<0.05, **P<0.01, ***P<0.001 compared with the control (IDH1WT) group; C.identification of the expression levels of candidate RBPs in IDH1R132H and IDH1OE cells
3 讨论
以往研究表明,IDH1高表达及IDH1突变均可促进胶质瘤的发生与发展。IDH1高表达通过促进脂质合成等代谢途径发挥促癌作用,并且与病人的不良预后显著相关[7]。而IDH1突变通过生成肿瘤代谢物羟基戊二酸(α-hydroxyglutaric acid, 2-HG)影响胶质瘤进展[8]。本研究发现,在胶质瘤细胞株LN229中敲低IDH1可导致多种基因的表达显著改变,进行通路富集分析显示这些基因显著富集在干扰素信号通路和免疫系统相关通路等。这一结果提示,IDH1可能会调控免疫应答相关基因的表达。
进一步分析发现,IDH1敲低后的差异表达基因包括14个编码RBP的基因,其中9个RBPs间具有密切的相互作用,且均参与干扰素相关通路。与对照组相比,在IDH1敲低的胶质瘤细胞系LN229中,这9个RBPs表达水平均显著上调;IDH1过表达时,IFIT3表达显著下降;而IDH1突变时,IFIT3表达未检测到显著变化。以上结果提示,在胶质瘤细胞系LN229中,IFIT3可能受到IDH1的调控。
IFIT3属于三角形四肽重复干扰素诱导蛋白(interferon-induced protein with tetratricopeptide repeats, IFIT)家族。该家族成员包括IFIT1、IFIT2、IFIT3和IFIT5,它们均具有多个TRP(tetratricopeptide repeat)模体,通过识别病毒RNA发挥抗病毒功能[9]。除此之外,IFIT蛋白家族还参与一系列生物学过程,例如细胞增殖、 迁移和双链RNA信号通路等[10]。多项研究表明,IFITs家族成员在肿瘤恶性进展中发挥重要作用:在胶质母细胞瘤中,IFIT1可诱导细胞凋亡,并且IFIT1高表达的患者预后较好[11];IFIT2通过抑制上皮间质转化(epithelial-mesenchymal transition, EMT)降低肿瘤细胞迁移和侵袭能力,从而影响口腔鳞状细胞癌进展[12];在人单核淋巴瘤细胞系U937中,IFIT3通过下调c-Myc,增强细胞周期负性调控因子p27和p21的表达,抑制肿瘤细胞增殖[13];IFIT5通过调控miRNA的代谢促进肾细胞癌进展[14]。目前为止,IFIT3在胶质瘤发生发展中的功能未见报道,还需进一步研究。
综上所述,本研究在人胶质瘤细胞系LN229中敲低IDH1后,通过RNA-seq检测IDH1调控的基因,并且对干扰素通路相关的RBPs编码基因进行验证,最终挑选出IDH1调控的候选基因IFIT3。这为进一步研究IDH1在胶质瘤发生发展中的关键作用提供了新的线索,然而IDH1对IFIT3的具体调控机制还需要深入探索。
