阿胶对慢性阻塞性肺疾病大鼠肺功能及肺组织病理损伤的影响
2021-07-19那扎开提艾尼瓦尔张田甜宋美月赵红梅靳洪涛
那扎开提·艾尼瓦尔,胡 广,张田甜,宋美月,赵红梅,靳洪涛*,王 婧*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 病理生理学系,北京 100005; 2.北京中医药大学,北京 100029;3.中国医学科学院 北京协和医学院 药物研究所 新药安全评价研究中心,北京 100050)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)简称慢阻肺,是一种以持续性呼吸道症状和不完全可逆气流受限为特征的呼吸系统慢性疾病,患病率高、死亡率高,是全球重要的公共卫生问题。目前临床上多以西药治疗为主,但效果甚微,难以根治,且长期用药不良反应多,开发新药物是近年来的研究热点[1]。中医药治疗慢阻肺有一定疗效,副作用小[2]。阿胶(Collacoriiasini,CCA,E’jiao, donkey-bide gelatin)是一味传统中药,已有两千多年的药用历史,是由驴皮经过煎煮、浓缩等复杂程序制成的固体胶块,主要成分是胶原蛋白、氨基酸、硫酸皮肤素和微量元素等[3],具有造血补血、滋阴润肺、增强免疫力、抗感染、抗衰老、抗肿瘤、抗疲劳等多种药理作用,并且安全性较高[4],但其具体作用机制不明。现代研究表明阿胶可以保护气管内滴注aPM2.5致肺损伤大鼠的肺功能,可抑制肺泡巨噬细胞的增多、减轻哮喘大鼠肺组织嗜酸性粒细胞浸润程度、逆转气道炎性反应小鼠Th17/Treg细胞亚群失衡[5-6],提示CCA对呼吸系统有一定的保护作用,但CCA对COPD的治疗作用及其机制目前尚无研究报道。因此本研究首次通过制备大鼠慢阻肺模型,观察CCA对其肺功能及肺组织病理损伤的影响,为CCA应用于慢阻肺治疗初步提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物:SPF级雄性SD大鼠25只[北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011],9~10周龄,体质量280~300 g。于自然光照下普通动物饲料统一喂养,室温(23±2)℃,相对湿度40%~60%,自由摄食、饮水,12 h昼夜明暗交替,清洁级适应性喂养1周后开始实验。相关操作符合科学技术部颁发的《实验动物管理条例》(2017版)要求。
1.1.2 试剂:实验用卷烟(中国辐射防护研究院安全评价中心);阿胶(CCA)(山东东阿阿胶股份有限公司);苏木素-伊红(HE)染色试剂盒(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 大鼠的分组及处理:将大鼠随机分为:对照组(control)、模型组(COPD)、阿胶低(low-dose CCA)、中剂量组(medium-dose CCA)和高剂量组(high-dose CCA)。除对照组外,参照文献[7]采用单纯卷烟烟雾暴露的方法,每日1次暴露于(1 100±10)mg/m3的烟雾浓度中90 min,连续暴露48周制备慢阻肺大鼠模型。分别以1、2、4 g/kg的剂量每日灌胃给药1次,每次现配现用,连续28 d,每组5只。
1.2.2 肺功能的检测:采用EMKA动物肺功能仪检测肺功能,检测前校正系统。将清醒大鼠置于全身体积描计箱中,适应环境10 min,记录10 min的情况,测定潮气量(tidal volume,TV)、每分钟呼气量(expiratory volume,EV)、呼气持续时间(expiratory time,Te)、松弛时间(relaxation time,RT)、呼气末期停顿(end expiratory pause,EEP)、支气管收缩程度(pause enhanced,Penh)、呼气峰流速(peak expira-tory flow,PEF)、吸气峰流速(peak inspiratory flow,PIF)、每分钟通气量(minute ventilation volume,MV)、呼出50%潮气量时呼气流速(expiratory flow rate at 50% tidal volume,EF50)、呼吸频率[frequency of breathing,f(B)]等肺功能指标。
1.2.3 肺组织病理形态学的观察:肺功能检测结束后,腹腔注射2%戊巴比妥钠麻醉,采血处死,取出右肺组织,置于4%多聚甲醛中固定48 h,常规石蜡包埋、切片(5 μm厚度),HE染色,中性树胶封片,光镜下观察各组大鼠肺组织病理形态学变化。
1.3 统计学分析

2 结果
2.1 阿胶(CCA)对肺功能的影响
与对照组比较,模型组大鼠的肺功能指标TV、EV、Te、RT、EEP、Penh均显著增加(P<0.05),而PEF、PIF、MV、EF50、f均显著降低(P<0.05)。与模型组比较,阿胶中剂量组大鼠Penh和高剂量组Te、RT、Penh均下降(P<0.05),而MV、PIF、EF50均明显增加(P<0.05)(图1)。
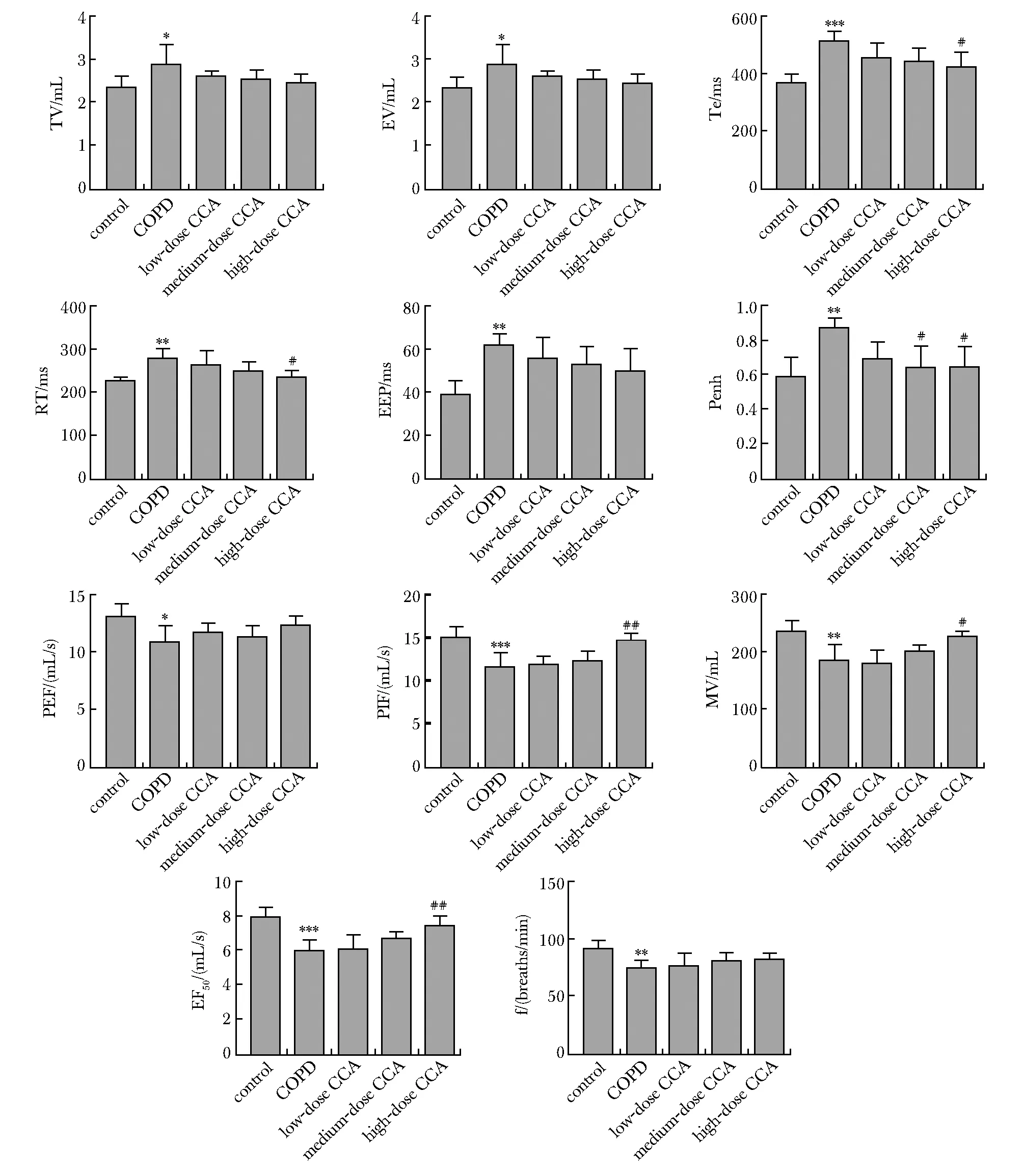
*P<0.05, **P<0.01, ***P<0.001 compared with control group; #P<0.05, ##P<0.01 compared with COPD model group
2.2 阿胶(CCA)对肺损伤的影响
对照组大鼠肺组织形态正常,肺泡和肺泡间隔结构完整,肺泡大小正常,充气状态良好,肺泡间隔无破坏,无肺气肿改变,无炎细胞浸润现象。模型组大鼠肺泡数目明显减少,肺泡结构损坏,肺泡明显扩张,肺泡壁变薄,肺泡间隔变窄、部分断裂融合成大囊泡,形成肺气肿,肺间质、肺泡腔、血管腔内大量炎性细胞浸润,以淋巴细胞、中性粒细胞为主。与模型组相比,CCA高剂量组肺泡增多,肺泡结构较完整,充气良好,可见少量萎缩肺泡,肺泡间隔大多正常,肺泡壁变薄、肺泡局部扩张融合程度明显改善,肺间质、肺泡腔、血管腔内炎性细胞浸润明显减轻。CCA低、中剂量组病理改变介于模型组和CCA高剂量组之间(图2)。
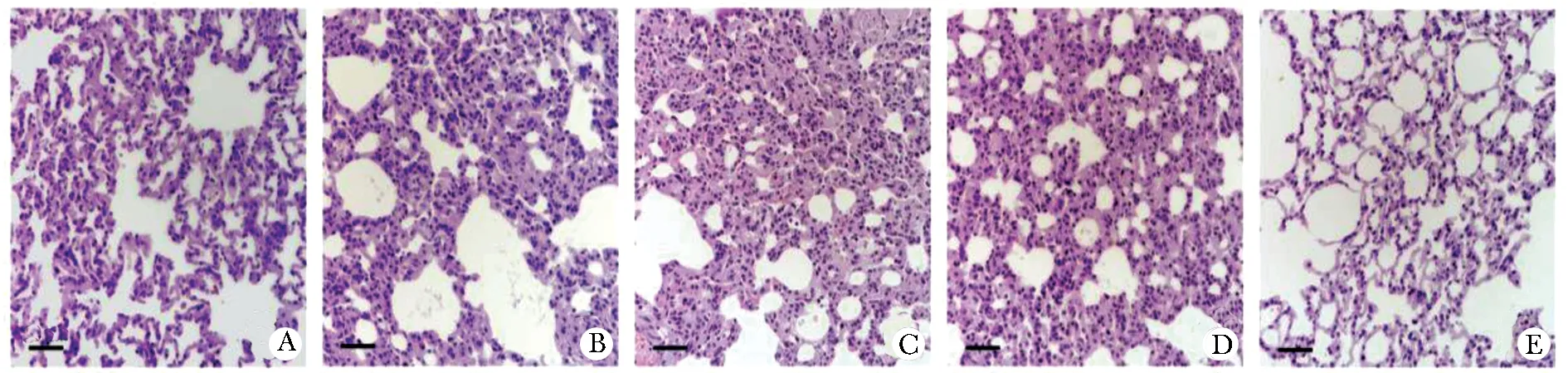
A.control group; B.COPD model group; C.low-dose CCA group; D.medium-dose CCA group; E.high-dose CCA group
3 讨论
COPD是一种最常见的可以预防和治疗的肺部疾病,多发于老年人群,主要表现为慢性咳嗽、咳痰、呼吸困难等症状,肺功能呈进行性下降,可并发肺心病、呼吸衰竭、右心衰竭等多种疾病[1]。其发病机制复杂,尚未完全明确,目前公认的主要有炎性反应机制、氧化应激机制、蛋白酶-抗蛋白酶失衡机制等学说,慢性炎性反应是核心机制,包括炎性细胞因子的释放和免疫细胞的反应[8]。长期吸烟是COPD最重要的危险因素,患病率和吸烟的时间长短、日吸烟量呈正比,香烟烟雾中含有尼古丁、焦油、镉等有害物质,可以刺激支气管黏膜,使纤毛结构和功能受损,气道自净功能逐渐降低,同时产生大量氧自由基,刺激中性粒细胞、巨噬细胞、活化的T淋巴细胞等炎性细胞的增殖和聚集,炎性因子和弹性蛋白酶的分泌增加,进一步使蛋白酶-抗蛋白酶失衡,引起气道、肺实质和肺血管的慢性炎性改变;且刺激黏膜下感受器使小气道痉挛收缩,气道阻力增加,肺功能受损[9]。
肺功能检测和病理检查是目前公认的评估COPD动物模型是否成功的两种重要方法。本实验将大鼠长期暴露于卷烟烟雾中来制备COPD模型,使模型组大鼠肺功能降低,产生肺气肿和炎性反应的形态学改变,提示大鼠肺组织发生了病理性损伤,与临床上COPD肺组织病理学改变相似[8]。
CCA素来以“滋阴润肺”著称,研究发现CCA可以通过调节抗氧化酶的活性和相关基因的表达,对氧化应激损伤起保护作用[10],显著提高腹腔巨噬细胞的吞噬活性,促进细胞免疫和体液免疫,对免疫抑制小鼠有很好的免疫保护作用[11],可以通过逆转Th17、Treg亚群失衡和下调IL-6、IL-17A、Foxp3细胞因子表达从而减轻烟尘所致气道炎性反应模型小鼠肺部的炎性反应[12]。本实验中经过CCA溶液灌胃给药干预治疗后,高剂量CCA缓解了气流受限和阻塞性通气障碍,使肺功能有所改善,明显好于模型组;低、中剂量组大鼠指标虽无显著差异,但可以看出和对照组相比肺功能均下降,给药后呈现改善的趋势。组织病理结果显示高剂量组大鼠肺组织炎性反应和肺气肿有明显改善,无肺水肿,炎性细胞浸润减少,肺泡壁破裂融合形成肺气肿现象有所缓解,肺组织病理损伤明显减轻。提示CCA具有一定程度改善COPD模型大鼠肺功能、减轻肺组织炎性反应的作用。
综上所述,本研究采用卷烟烟雾慢阻肺大鼠模型,证明CCA对其有一定的保护作用,可以改善其肺功能、减轻肺组织病理损伤,延缓COPD病理进展。这为CCA应用于慢阻肺的治疗提供了实验依据,但其确切作用机制仍需进一步深入研究。
