Box-Behnken响应面法优化姜黄素紫杉醇复方脂质体处方
2021-07-19唐海玲秦学伟温杏莉蒋梦婷潘欣欣农静连
唐海玲,秦学伟,温杏莉,蒋梦婷,潘欣欣,农静连,陈 清
(1.广西中医药大学,广西 南宁 530200;2.广西高校中药制剂共性技术研发重点实验室,广西 南宁 530200)
肿瘤是全球范围内发病率高、最常见的人类致死性疾病之一。在不能进行手术治疗的晚期肿瘤患者中,常使用顺铂、多柔比星、紫杉醇普通注射液等药物进行化疗,但化疗药物常伴随严重的副作用[1-2]。紫杉醇白蛋白纳米粒(Abraxane)、盐酸多柔比星脂质体(Doxil)、紫杉醇脂质体(力朴素)等可提高化疗药物的肿瘤靶向性,降低化疗药物的毒副作用,从而提高患者用药的顺应性和安全性[3-4]。其中,脂质体作为一种新型的药物输送载体系统,经历了近半个世纪的发展,到目前已有20个脂质体药品获批上市销售。2017年,FDA批准的首个被授予突破性疗法的复方脂质体Vyxeos,同时转载柔红霉素和阿糖胞苷,临床疗效明显,使得复方脂质体越来越受到关注[5]。
姜黄素(curcumin,CUR)是草本植物姜黄根茎中含不饱和芳香族基团的多酚类物质,溶于乙醇,难溶于水,具有亲脂性。已有文献报道姜黄素具有抗氧化、抗癌、提高耐药性肿瘤对化疗药物的敏感度等多种生理活性[6-7]。紫杉醇(paclitaxel,PTX)是不溶于水的四环二萜化合物,可作用于细胞微管蛋白,通过抑制微管的解聚,使肿瘤细胞的增殖处于停滞期,临床上主要用于卵巢癌和乳腺癌的治疗[8-9]。研究发现,将姜黄素和紫杉醇联合使用,可以实现协同增效的作用。SREEKANTH等[10]制备了姜黄素脂质体与紫杉醇-聚氧乙烯蓖麻油胶束联用,在宫颈癌荷瘤小鼠模型中,观察到姜黄素脂质体可增强由紫杉醇引发的肿瘤细胞的抗凋亡因子和生存信号因子NF-κB、Akt的信号通路。JIANG等[11]制备了RGD修饰的姜黄素/紫杉醇复方脂质体,实验研究表明其能明显抑制人肺腺癌细胞(A549细胞)的生长,体现了姜黄素与紫杉醇联用的协同作用。
微流控芯片技术是在芯片上实现对微量流体动力学精确控制的一种技术手段,利用微流控芯片技术可以快速实现脂质体制备工艺和处方的优化筛选。NOBUHITO等[12]利用微流控技术制备了姜黄素脂质体,使姜黄素脂质体的载药量提高了17%。本研究通过微流控芯片技术制备同时装载姜黄素和紫杉醇的脂质体(CUR-PTXL),利用单因素实验筛出对微球性质影响较显著的因素,采用Box-Behnken响应面法优化脂质处方[13],并通过实验验证可实现姜黄素和紫杉醇脂质体稳定包封的最优处方,提高脂质体样品的储存稳定性。
1 实验材料
1.1 仪器 FA1004电子天平[邦西仪器科技(上海)有限公司];iNano Lab System快速纳米药物制备系统[迈安纳(上海)仪器科技有限公司];HT7700透射电子显微镜[日本日立(HITACHI)公司];Quanta250扫描电子显微镜(美国FEI公司);2A5-3型恒温磁力搅拌器(上海司乐仪器有限公司);Milli-Q Advantage A10超纯水系统[美国密理博(MILLIPORE)];101-WB电热恒温干燥箱(浙江力辰仪器科技有限公司);JP-040S洁盟牌超声波清洗机(深圳市洁盟清洗设备有限公司);MD25透析袋(MW:1 000,VAKE);人字型凹槽微流控芯片[迈安纳(上海)仪器科技有限公司];EYELA旋转蒸发仪(东京理化株式公司);TGL-16G超速离心机(上海安亭科学仪器厂);MiniFlex600-CX射线衍射仪(日本理学)。
1.2 试剂和样品 蛋黄磷脂酰胆碱(EPC)为广州白云山汉方现代药业有限公司产品;胆固醇(CHOL)、二硬脂酰磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG 2000)为艾伟拓(上海)医药科技有限公司产品;无水乙醇(分析纯)为成都市科隆化学品有限公司产品;葡萄糖(分析纯)为国药集团化学试剂有限公司产品;氯化钠(分析纯)为天津市致远化学试剂有限公司产品;300目铜网普通碳膜为苏州晶硅科技有限公司产品。
2 方法与结果
2.1 CUR-PTX脂质体样品的制备 采用微流控芯片技术制备脂质体样品:配制含240 mg/ml EPC、20 mg/ml CHOL、120 mg/ml DSPE-PEG 2000的乙醇脂质储备液。利用INano快速纳米制备仪制备脂质体样品,按处方量配制含CUR和PTX的脂质乙醇相,以5%葡萄糖作为水相,设定制备参数:总流速20 ml/min,水相/乙醇相的体积比为9∶1,总体积为8 ml。制备所得的脂质体样品用旋转蒸发仪除去乙醇,放置4℃保存。
2.2 CUR和PTX的HPLC含量测定
2.2.1 对照品溶液的制备 精密称取0.022 2 g姜黄素和0.022 8 g紫杉醇原料药,置于50 ml容量瓶内,以乙醇为溶剂,分别配制成含0.444 mg/ml姜黄素和0.456 mg/ml紫杉醇的对照品溶液。
2.2.2 供试品溶液的制备 取100µl脂质体样品,加入900µl异丙醇涡旋破乳,破乳后的溶液5 000 r/min,离心5 min,吸取上清液,即为供试品溶液。
2.2.3 空白脂质体样品溶液的制备 配制含120 mg/ml EPC、20 mg/ml CHOL、12 mg/ml DSPE-PEG 2000的脂质乙醇相,以5%葡萄糖为水相,利用INano快速纳米制备仪制备空白脂质体样品,旋转蒸发仪除去乙醇。
2.2.4 色谱条件 Phenomenex Luna PFP 100Å色谱柱(5µm,250 mm×4.6 mm);流动相:乙腈(A)~0.1%乙酸水溶液(B),等度洗脱(0~15 min,60%A);检测波长:227 nm;柱温:30℃;流速:1 ml/min;进样量:10µl。
2.2.5 标准曲线的建立 取对照品溶液适量,以乙醇为溶剂,分别将姜黄素和紫杉醇对照品溶液稀释2倍、4倍、8倍、16倍、32倍、64倍、128倍,进行HPLC检测。以峰面积为纵坐标,浓度为横坐标绘制标准曲线,得紫杉醇标准曲线方程为:Y=6×10-5X-0.002 7(R2=0.999 7),姜黄素标准曲线方程为:Y=5×10-5X-0.003 9(R2=0.997 4)。
2.2.6 专属性和精密度考察 分别精密吸取对照品溶液、供试品溶液和空白脂质体样品溶液适量,按照“2.2.4”项下色谱条件进行分析。结果CUR和PTX精密度分别为:2.4%±0.76%和1.5%±0.2%,专属性良好,符合检测要求。
2.2.7 CUR和PTX的含量检测 取100µl脂质体样品,加入900µl异丙醇涡旋破乳,破乳后的溶液置于离心机中5 000 r/min离心5 min,吸取上清液直接进样检测CUR和PTX的含量。
2.3 脂质体中CUR和PTX的包封率检测 取1 ml
脂质体样品,于5 000 r/min条件下离心5 min,取上清液100µl,加入900µl异丙醇涡旋破乳,作为供试品溶液。取100µl的脂质体样品,直接加入900µl异丙醇涡旋破乳,作为对照品溶液。将处理后的样品溶液放入4℃存放,统一检测。进样前,将样品恢复室温,在5 000 r/min下离心5 min,吸取上清液按照“2.2.4”项下的色谱条件进行CUR和PTX含量分析,计算出CUR和PTX的包封率。包封率(%)=(脂质体实际载药量/理论投料量)×100%。
2.4 响应面法优化CUR-PTX复方脂质处方
2.4.1 响应面法优化设计和结果 根据单因素预试验的考察结果,固定EPC在脂质处方中浓度为120 mg/ml,以及CUR和PTX质量比为1∶1,选择对脂质体包封率影响较大的3个因素进行考察,即乙醇相中CHOL、DSPE-PEG 2000、CUR+PTX浓度。将乙醇相中CHOL质量浓度(3~6 mg/ml)、PTX+CUR的总质量浓度(3~6 mg/ml)、DSPE-PEG 2000(0~24 mg/ml)作为自变量,以粒径(Y1)、紫杉醇包封率(Y2)、姜黄素包封率(Y3)、放置15天姜黄素包封率(Y4)为因变量,进行响应面优化设计,因素水平如表1所示。实验安排及结果见表2。

表1 Box-Behnken响应面设计因素和水平表 (mg/ml)
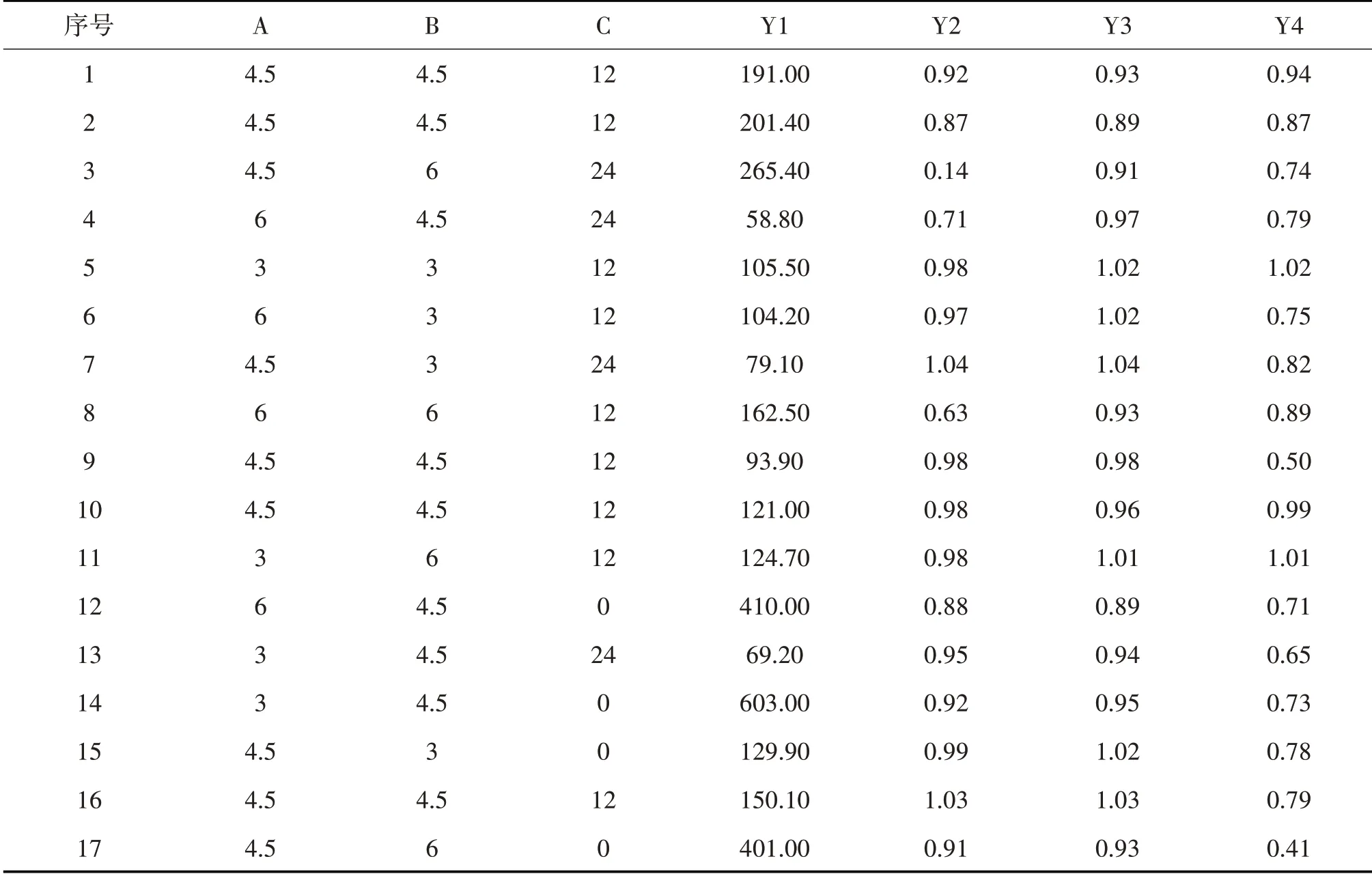
表2 Box-Behnken响应面实验设计和结果
2.4.2 模型拟合 应用Design Expert V10.0软件对响应曲面实验数据进行Mean、Liner、2F1、Quadratic、Cubic、Quartic最优方程拟合,对比不同的拟合模型,进行粒径、包封率与各脂质组分含量的相关性研究,结果见表3。

表3 粒径和包封率响应相关性方程拟合
其中,Y1和Y2的回归方程拟合系数R2均>0.97,可用于导航设计,表明在此模型的因素水平范围可以预测脂质体粒径和紫杉醇包封率的实际情况。从Y1的响应值模型,可得到B、(C)2、(A)2B的P值均<0.01,(A)2C的P值<0.1,表明PTX+CUR、DSPE-PEG 2000的含量对粒径存在显著性影响,PTX/CUR与CHOL、DSPE-PEG 2000与CHOL之间也存在交互作用,会显著影响脂质体样品的粒径。Y3和Y4的Quartic拟合显示姜黄素第1天和放置第15天的包封率变化不明显。选择Linear拟合Y3时,B的P值<0.05,说明PTX+CUR的含量对姜黄素包封率存在影响,此时Y3=0.97-0.015A-0.038B+0.009C。第15天姜黄素包封率的数值与各脂质处方含量未呈现相关性。从粒径和包封率响应的非线性相关方程拟合结果来看,固定卵磷脂的含量,改变CHOL、PTX+CUR、DSPE-PEG 2000的含量,对粒径和紫杉醇的包封率具有显著影响。紫杉醇和姜黄素在磷脂膜层存在不同的包封行为,总体而言,姜黄素更容易被包封在脂膜内,在脂膜内的包封稳定性未体现与脂膜组分相关的规律性。
2.4.3 响应面优化与分析 根据响应面拟合方程,应用Design Expert V10.0软件进行方程的结果分析。在微流控芯片技术制备姜黄素和紫杉醇复方脂质体时,选择1 ml的乙醇脂质溶液与9 ml 5%葡萄糖,以20 ml/min的流速进行混合。当固定卵磷脂的含量为120 mg/ml时,随着PTX+CUR总浓度(3~6 mg/ml)的增加,粒径在不断的增大;CHOL对粒径的影响也同样受PTX/CUR的含量影响,两者存在交互作用。在单因素分析中,固定CHOL和PTX+CUR的含量,随着DSPE-PEG 2000含量的增加,粒径会明显的下降。当PTX+CUR的总浓度为3 mg/ml、CHOL浓度为4.2~4.8 mg/ml、DSPE-PEG 2000浓度为12~18 mg/ml时,制备得到的PTX/CUR的脂质体粒径分布最小。粒径与各脂质组分含量的相关性分析结果如图1所示。紫杉醇包封率与各脂质组分含量的变化如图2所示,随着PTX/CUR含量的增加,CHOL和DSPEPEG 2000的增加会降低PTX/CUR的包封率。
图1 粒径与各脂质组分含量的相关性分析

图2 紫杉醇和姜黄素的包封率与各脂质组分含量的相关性分析
2.4.4 工艺验证 考虑到实验操作的可行性,根据Design Expert V10.0分析软件综合评价后,设定脂质体制备的最优处方为:EPC质量浓度为120 mg/ml,CHOL质量浓度为6 mg/ml,DSPE-PEG 2000质量浓度为12 mg/ml,PTX+CUR质量浓度为3 mg/ml,在此条件下,粒径、紫杉醇包封率的预测值分别为104.2 nm和96.9%。按此处方同时制备CUR/PTX复方脂质体,计算预测值与实测值的偏差,偏差=(预测值-实测值)/预测值×100%。实际测得的粒径为113.1 nm,偏差为7.8%;紫杉醇的包封率为96.2%,偏差为0.7%。表明响应面法所建模型的预测性良好,方法可行,结果可靠。
2.5 CUR-PTX脂质体的形貌观察 取按优选处方制备得到的脂质体样品适量,利用电子透射电镜观察脂质体形貌,电压设为100 kV。结果脂质体呈球形,粒径分布较为均一,见图3。

图3 CUR-PTX脂质体透视电镜形貌图
2.6 CUR-PTX脂质体的体外释放 按优选处方制备CUR-PTX脂质体,取5 ml用pH 7.4 PBS定容至25 ml。分别取1 ml转移至MW3500透析袋中,将透析袋置于900 ml释放介质(pH 7.4 PBS)中,100 r/min离心,37℃恒温搅拌,分别在1 h、2 h、4 h、8 h、16 h、24 h取样。按“2.2”项下方法测定姜黄素和紫杉醇的浓度,体外释放试结果见图4。
图4 显示,CUR-PTX脂质体在pH 7.4 PBS介质中存在缓慢释放行为,4 h时CUR和PTX的释放度分别为61.99%和47.93%;PTX和CUR存在明显不同的释放行为,其中PTX的释放度在2 h后明显低于CUR,这可能与PTX水中溶解度更低有关。24 h时,PTX的释放度为86.02%,CUR的释放度为92.21%,两个药物被包封在脂质体内,在体外均体现了良好的缓释行为。
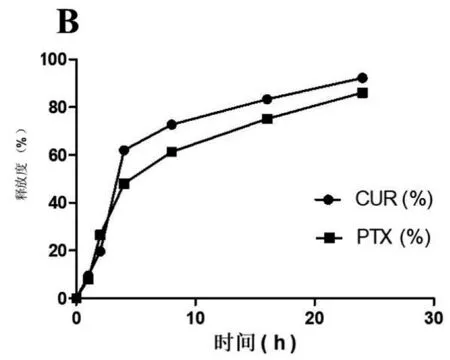
图4 CUR-PTX脂质体体外释放曲线图
2.7 CUR-PTX脂质体中脂质成分对CUR和PTX晶型的影响 将X射线衍射(XRD)测试仪器的电压设为40 kV,电流为15 mA,扫描角度范围为3°~60°,扫描速度为10°/min。取按优选处方制备的CUR-PTX脂质体真空干燥,以及CUR、PTX、EPC、CHOL、DSPEPEG2000原料,记录样品X射线衍射曲线,结果见图5。

图5 各脂质组分和CUR-PTX脂质体的XRD衍射峰
从图5中可以看出,姜黄素原料药粉末在衍射角(2θ)7.94°、8.88°、13.82°、14.52°、17.18°、21.14°、23.64°等处均出现尖锐的衍射峰,是典型的晶体衍射峰,表明姜黄素原料药为晶体结构;紫杉醇原料药在衍射角(2θ)8.86°、9.98°、11.14°、15.60°、17.08°、21.96°、25.18°等处均出现尖锐的衍射峰;CHOL原料药 在 衍 射 角(2θ)5.24°、10.07°、11.46°、12.68°、14.18°、16.94°、25.18°等处均出现尖锐的衍射峰;EPC原料药在衍射角(2θ)7.20°、20.64°等处均出现尖锐的衍射峰;DSPE-PEG 2000在衍射角(2θ)19.08°、19.64°、25.88°等处均出现尖锐的衍射峰。而CUR-PTX脂质体的干燥粉末在3°~60°衍射角(2θ)未出现明显衍射锋,峰形平缓,由此推测CUR和PTX以无定形的状态分散在干燥的脂质粉末中。
3 讨论
制剂处方优化是为了更好地提高药物体内的生物利用度、用药安全性,发挥更好的临床效果。脂质体作为新型的药物传递系统,构成其基本结构的脂质组分直接影响装载药物的体内分布、代谢、排泄。本研究利用Box-Behnken响应面法优化姜黄素紫杉醇复方脂质体处方,对影响姜黄素(CUR)和紫杉醇(PTX)包封率、脂质体粒径的磷脂辅料EPC、CHOL、DSPE-PEG 2000的用量进行了考察。在单因素试验中,EPC含量的增加会提高CUR和PTX的包封率。随着CUR和PTX含量的增加,脂质体粒径也会增大,这可能是由于CUR和PTX分布在磷脂膜双层结构内,降低了脂膜的曲面张力[14-15]。
本研究选择微流控芯片技术实现了脂质体的快速制备,微流控芯片技术是从分子水平构建纳米制剂的新技术,可以在微米尺寸的流体内完成分子自组装,以bottom-up方式形成纳米制剂微观结构。为了更好地考察CUR、PTX与各脂质组分的交互作用,将卵磷脂的浓度固定为120 mg/ml,改变CHOL、DSPE-PEG 2000的浓度,结果显示,CHOL浓度的改变会明显影响PTX的包封率,当CHOL浓度为6 mg/ml,PTX浓度从2 mg/ml增加到3 mg/ml时,PTX的包封率从90%下降到了70%。虽然固定了CUR与PTX的质量比为1∶1,但两种药物在脂膜中的包封率行为并不一致。从Box-Behnken响应面的实验结果可以看出,CUR更容易稳定地包封在脂膜中,且在设定的CHOL和DSPE-PEG 2000响应曲面浓度范围里,CUR不易受脂膜成分和含量的影响。
同时对按Box-Behnken响应面法最终优化的脂质处方制备得到的脂质体进行了体外释放度的考察,选择了pH 7.4 PBS作为释放介质,结果包封在脂质体内的姜黄素和紫杉醇均体现了明显缓释效果,1 h和2 h姜黄素和紫杉醇的释放度分别为9.5%、19.6%和8.06%、26.5%,未出现包封药物的突释,表明姜黄素和紫杉醇可以稳定地包封在脂质体内并实现缓慢释放。响应面实验设计的处方2、处方3均可以观察到脂质粉末中姜黄素和紫杉醇结晶特征衍射峰都存在,说明CUR和PTX在脂质体中是否为晶型结构与能否有效包封装载在脂质体膜内密切相关。通过对XRD衍射峰进行测定,发现紫杉醇和姜黄素包封率均高于95%的CUR-PTX脂质体中,姜黄素和紫杉醇的特征结晶峰消失,强度减弱,表明CUR和PTX在磷脂双分子层中晶型结构已发生变化,以无定型或分子形式存在,CUR和PTX能均一分散在脂质体磷脂双子层中。
利用响应曲面法可以通过非线性模型拟合,充分考虑各影响因素间的交互作用。工艺验证结果,预测值与真实值接近。通过响应面法可以快速有效地对影响脂质体质量的关键处方因素进行优化,有利于确定影响制剂稳定的关键因素。且按优化处方制备所得的脂质体形态圆整,粒径分布均一,体外释放缓慢,可为紫杉醇姜黄素联合用药提供了新型稳定的脂质载体系统。
