海洋细菌BMF04菌株的抑菌和毒素去除作用
2021-07-17李文进汤曼利周荣翔李霁虹王雨婷马桂珍暴增海
彭 云,李文进,汤曼利,周荣翔,李霁虹,董 霆,王雨婷,马桂珍,暴增海
(江苏海洋大学海洋生命与水产学院,江苏连云港 222005)
小麦赤霉病(FusariumHead Blight,FHB)是由小麦赤霉病菌(Fusarium graminearum)和小麦雪腐镰刀菌(Fusarium nivale(Fr)Ces.)等多种镰刀菌引起的真菌病害[1],感病后导致籽粒皱缩,品质下降,产生可破坏人和动物的免疫系统、致癌、致畸的等多种毒素,严重威胁到人畜的健康安全[2−4]。ZEN 毒素是世界上污染最为广泛的镰刀菌毒素,在全世界谷物以及农副产品中检出率高90%[5],我国粮食原料及饲料中霉菌毒素污染十分普遍且严重[6−8],不同地区和不同季节的原料及饲料产品检出率为70%~100%[9]。开发安全有效的方法控制毒素的产生和去除已产生的毒素迫在眉睫。
传统的毒素降解方法主要有物理降解法和化学降解法。工业上主要采取活性炭、硅铝酸盐、寡聚糖等物理吸附剂吸附,其有较强选择性,能有效降低生产成本,但是物理吸附剂易破坏营养成分而影响营养素的吸收。Volko 等[10]研究表明,毒素吸附剂不能有效彻底去除ZEN 毒素,对动物的生产性能产生很大影响。化学脱毒法通过氧化处理或碱处理,可达到比物理脱毒方法更好的效果,但化学脱毒方法难以在实际生产中大规模进行,添加化学试剂可能在粮食和饲料中有残留,造成营养物质破坏和二次污染等,存在着不可避免的局限性[11]。生物降解法主要由微生物产生的次级代谢产物和胞内、胞外酶分解毒素,产生的降解产物无毒,并对原料中的其他成分没有破坏作用,不会降低营养价值,是解决霉菌毒素污染的发展方向和趋势。目前用于毒素降解的微生物菌株较少,筛选既能够高效抑制小麦赤霉病菌和小麦雪腐镰刀菌生长又能去除毒素的微生物生防菌株,可以有效减少小麦赤霉病的发生和毒素的产生,对于保障食品安全有重要意义[12−14]。国内外不同学者已经从土壤等不同环境中分离到一些降解ZEN 毒素的微生物菌株,主要有红球菌(Rhodococcus)[15−16]、枯草芽孢杆菌(Bacillus subtilis)[17−18]、链霉菌(Streptomyces)[19]、假单胞菌(Pseudomonas)[20]、酵母菌等[21−22],应用微生物去除毒素已经成为发展趋势。
BMF04 菌株是本实验室从连云港海域分离的对多种病原菌具有较强抑制作用,并具有促生作用的甲基营养型芽孢杆菌(Bacillus methylotrophicus)[23],有关该菌株对小麦赤霉病菌和小麦雪腐镰刀病菌的抑制作用及其对ZEN 毒素的去除作用尚未进行研究,本研究测定该菌株对小麦赤霉病菌和小麦雪腐镰刀病菌菌丝的抑菌作用和对ZEN 毒素的降解作用,探究其降解ZEN 毒素的降解机理,为该菌株用于降解ZEN 毒素提供理论依据。
1 材料与方法
1.1 材料与仪器
供试菌株:海洋甲基营养型芽孢杆菌BMF04(B.methylotrophicus) 由本实验室从连云港海域分离并保存;小麦赤霉病菌(F.graminearum)、小麦雪腐镰刀菌(F.nivale(Fr)Ces.)、大肠杆菌(Escherichia coli)、解淀粉芽孢杆菌GM-1-2(Bacillus amyloliquefaciens) 由本实验室分离并保存;PDA 培养基、PD 培养基、DF 培养基(2.44 g/L Na2HPO4,1.52 g/L KH2PO4,0.5 g/L(NH4)2SO4,0.2 g/L MgSO4·7H2O,0.05 g/L CaCl2) 实验室自配;玉米赤霉烯酮毒素(ZEN) 江苏省农业科学院粮食作物研究所制备提供;胰蛋白酶(25 万 U/g) Biosharp 公司;胃蛋白酶(300 万~350 万 U/g) Bio Basic Inc 公司;蛋白酶K(4 万 U/g) 德国MERCK 公司。
安捷伦1260 高效液相色谱仪(配有可变波长紫外检测器、OpenLAB 3.3.2 SP3 安捷伦液相色谱化学工作站) 美国安捷伦公司;Biosafer-20TC 实验室级超纯水器 赛飞(中国)有限公司;MIKIO 200 R 高速冷冻离心机 德国Hettich 科学仪器有限公司;JY92-IIDN 超声波细胞粉碎机隔音箱 上海净信实业发展有限公司。
1.2 实验方法
1.2.1 BMF04 菌株及无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌菌丝生长的抑制作用
1.2.1.1 菌株对小麦赤霉病菌和小麦雪腐镰刀菌菌丝生长的抑制作用 采用平板对峙法测定BMF04菌株对小麦赤霉病菌和小麦雪腐镰刀菌菌丝的抑制作用。小麦赤霉病菌和小麦雪腐镰刀菌在PDA 平板上28 ℃培养3 d,用打孔器取直径1 cm 的菌苔分别接种于新的PDA 平板中央,在距离培养皿边缘2 cm 处划线接种BMF04 菌株,接种3 次为3 重复,以不接菌为对照,28 ℃培养3 d,测定抑菌带宽度。
抑菌带宽度(mm)=对照病原菌菌落半径(mm)−处理病原菌菌落半径(mm)[24]
1.2.1.2 无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌菌丝生长的抑制作用 将BMF04 菌株接种到装有60 mL PD 培养基的250 mL 三角瓶中,28 ℃,180 r/min 振荡培养52 h。发酵液于4 ℃、8000 r/min离心15 min,将上清液用0.22 μm 的微孔过滤器过滤得到无菌发酵液。采用打孔法测定无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌菌丝的抑制作用。在PDA 平板中央接种直径5 mm 的培养了3 d 的小麦赤霉病菌和小麦雪腐镰刀菌菌苔,在距病原菌15 mm 处等距离用直径8 mm 的打孔器打孔,每孔分别加入150 μL 不同菌株的无菌发酵液,以等量PD 培养基为对照,28 ℃恒温培养3 d,测量BMF04菌株无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌的抑菌圈直径,每个病原菌株3 次重复[24]。
1.2.2 BMF04 菌株对ZEN 毒素去除作用的研究
1.2.2.1 定性测定 挑取BMF04 菌株接种在浓度为4 μg/mL 含ZEN 毒素平板上,28 ℃培养3 d,观察BMF04 菌株的生长情况,若BMF04 菌株能生长,说明该菌株具有去除ZEN 毒素作用。以不具有毒素去除作用的大肠杆菌(E.coli)为阴性对照,以具有解毒作用的B.amyloliquefaciens的GM-1-2 菌株为阳性对照[25]。
1.2.2.2 定量测定 ZEN 毒素标准曲线的制作:分别配制2、4、6、8、10、12、14、16 μg/mL ZEN 毒素溶液,采用HPLC 法测定不同浓度毒素溶液的色谱峰面积,每个浓度测定3 次取平均值。HPLC 检测ZEN 毒素的条件:色谱仪为安捷伦高效液相色谱仪;色谱柱为安捷伦反相C18柱,孔径4 μm,长250 mm×宽4.6 mm;流动相为甲醇:水=80:20(V/V);紫外检测波长为236 nm;柱温25 ℃;进样量20 μL;流速1 mL/min。以ZEN 浓度为横坐标,色谱峰面积为纵坐标,绘制ZEN 标准曲线。
BMF04 菌株对ZEN 毒素的去除作用测定:挑取BMF04 菌株接种于PDA 培养基斜面,28 ℃培养18 h,用无菌DF 培养基洗下菌体,并调节其菌悬液浓度为107CFU/mL,菌悬液中加入浓度为1 mg/mL的ZEN 毒素母液,使毒素的终浓度为4 μg/mL,28 ℃、180 r/min 振荡培养48 h,4 ℃、12000 r/min 条件下离心15 min,上清液用孔径为0.45 μm 细菌过滤器过滤,利用HPLC 检测上清液中的峰面积,3 次重复,以不加菌悬液的含等量毒素的DF 培养基为对照(CK),将峰面积代入所建立的ZEN 毒素标准曲线,计算溶液中毒素浓度和去除率,如去除率达到100%,再增加菌悬液中毒素含量[26]。
去除率(%)=(CK 毒素浓度−样品中毒素浓度)/CK 毒素浓度×100
1.2.3 BMF04 菌株去除ZEN 毒素的作用机理研究
1.2.3.1 BMF04 菌株去除ZEN 毒素方式研究 将活化18 h 的BMF04 菌株斜面用5 mL PD 洗下制成菌悬液,倒入装有55 mL 种子液培养基的250 mL三角瓶中,28 ℃、180 r/min 振荡培养24 h,发酵液于4 ℃、8000 r/min 离心15 min,分别收集发酵上清液和菌体沉淀。上清液过滤除菌得到无菌发酵液;将菌体沉淀用DF 培养基洗涤3 次,用等体积DF 培养基重悬菌体得到活菌悬浮液,菌体密度为107CFU/mL。无菌发酵液和活菌悬浮液121 ℃灭菌30 min,得到灭活无菌发酵液和灭活菌悬浮液;活菌悬浮液用超声细胞破碎仪处理,至菌体充分破碎,冰浴功率比20%,工作时间为3 s,间隙时间5 s,循环工作至活菌悬浮液呈透明状,4 ℃,8000 r/min,离心15 min,分别收集上清液和沉淀,上清液用0.45 μm 滤膜过滤,滤液为胞内液;沉淀为细胞壁组分,用等量DF 培养基重悬,得到细胞壁悬浮液。取BMF04 菌株活菌悬浮液、灭活菌悬浮液、无菌发酵液、灭活无菌发酵液、胞内液和细胞壁悬浮液,分别加入ZEN 毒素母液,使ZEN 毒素终浓度为15 μg/mL,28 ℃、180 r/min振荡培养48 h,测定不同处理的峰面积,计算不同样品中ZEN 毒素浓度和去除率[27]。
1.2.3.2 蛋白酶对BMF04 菌株去除ZEN 毒素作用的影响 BMF04 菌株的无菌发酵液中,分别加入胰蛋白酶、胃蛋白酶和蛋白酶K,使酶的终浓度为1 mg/mL,用2 mol/L 的HCl 和NaOH 溶液调节胰蛋白酶反应体系pH 为7.6、胃蛋白酶为pH2.0、蛋白酶K 为pH8.7,37 ℃水浴2 h,调回初始pH。取不同蛋白酶酶解后的样品,加入ZEN 毒素母液,ZEN 毒素终浓度为4 μg/mL,28 ℃静置12 h,采用HPLC的方法检测样品中ZEN 毒素峰面积,计算不同蛋白酶处理的无菌发酵液对ZEN 毒素的降解率。以未加蛋白酶的无菌发酵液为对照(CK1),未加无菌发酵液为空白对照(CK2),每种蛋白酶为1 处理,每个处理3 次重复[28−29]。
1.3 数据处理
实验中每个处理重复三次,使用SPSS 22.0 软件对实验数据进行统计分析,差异显著性采用Duncan检验进行多重比较(P<0.05),利用Microsoft Excel进行图形绘制。
2 结果与分析
2.1 BMF04 菌株及无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌菌丝生长的抑制作用
BMF04 菌株和无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌菌丝生长具有明显的抑制作用(图1)。BMF04 菌株对两种病原菌的抑菌带宽度分别为(25.73±1.42)mm 和(26.80±1.31)mm,无菌发酵液对两种病原菌的抑菌圈直径分别为(14.67±2.52)mm和(15.00±1.00)mm,表明该菌株与无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌都具有较强的抑制作用。
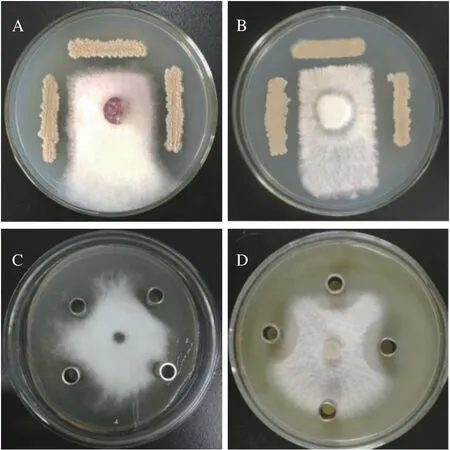
图1 BMF04 菌株及无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌菌丝的抑制作用Fig.1 Inhibitory effects of strain BMF04 and its aseptic fermentation broth on F.graminearum and F.nivale (Fr) Ces
2.2 BMF04 菌株对ZEN 毒素去除作用的定性测定
BMF04 菌株和阳性对照GM-1-2 菌株在含ZEN毒素平板上生长良好(图2),阴性对照大肠杆菌(E.coli)不生长,说明BMF04 菌株能够在以ZEN 毒素为唯一碳源的DF 培养基上生长,具有去除ZEN 毒素的作用。
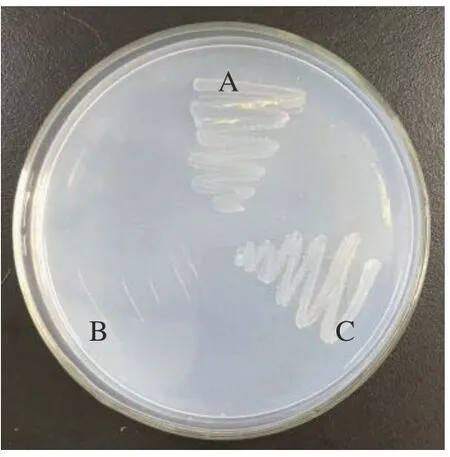
图2 不同菌株在含ZEN 毒素平板上的生长状态Fig.2 The growth state of different strains on ZEN plate
2.3 BMF04 菌株对ZEN 毒素降解的定量测定
2.3.1 ZEN 毒素标准品的检测 由图3可知,ZEN标准品的出峰时间约为2.689 min,峰型清晰无拖尾,与其他的峰没有重合,能够清晰地测量出相应的峰面积。表明该检测方法可用于ZEN 毒素的检测。
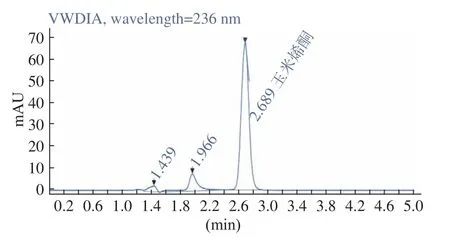
图3 ZEN 标准品HPLC 检测图谱Fig.3 HPLC analysis map of ZEN standard substance
2.3.2 ZEN 毒素标准曲线的建立 配制不同梯度浓度的ZEN 毒素溶液,利用HPLC 测定其毒素的峰面积,以ZEN 毒素浓度为横坐标,以峰面积为纵坐标,绘制ZEN 标准曲线(图4)。结果表明,在0~16 μg/mL浓度范围内,峰面积随着ZEN 毒素浓度的增加而逐渐增大,呈正相关,标准曲线方程为y=82.727x+1.2333,R2为0.9996,线性相关性较好。
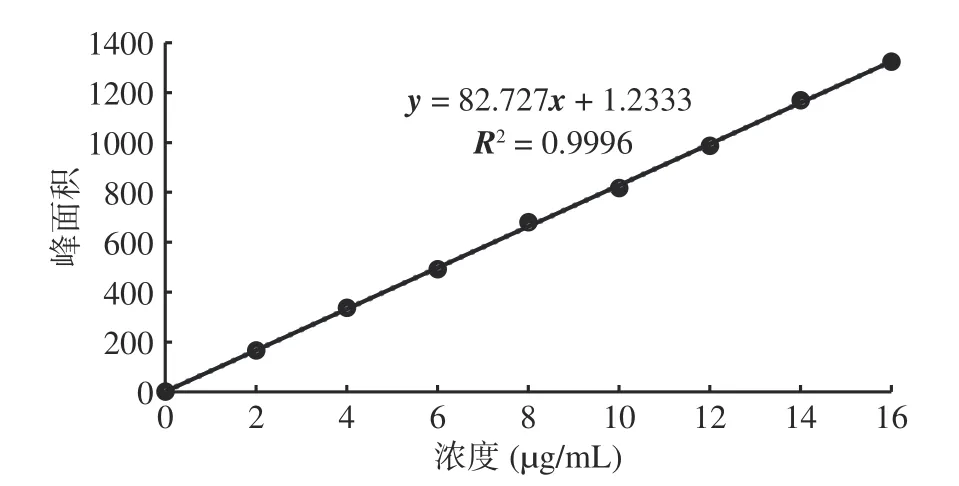
图4 ZEN 毒素的标准曲线Fig.4 The standard curve of ZEN
2.3.3 BMF04 菌株对ZEN 毒素去除率的测定 HPLC检测ZEN 毒素初始浓度为4、10 和15 μg/mL 的对照峰面积分别为(323.28±5.69)、(818.29±4.74)和(1234.68±24.83),加标回收率分别为97.25%±1.75%、98.80%±0.60%和99.40%±2.00%,与加入的ZEN 标准品初始浓度拟合程度较高,说明仪器灵敏度好,检测结果准确。将BMF04 菌株接种到ZEN 毒素终浓度为4 和10 μg/mL 的DF 培养液中,28 ℃培养48 h,HPLC 检测ZEN 毒素未出现吸收峰,说明该浓度下BMF04 菌株能完全降解ZEN 毒素,去除率为100%;当增加ZEN 毒素浓度为15 μg/mL,检测到ZEN 毒素峰面积为(12.96±0.14),ZEN 毒素浓度为(0.14±0.01)μg/mL,去除率仍为98.95%±1.27%(表1)。说明BMF04 菌株对ZEN 毒素具有较强的去除能力。
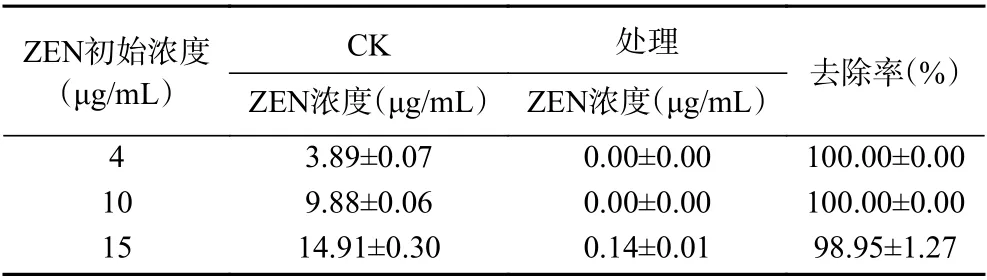
表1 BMF04 菌株对不同浓度ZEN 毒素的去除率Table 1 Removal rate of BMF04 strain to different concentration of ZEN
2.4 BMF04 菌株去除ZEN 毒素的机理研究
2.4.1 BMF04 菌株活菌悬液和灭活菌悬液对ZEN 毒素的去除作用 BMF04 菌株活菌悬液在含15 μg/mL ZEN 毒素的培养基中培养48 h,HPLC 检测峰面积为(14.29±0.77),浓度为(0.16±0.01)μg/mL,去除率为98.92%±0.07%;灭活菌悬液峰面积和毒素浓度分别(488.92±2.38)和(5.90±0.03)μg/mL(表2),去除率为60.32%±0.21%,比菌株活菌悬液的峰面积和毒素浓度明显下降,差异显著(P<0.05),说明去除ZEN 毒素作用是活菌生长过程中产生了具有去除ZEN 毒素作用的活性物质,高温处理后活性物质失活,导致去除率降低[30],高温灭活后细胞壁依然存在,灭活后活菌的去除作用消失,细胞壁的吸附作用受温度影响较小,因而灭活后仍然具有一定的去除率,表明BMF04菌株对ZEN 毒素的去除作用是菌株产生活性物质和细胞壁吸附的共同作用。
2.4.2 BMF04 菌株无菌发酵液和灭活无菌发酵液对ZEN 毒素的去除作用 无菌发酵液经121 ℃高温处理后与无菌发酵液对ZEN 毒素的去除作用差异显著(P<0.05),明显降低(表2)。无菌发酵液与浓度为15 μg/mL 的ZEN 毒素溶液混合培养48 h 后,HPLC 检测峰面积为(17.3±2.22),根据标准曲线计算ZEN 毒素浓度仅为(0.19±0.03)μg/mL,去除率达98.70%±0.19%;发酵液高温处理后再与毒素溶液混合培养48 h,HPLC 检测峰面积为(1204.75±36.29),ZEN 毒素浓度为(14.55±0.44)μg/mL(表2),去除率仅为2.09%±1.15%,去除率显著下降(P<0.05)。说明BMF04 菌株胞外物质对ZEN 毒素具有去除作用,且高温处理影响其去除作用。
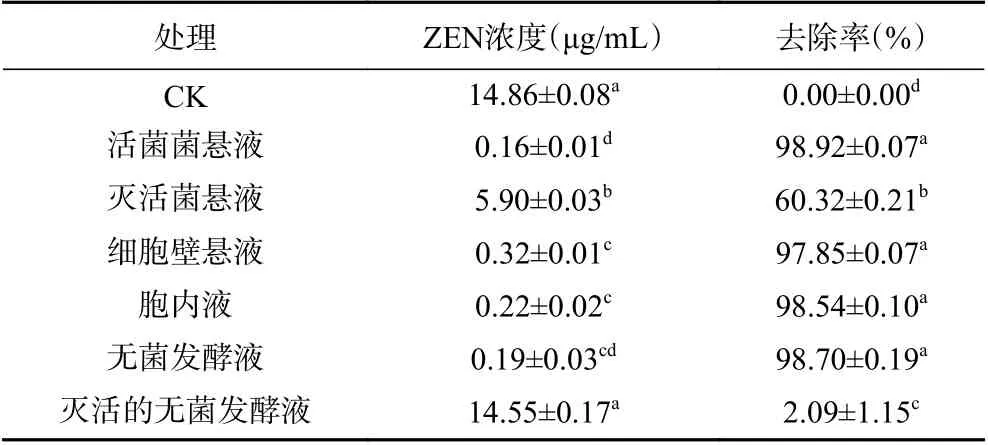
表2 不同处理BMF04 菌株ZEN 毒素的峰面积和浓度Table 2 Peak area and concentration of ZEN by strain BMF04 with different treatments
2.4.3 BMF04 菌株细胞壁悬浮液和胞内液对ZEN毒素的去除作用 细胞壁悬浮液和胞内液在含15 μg/mL ZEN 毒素的培养基中培养48 h,测定上清液中毒素含量,计算去除率。结果表明,经细胞壁悬浮液处理的样品峰面积分别为(27.91±0.98),ZEN 毒素浓度为(0.32±0.01)μg/mL,去除率为97.85%±0.07%(表2),说明BMF04 菌株对ZEN 毒素的去除作用有细胞壁吸附的作用。经胞内液处理的样品峰面积为(19.12±1.06),ZEN 毒素浓度为(0.22±0.02)μg/mL,去除率为98.54%±0.10%(表2),表明BMF04 菌株对ZEN 毒素的去除作用也有菌株产生的胞内活性物质的作用。
2.4.4 蛋白酶处理对无菌发酵液去除解ZEN 毒素作用的影响 无菌发酵液经胰蛋白酶、胃蛋白酶和蛋白酶K 处理后对ZEN 毒素的去除作用明显降低,差异显著(P<0.05),反应体系中ZEN 毒素浓度分别为(3.83±0.03)、(3.95±0.02)和(3.96±0.00)μg/mL(表3),对应的去除率分别为3.52%±0.77%、0.50%±0.39%和0.18%±0.12%,未处理无菌发酵液对照ZEN 毒素峰面积为(45.44±2.37),浓度为(0.53±0.03)μg/mL,去除率为86.54%±0.72%(表3),3 种酶处理后对毒素的去除作用与对照CK1 差异显著(P<0.05),胃蛋白酶和蛋白酶K 之间差异不显著,其中胃蛋白酶和蛋白酶K 对BMF04菌株无菌发酵液去除ZEN 毒素的影响强于胰蛋白酶。表明胰蛋白酶、胃蛋白酶和蛋白酶K 能降低BMF04 菌株无菌发酵液对ZEN 毒素的去除作用,进一步说明BMF04 菌株去除ZEN毒素的胞外活性物质为蛋白类物质。
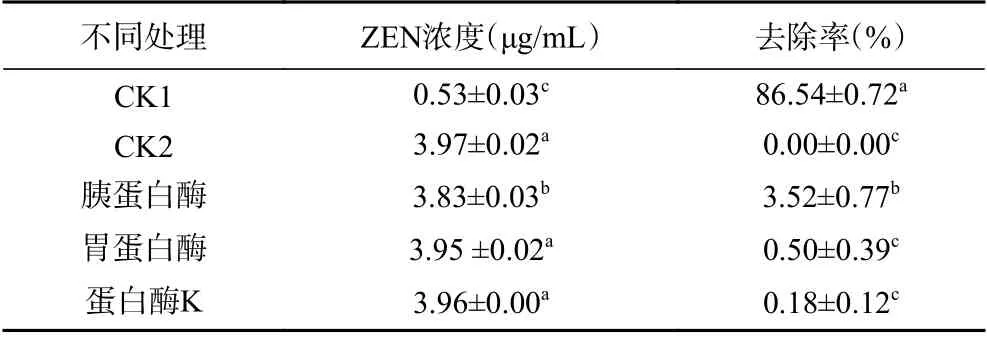
表3 不同蛋白酶处理BMF04 菌株无菌发酵液后ZEN毒素的峰面积、浓度和去除率Table 3 Peak area and concentration of ZEN culture medium after different protease treatment of aseptic fermentation broth
3 讨论与结论
不同解毒微生物菌株对ZEN 毒素的降解作用和机理不同,Cho 等[17]从土壤中分离出一株降解ZEN 毒素的枯草芽孢杆菌(B.subtilis),对液体培养基和固体培养基中含1 和0.25 mg/kg ZEN 毒素的降解率分别为99%和95%;Yi 等[31]从土壤中分离得到一株能降解ZEN 毒素的地衣芽孢杆菌,在ZEN 毒素浓度为2 mg/kg 的LB 培养基中对降解率为95.8%;谭辉[32]从牛瘤胃中分离纯化到假单胞属(Pseudomonas)菌株TH-N 1,在培养基中含2 μg/mL ZEN 毒素时降解率为59%;Saumuel 等[20]分离出一株假单胞菌(Pseudomonassp.),在培养基中含0.2 μg/mL ZEN 毒素时对其降解率为90%以上。不同降解毒素菌株中芽孢菌属降解ZEN 毒素的能力较强[18,33],张晨曦等[34]筛选获得一株解淀粉芽孢杆菌NS2 对5 μg/mL ZEN 的降解率高达95.99%。BMF04菌株在ZEN 毒素浓度为15 μg/mL 时,去除率仍可达为98.95%,对ZEN 毒素的去除作用明显高于已有菌株。
不同微生物菌株降解ZEN 毒素的方式、活性物质种类不同。王国兵[35]和Xu 等[36]研究发现解淀粉芽抱杆菌ZDS-1 和香茅醇假单胞ASAG16 对ZEN毒素的去除作用是降解作用,降解过程中,没有产生ZEN 的类似物,不是简单的结合或吸收作用;耿海荣等[18]研究表明枯草芽孢杆菌(B.subtilis)Y-33 的菌液对2 和20 μg/mL ZEN 毒素降解率分别为93.79%和82.40%,发酵上清液对ZEN 毒素降解率为62.02%,说明该菌株降解ZEN 毒素活性成分存在于发酵上清液中;谭辉[32]对菌株TH-N 1 的降解机理研究发现活菌体细胞和细胞内含物对ZEN 的降解率分别为59%和38%,无菌的上清液和灭活后的菌液对ZEN 毒素无降解作用,说明其降解作用可能是由于细胞内的胞内酶的作用。唐彧等[37]研究认为谷氨酸棒状杆菌(Corynebacterium glutamate)406 降解ZEN和AFB1 活性成分存在于发酵上清液中,降解率分别为50%和58%,初步确定其降解活性物质为一种胞外酶,而不是基于细胞壁的吸附作用。本研究结果表明BMF04 菌株对ZEN 毒素的去除作用既有细胞壁吸附作用又有蛋白质的参与,但有关降解毒素的活性物质种类待于进一步研究。
BMF04 菌株及无菌发酵液对小麦赤霉病菌和小麦雪腐镰刀菌的菌丝生长均具有良好的抑制作用,通过细胞壁的吸附、胞内物质和胞外蛋白的降解对ZEN 毒素具有较强的去除作用,去除效果明显高于已有菌株,该结果为菌株进一步用于去除污染粮食、饲料中的ZEN 毒素提供了新的菌种资源和理论依据。
