circTCF25抑制mTOR信号通路对TNF-α诱导血管平滑肌细胞增殖和迁移的影响
2021-07-16冯智明尤宜洁郝军舰
冯智明 尤宜洁 郝军舰
1青海红十字医院血管外科(西宁810000);2青海省人民医院产科(西宁810000)
经皮腔内冠状动脉成形术(percutaneous intracavitary coronary angioplasty,PCA)是冠心病介入性治疗的重要手段,然而术后6 个月内支架内再狭窄发生率高达30% ~35%,严重影响冠状动脉介入治疗的效率和患者的生存质量[1]。血管平滑肌细胞(vascular smooth muscle cell,VSMCs)是动脉壁的主要组成部分,研究显示,在内外环境刺激因子作用下VSMCs 发生表型转换触发内膜迁移并促进细胞增殖,是内膜增生、动脉壁变性和血管成形术后再狭窄的中心环节[2]。因此,抑制VSMCs 的异常迁移和侵袭可能是PCA后再狭窄的重要治疗策略。环状RNA(circular RNA,circRNA)是一类广泛分布的、具有共价闭合环状结构的内源性非编码RNA,参与基因表达调控,在心血管疾病进展中具有重要作用[3]。邹天宇等[4-5]通过circRNA 芯片、荧光定量PCR 对冠心病患者外周血单个核细胞中circRNA 表达谱进行分析和验证发现,circTCF25 表达水平显著降低,circTCF25表达增加与冠心病发病风险降低相关。在膀胱癌、骨肉瘤中circTCF25 高表达对肿瘤细胞的增殖、迁移和侵袭具有促进作用[6-7]。然而,关于circTCF25 对VSMCs 增殖和迁移的影响尚属空白。本研究以肿瘤坏死因子α(TNF-α)诱导大鼠VSMCs 建立体外增殖和迁移模型,重点探讨circTCF25 对VSMCs 增殖和迁移的作用,以期为PCA 后再狭窄提供有效治疗靶点。
1 材料与方法
1.1 实验材料大鼠胸大动脉平滑肌细胞A7r5、杜尔伯格伊戈尔培养基(dulbecco′s modified eagle medium,DMEM)、胎牛血清、青链霉素双抗购于武汉普诺赛生命科技有限公司;Lipofectamine 2000、TRIzol RNA 提取试剂盒、cDNA 合成试剂盒、SYBR Green I Master Kit 购于美国Invitrogen 公司;pcDNANC、pcDNA-circTCF25 购于上海生工生物公司;mTOR 激活剂MHY1485 购于湖北信康药化有限公司化学研究所;Transwell 小室购于美国康宁公司;放射免疫沉淀试验缓冲液、蛋白定量检测试剂盒购于杭州主诺生物技术有限公司;Ki67 兔单克隆抗体(ab92742)、上皮细胞钙粘蛋白(E-cadherin)兔单克隆抗体(ab40772)、神经钙黏素(N-cadherin)兔多克隆抗体(ab18203)、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)兔单克隆抗体(ab181602)、山羊抗兔IgG(ab205718)购于上海艾博抗公司。
1.2 方法
1.2.1 构建体外A7r5 细胞增殖和迁移模型A7r5采用含10%胎牛血清、1%青链霉素双抗的DMEM培养基于含95%空气、5%CO2的细胞培养箱中培养。当细胞80%汇合时,加入胰酶消化按照1∶3比例传代,每周换液2 ~3 次,收集对数期细胞用于实验。参照牛珩等[8]实验方法用含100 ng/mL TNF-α的细胞培养液孵育细胞24 h 构建体外A7r5细胞增殖和迁移模型,记为模型组。同时设置对照组。
1.2.2 细胞转染和实验分组收集对数期A7r5 细胞,利用Lipofectamine 2000 将pcDNA-NC、pcDNAcircTCF25 分别转染A7r5 细胞,转染成功后用含100 ng/mL TNF-α的细胞培养液孵育细胞24 h,依次记为NC 组、circTCF25 组。转染pcDNA-circTCF25的A7r5细胞用100 ng/mL TNF-α 和10 μmoL 的MHY1485细胞培养液孵育细胞24 h,记为circTCF25+MHY1485 组。
1.2.3 RT-qPCR 检测circTCF25、mTOR mRNA、p70S6k mRNA 表达水平使用TRIzol RNA 提取试剂盒从各组A7r5 细胞中提取总RNA。检测circTCF25 表达时将RNA 提取液与3 U/mg RNase R室温孵育15 min 去除线性RNA。cDNA 合成试剂盒进行逆转录,以cDNA 为模板,利用SYBR Green I Master Kit、特异性引物进行PCR反应。以GAPDH为内参照,2-ΔΔCt法计算circTCF25、mTOR mRNA、p70S6k mRNA 的相对表达量。(circTCF25 上游5′-CACTGGCGTATTTCCTGCTG-3′,下游5′-ATCTGCTTGTA GAGGGCCAG-3′;GAPDH 上游5′-ATCCACGGGAGAGCGACAT-3′,下游5′-CAGCTGCTTGTAAAGTGGAC-3′;mTOR 上游5′-AGGAAGGACGTTTGCTCAGA-3′,下游5′-TCCCTCACTGAACACAGCAG-3′;p70S6k 上游5′-GGGAAGGCTTTGCACTTTAC-3′,下游5′-TCCAGTCCCTCACGAACAAA-3′)。
1.2.4 CCK-8 法和平板克隆实验检测细胞增殖CCK-8 法:收集各组A7r5 细胞,接种100 μL 细胞悬液至96 孔板,每孔加入10 μL 的CCK-8 试剂,培养性箱内孵育2.5 h,在450 nm 波长处测定光密度(OD)值表示细胞活力。
平板克隆实验:每组取300 个A7r5 细胞接种6孔板,缓慢旋转平板使细胞分均匀散。放入培养箱孵育2 周直到出现细胞集落,终止培养。磷酸盐缓冲盐水(PBS)冲洗两次,采用4%多聚甲醛固定集落,0.5%结晶紫染色。在显微镜下计数大于50 个细胞的集落数量表示集落形成数。
1.2.5 Transwell 实验检测细胞迁移收集各组A7r5 细胞,用无血清DMEM 培养基调整为1 × 108个/L 的单细胞悬液。向Transwell 上腔室内加入300 μL 细胞悬液,向24 孔板下腔室加入500 μL 含20%胎牛血清的DMEM 培养基(不含细胞)。培养箱孵育24 h,取出Transwell 小室,用无菌湿棉签擦去上腔室未穿膜细胞,用1%多聚甲醛、0.5%结晶紫分别对Transwell 小室下表面进行固定和染色。显微镜下观察细胞穿膜情况,随机选择3 个视野计数,以其均值表示细胞迁移细胞数。
1.2.6 Western blot 检测Ki67、E-cadherin、N-cadherin 蛋白表达使用预冷的放射免疫沉淀试验缓冲液裂解各组A7r5 细胞提取细胞总蛋白。用蛋白试剂盒测定蛋白含量。将聚丙烯酰胺凝胶电泳分离的蛋白转移至聚偏二氟乙烯膜上,用5%脱脂牛奶的缓冲液室温封闭膜2 h。然后将膜置于一抗溶液(Ki67 为1∶5 000,E-cadherin、N-cadherin 和GAPDH 为1∶10 000)中室温孵育2 h。随后用相应的二抗(1∶2 000)室温孵育膜1 h。加入化学发光试剂显色,曝光。Image J 软件分析目的条带灰度值,用目的蛋白与内参GAPDH 灰度值比值表示目的蛋白相对表达量。
1.3 统计学方法实验独立重复3次,计量资料满足正态性分布用()表示。采用SPSS 20.0软件进行统计分析。多组间比较采用单因素方差分析,进一步组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 circTCF25 在TNF-α诱导A7r5 细胞中的表达与对照组比较,模型组A7r5 细胞中circTCF25表达显著降低(P<0.05);与模型组、NC 组比较,circTCF25 组A7r5 细胞中circTCF25 表达显著升高(P<0.05)。见表1。
表1 circTCF25 的表达(n=3)Tab.1 Expression of circTCF25(n=3) ±s
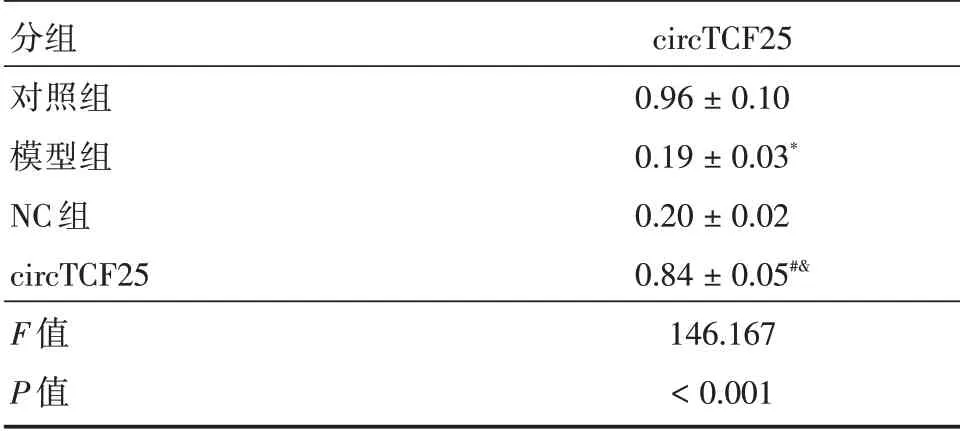
表1 circTCF25 的表达(n=3)Tab.1 Expression of circTCF25(n=3) ±s
注:与对照组相比,*P <0.05;与模型组相比,#P <0.05;与NC组相比,&P <0.05
分组对照组模型组NC 组circTCF25 F 值P 值circTCF25 0.96±0.10 0.19±0.03*0.20±0.02 0.84±0.05#&146.167<0.001
2.2 circTCF25 对TNF-α诱导A7r5 细胞增殖和迁移的影响与对照组比较,模型组A7r5 细胞活力、集落形成数、迁移细胞数显著升高(P<0.05);与模型组、NC 组比较,circTCF25 组A7r5 细胞活力、集落形成数、迁移细胞数显著降低(P<0.05)。见表2、图1。
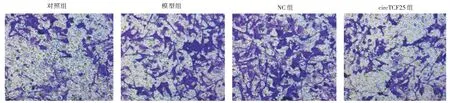
图1 迁移细胞数的检测Fig.1 Detection of the number of migrating cells
表2 circTCF25 对TNF-α诱导A7r5 增殖和迁移的影响(n=3)Tab.2 Effect of circTCF25 on proliferation and migration of A7r5 induced by TNF-α(n=3) ±s
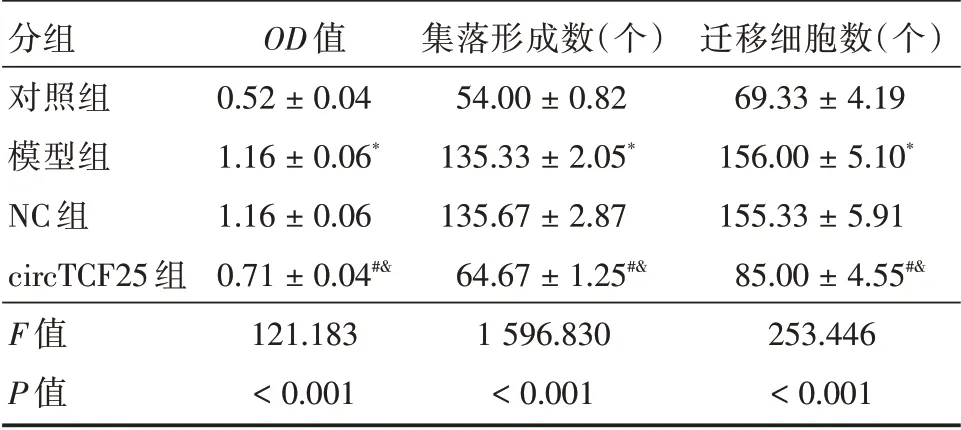
表2 circTCF25 对TNF-α诱导A7r5 增殖和迁移的影响(n=3)Tab.2 Effect of circTCF25 on proliferation and migration of A7r5 induced by TNF-α(n=3) ±s
注:与对照组相比,*P <0.05;与模型组相比,#P <0.05;与NC组相比,&P <0.05
分组对照组模型组NC 组circTCF25 组F 值P 值OD 值0.52±0.04 1.16±0.06*1.16±0.06 0.71±0.04#&121.183<0.001集落形成数(个)54.00±0.82 135.33±2.05*135.67±2.87 64.67±1.25#&1 596.830<0.001迁移细胞数(个)69.33±4.19 156.00±5.10*155.33±5.91 85.00±4.55#&253.446<0.001
2.3 circTCF25 对TNF-α诱导A7r5 细胞中mTOR信号通路的影响与对照组比较,模型组A7r5 细胞中mTOR mRNA 和p70S6k mRNA 表达显著升高(P<0.05);与模型组、NC 组比较,circTCF25 组A7r5 细胞中mTOR mRNA 和p70S6k mRNA 表达显著降低(P<0.05)。见表3。
表3 circTCF25 对TNF-α诱导A7r5 细胞中mTOR 信号通路的影响(n=3)Tab.3 Effect of circTCF25 on TNF-α induced mTOR signaling pathway in A7r5 cells(n=3) ±s
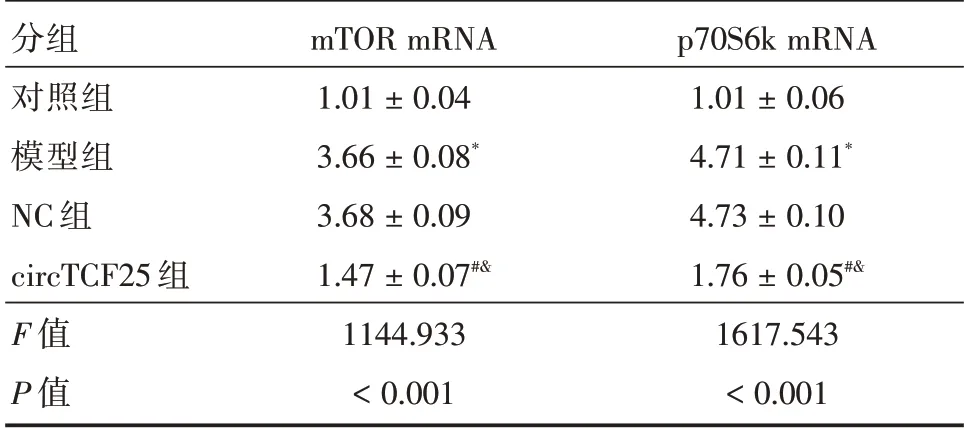
表3 circTCF25 对TNF-α诱导A7r5 细胞中mTOR 信号通路的影响(n=3)Tab.3 Effect of circTCF25 on TNF-α induced mTOR signaling pathway in A7r5 cells(n=3) ±s
注:与对照组相比,*P <0.05;与模型组相比,#P <0.05;与NC组相比,&P <0.05
分组对照组模型组NC 组circTCF25 组F 值P 值mTOR mRNA 1.01±0.04 3.66±0.08*3.68±0.09 1.47±0.07#&1144.933<0.001 p70S6k mRNA 1.01±0.06 4.71±0.11*4.73±0.10 1.76±0.05#&1617.543<0.001
2.4 MHY1485 对circTCF25 作用的TNF-α诱导A7r5 细胞增殖和迁移的影响与模型组比较,circTCF25 组A7r5 细胞活力、集落形成数、迁移细胞数显著降低(P<0.05);与circTCF25 组比较,circTCF25+MHY1485 组A7r5 细胞活力、集落形成数、迁移细胞数显著升高(P<0.05)。见表4。
表4 MHY1485 对circTCF25 作用的TNF-α诱导A7r5 细胞增殖迁移的影响(n=3)Tab.4 Effect of mhy1485 on proliferation and migration of A7r5 cells induced by TNF-α in circTCF25(n=3) ±s
注:与模型组相比,#P <0.05;与circTCF25 组相比,@P <0.05
分组模型组circTCF25 组circTCF25+MHY1485 组F 值P 值OD值1.16±0.08 0.72±0.04#1.02±0.06@39.207<0.001集落形成数(个)135.00±2.45 63.67±1.70#117.67±1.89@999.346<0.001迁移细胞数(个)155.67±6.85 85.33±3.86#138.00±3.74@158.965<0.001
2.5 MHY1485 对circTCF25 作用的TNF-α诱导A7r5 细胞中Ki67、E-cadherin、N-cadherin 表达的影响与对照组比较,模型组A7r5 细胞中Ki67 和N-cadherin 蛋白表达显著升高,E-cadherin 蛋白表达显著降低(P<0.05);与模型组、NC 组比较,circTCF25 组A7r5 细胞中Ki67 和N-cadherin 蛋白表达显著降低,E-cadherin 蛋白表达显著升高(P<0.05);与circTCF25 组比较,circTCF25+MHY1485组A7r5 细胞中Ki67 和N-cadherin 蛋白表达显著升高,E-cadherin 蛋白表达显著降低(P<0.05)。见图2、表5。
图2 Ki67、E-cadherin、N-cadherin 蛋白的表达Fig.2 Expression of Ki67,E-cadherin and N-cadherin
表5 Ki67、E-cadherin、N-cadherin 蛋白的表达(n=3)Tab.5 Expression of Ki67,E-cadherin and N-cadherin(n=3) ±s
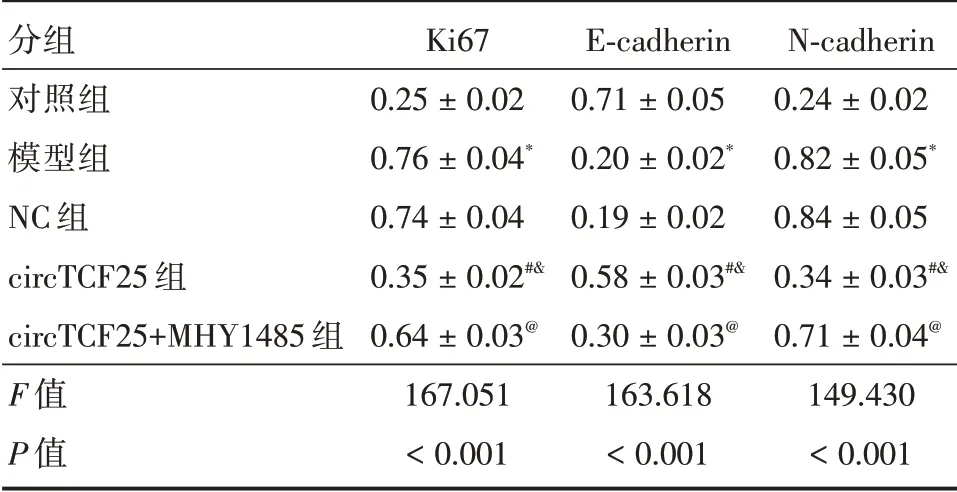
表5 Ki67、E-cadherin、N-cadherin 蛋白的表达(n=3)Tab.5 Expression of Ki67,E-cadherin and N-cadherin(n=3) ±s
注:与对照组相比,*P <0.05;与模型组相比,#P <0.05;与NC 组相比,&P <0.05;与circTCF25 组相比,@P <0.05
分组对照组模型组NC 组circTCF25 组circTCF25+MHY1485 组F 值P 值Ki67 0.25±0.02 0.76±0.04*0.74±0.04 0.35±0.02#&0.64±0.03@167.051<0.001 E-cadherin 0.71±0.05 0.20±0.02*0.19±0.02 0.58±0.03#&0.30±0.03@163.618<0.001 N-cadherin 0.24±0.02 0.82±0.05*0.84±0.05 0.34±0.03#&0.71±0.04@149.430<0.001
3 讨论
circRNAs 是进化上保守的非编码RNA,其具有强大的基因调控功能,广泛参与调节血管生成、平滑肌细胞功能和心脏损伤反应等生物过程,与心血管疾病的发展密切相关[9-10]。研究显示,CircFndc3b 通过血管内皮生长因子A(vascular endothelial growth factor,VEGF-A)调控心肌梗死后的心脏修复[11]。circ_000203 通过抑制miR-26b-5p 和miR-140-3p 与转录因子GATA4 结合而加重心肌肥厚[12]。此外,circ_005717 调节大鼠VSMCs 增殖、迁移和分化,具有抑制内膜增生、延缓血管再狭窄功能[13]。然而,circTCF25 在VSMCs 增殖、迁移中的作用尚未可知。VSMCs 具有显著的表型可塑性,在血管损伤或炎症细胞因子刺激下,VSMCs 将脱分化并重新获得增殖、迁移能力,这是PCA 后再狭窄、动脉粥样硬化性狭窄的病理基础。本研究显示,TNF-α诱导后A7r5 细胞增殖、迁移能力增加,circTCF25 表达降低,提示circTCF25 低表达可能与A7r5 细胞异常的增殖和迁移能力有关。进一步功能验证显示,circTCF25 过表达后TNF-α诱导的A7r5 细胞的增殖、迁移和侵袭能力显著降低。Ki67 是一种与细胞有丝分裂相关的蛋白质,其表达水平与细胞增殖活力呈正相关,是反映细胞增殖能力的重要指标[14]。E-cadherin 和N-cadherin 是细胞表面粘附分子超家族重要成员,对维持组织完整性和稳态具有重要作用,上调E-cadherin 蛋白表达、下调N-cadherin 表达促进VSMCs 粘附降低细胞迁移能力[15-16]。本研究发现,circTCF25 过表达后,TNF-α诱导的A7r5 细胞Ki67、N-cadherin 蛋白表达降低,E-cadherin 蛋白表达升高,与功能实验吻合,说明过表达circTCF25 能够抑制TNF-α诱导的VSMCs 的增殖和迁移。
mTOR 是哺乳动物表达的一种丝氨酸/苏氨酸蛋白激酶,参与细胞发育、血管生成、自噬以及先天适应性免疫反应等多种病理生理过程。大量研究证实,mTOR 信号的激活除参与动脉粥样硬化巨噬细胞活化、内皮功能紊乱、泡沫细胞形成,还与VSMCs 的异常增殖、迁移和易损斑块形成有关[17-18]。抑制mTOR 信号通路可降低VSMCs 的增殖、迁移和侵袭能力,是预防动脉粥样硬化的潜在策略[19-20]。本研究显示TNF-α诱导后A7r5 细胞中mTOR mRNA 和p70S6k mRNA表达显著升高,而circTCF25过表达可降低TNF-α诱导对mTOR mRNA和p70S6k mRNA 表达的促进作用,提示circTCF25对VSMCs 的抗增殖、迁移作用可能与抑制mTOR信号通路活化有关。激活mTOR 信号通路可逆转circTCF25 对TNF-α诱导的A7r5 细胞增殖、迁移及相关蛋白表达的影响,说明circTCF25 对TNF-α诱导的A7r5 细胞增殖和迁移的抑制作用与抑制mTOR 信号通路活化有关。
综上所述,本研究发现过表达circTCF25 可降低TNF-α诱导的VSMCs 的增殖和迁移能力,其机制与抑制mTOR 信号通路活化有关,提示circTCF25 可能是PCA 后再狭窄等血管增生性疾病的潜在靶点。
