长链非编码RNAs-微小RNAs-mRNAs调控轴在脑缺血/再灌注损伤机制中的作用进展
2021-07-16李俊杰邵建林
李俊杰 邵建林
昆明医科大学第一附属医院麻醉科(昆明650032)
缺血性脑卒中是一种常见且高发的脑血管病,其发生率约占所有卒中的87%[1]。缺血性脑卒中发生后血流的再通导致缺血组织损伤加重的现象,称为脑缺血/再灌注(ischemia/reperfusion,I/R)损伤。再灌注损伤的机制复杂多样,与细胞凋亡、氧化应激、神经炎症、兴奋性氨基酸毒性、细胞自噬以及血脑屏障破坏等病理过程密切相关[2]。长链非编码RNAs(long non-coding RNAs,lncRNAs)和微小RNAs(microRNAs,miRNAs)在许多生物过程的基因表达调控中发挥重要作用[3-4]。lncRNAs是近年发现的能够在表观遗传水平、转录水平和转录后水平对基因表达进行调控的一类非编码RNAs,miRNAs 则发挥了切割mRNAs,保持mRNAs的稳定性以及抑制翻译的作用[5]。lncRNAs 主要通过竞争性内源RNA(competing endogenous RNA,ceRNA)机制,作为miRNAs 的内源性“海绵”抑制miRNAs 的表达,从而抑制了miRNAs 对mRNAs 的负性调控作用;此外,也有部分lncRNAs 能与miRNAs 竞争mRNAs 的3′端结合位点,直接与mRNAs结合,解除了miRNA对mRNA的抑制作用[6](图1)。近年来,越来越多的研究表明lncRNAs-miRNAsmRNAs 调控轴在诸多方面参与了脑I/R 损伤病理过程的调控。本文将从以下几个方面对近年关于lncRNAs-miRNAs-mRNAs 调控轴在脑I/R 损伤中的作用及其机制的研究进行总结与分析,为脑I/R损伤的分子机制及治疗靶点的选择提供理论依据和参考。
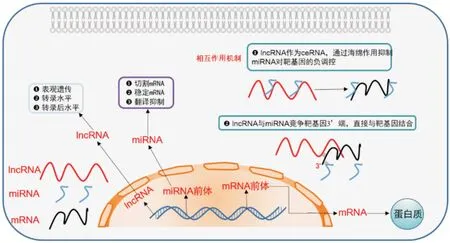
图1 lncRNA 和miRNA 的作用及调控mRNA 的作用机制示意图Fig.1 Schematic diagram of the roles of lncRNA and miRNA and the mechanism of regulating mRNA
1 lncRNAs-miRNAs-mRNAs 轴与脑I/R 损伤后细胞凋亡
细胞凋亡是由基因控制的细胞自主的有序死亡过程,在脑I/R 损伤过程中发挥了重要作用。研究发现,lncRNA TUG1 和MALAT1 在脑I/R 损伤后的星形胶质细胞和小鼠脑组织中高表达,二者均能通过吸附miR-145而上调AQP4的表达,促进了脑I/R 损伤后细胞凋亡[7-8]。lncRNA KCNQ1OT1 在I/R后的大脑皮质神经元中表达上调,并通过与miR-9的反应元件结合抑制其表达,解除了miR-9 对靶基因MMP-8的表达抑制,从而诱导神经元发生凋亡[9]。KCNQ1OT1还能通过lncRNA KCNQ1OT1-miR-153-3p-Foxo3调控轴,以相同的作用方式促进脑I/R损伤后皮质神经元的凋亡[10]。另一项研究发现,lncRNA CHRF 在I/R 损伤后小鼠脑组织中高表达,同时,敲低CHRF 基因表达能通过靶向调控miR-126/SOX6 通路抑制细胞凋亡,改善脑I/R 损伤[11]。此外,下调lncRNA H19可通过与miR-19a竞争结合靶基因Id2 的3′端间接抑制Id2 的表达,改善Id2 高表达所致的神经元损伤[12]。lncRNA MEG3 也参与了脑I/R损伤后细胞凋亡的调控,它能通过ceRNA机制竞争性抑制miR-21a 的表达,从而上调靶蛋白PDCD4的表达,诱导缺血所致的神经元凋亡[13]。上述研究表明,脑I/R 后大量的lncRNAs 呈高表达,并通过lncRNAs-miRNAs-mRNAs 轴促进神经细胞凋亡,加重脑组织的再灌注损伤。然而,有极少数lncRNAs 在脑I/R 后高表达,可以抑制凋亡,抗I/R损伤。YIN 等[14]研究发现,lncRNA SNHG12 在I/R后的海马神经元中高表达,抑制了miR-199a对靶基因SIRT1 的负调控,并激活AMPK 信号通路抑制了神经元凋亡。
B 细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)家族蛋白(Bcl-2、Bax)以及其下游的半胱氨酸蛋白酶3(cysteine protease-3,Caspase-3)在细胞凋亡的早期发挥了非常重要的调节作用,它们以酶原的形式存在于胞质,并在一定条件下被激活后促进或抑制凋亡[15]。诸多研究证实lncRNAs-miRNAsmRNAs 调控 轴 能激活Bcl-2、Bax 或Caspase-3 途径参与脑I/R 损伤后细胞凋亡的调控。lncRNA AK 038897 在脑I/R 损伤后小鼠脑组织和N2a 细胞中表达显著上调,作为miR-26a-5p 的一个ceRNA 与DAPK1 竞争结合共同的miR-26a-5p 结合位点,通过lncRNA AK038897-miR-26a-5p-DAPK1 轴使Bax和Caspase-3 蛋白表达上调,Bcl-2 蛋白表达下调,加重了细胞凋亡[16]。相反的是,lncRNARian 在脑I/R 后表达显著降低,过表达Rian 通过海绵吸附作用抑制了miR-144-3p 对靶基因GATA3 的负调控作用,从而抑制了Bax、Caspase-3 蛋白表达,激活了Bcl-2 的表达,发挥抗凋亡的保护作用[17]。lncRNA Oprm1 与lncRNA Rian 作用相似,定位在胞浆,脑I/R后Oprm1表达降低,过表达后通过lncRNA Oprm1-miR-155-GATA3 调控轴降低了Caspase-3 的蛋白表达[18]。此外,下调lncRNA Gm11974 的表达通过lncRNA Gm11974-miR-766-3p-NR3C2 轴激活Bcl-2和抑制Bax 蛋白表达,从而减少脑I/R 损伤后细胞凋亡[19]。综上可见,脑I/R 损伤发生后对这些差异表达的lncRNAs 或其相应的调控轴进行干预可能对挽救I/R 损伤后神经细胞的存活具有重要作用。
2 lncRNAs-miRNAs-mRNAs 轴与脑I/R 损伤后氧化应激损伤
氧化应激是导致脑I/R 损伤最常见和研究最充分的因素[20]。大量氧化物质生成减少是造成氧化应激损伤的主要因素之一。lncRNA H19 参与的调控轴不仅能调控细胞凋亡,对氧化应激反应也具有调控作用。研究表明,lncRNA H19可作为miR-19a-3p的一个ceRNA,通过海绵吸附作用抑制其表达,从而使PTEN 上调,增加了MDA 和减少了SOD的产生,加重了I/R 后脑组织的氧化应激损伤[21]。另一项研究发现二甲双胍抗氧化应激,保护脑I/R损伤的机制是通过抑制lncRNA H19-miR-148a-3p-Rock2 调控轴来实现[22]。同时,研究发现lncRNA KCNQ1OT1 在脑I/R 后表达显著上调,通过靶向抑制miR-140-3p 促进了HIF-1α的表达,增加了ROS和MDA 的生成以及减少了SOD 的产生[23]。此外,lncRNA KCNQ1OT1 还参与了脑I/R 损伤所致内质网应激(endoplasmic reticulum stress,ERS)的调控,KCNQ1OT1 表达上调后通过靶向作用于miR-30b-GRP78 轴,上调ERS 相关蛋白的表达,加重再灌注后ERS 所致的脑损伤[24]。lncRNA ROR 在I/R损伤的PC12 神经细胞模型中表达显著上调,通过调控miR-135a-5p/Rock1/2 轴加重再灌注损伤所致的氧化应激损伤[25]。然而,在脑I/R 损伤的SH-SY5Y 细胞模型中,lncRNA SNHG16 的表达则下调,过表达SNHG16 通过海绵吸附作用靶向抑制miR-106b-5p的表达,从而上调了LIMK1 的表达,最终减少了内质网应激相关蛋白的产生,发挥了抗氧化应激的保护作用[26]。另一项体内实验表明,lncRNA NEAT-1在I/R 损伤后大鼠脑组织中表达上调,通过靶向抑制miR-214 并促进PTEN 的表达增加了氧化物质MDA和连环蛋白(catenin,CAT)并减少了抗氧化物质SOD 的产生,加重了脑组织的继发性损伤[27]。由此可见,lncRNAs-miRNAs-mRNAs 调控轴在脑I/R 损伤中具有促氧化应激和抗氧化应激的双向调控作用。
3 lncRNAs-miRNAs-mRNAs 轴与脑I/R 损伤后神经炎症
炎症反应是造成脑I/R 后继发性损伤的重要因素之一,再灌注早期,炎症级联效应被激活,大量的细胞因子的生成促进了炎症反应,加重了脑组织的损伤[28-29]。lncRNA MEG3 及其调控轴不仅参与了细胞凋亡的调控,对神经炎症也具有调控作用。研究表明,在I/R 损伤后的大鼠脑组织和SH-SY5Y 细胞模型中,MEG3 的表达上调,并通过作为miR-485 的一个ceRNA,海绵吸附miR-485 抑制其表达,从而上调靶基因AIM2 的表达,最终增加了IL-1β和IL-18 的分泌,加重炎症反应[30]。另一方面,lncRNA ZFAS1 则呈现低表达,过表达后通过调控miR-582/NOS3 轴,降低了脑组织和细胞上清液中TNF-α和IL-1β的产生,抑制了脑I/R 损伤所致的炎症反应[31]。lncRNA H19 在I/R 后脑组织中高表达,如上文所述,H19 及其相关lncRNAsmiRNAs-mRNAs 调控轴参与了脑I/R 损伤后细胞凋亡和氧化应激的调控。lncRNA H19 可作为mi-138-5p 的分子海绵抑制其表达并上调了靶基因p65 的表达,从而增加了细胞因子的产生,促进了炎症反应[32]。lncRNA KCNQIOT1 也参与了神经炎症的调控,体外研究表明,KCNQIOT1 通过靶向调控miR-140-3p/HIF-1α轴增加了细胞上清液中炎症因子的分泌[23]。此外,ZHONG 等[33]还通过RNA 免疫沉淀和下拉实验证实了lncRNA SNHG14 可作为miR-136-5p 的ceRNA,通过与ROCK1 竞争miR-136-5p 共同的结合位点抑制miR-136-5p 对ROCK1 的负调控作用,从而增加脑I/R 损伤后促炎细胞因子的产生,加重神经炎症反应[33]。
4 lncRNAs-miRNAs-mRNAs 轴与脑I/R 损伤后细胞自噬
自噬通过去除蛋白质聚集体和破坏细胞器,以及回收自噬降解的副产品,对维持细胞内稳态具有重要意义,同时,它又是真核生物的重要降解途径之一,并且与心脑血管疾病相关[34-35]。然而,过度自噬可促进脑I/R 损伤过程中神经元凋亡,导致神经细胞死亡[36]。已有研究证实lncRNAsmiRNAs-mRNAs 调控轴参与脑I/R 损伤后神经细胞的自噬过程。脑I/R 后lncRNA SNHG3 表达上调,并作为miR-485 的ceRNA 抑制了miR-485 的表达,靶向上调了自噬相关蛋白ATG7 的表达,增加了LC3II/I 的生成,促进了自噬诱导的神经细胞凋亡[37]。此外,lncRNA KCNQ1OT1 通过调控miR-200/FOXO3/ATG3 通路增加了I/R 损伤后神经细胞的自噬通量(ATG3、LC3II/I 和SQSTM1 生成增加),诱导神经细胞自噬,加重小鼠脑梗死和神经功能障碍[38]。另一项体外研究表明,lncRNA Malat1 是一种有效的自噬诱导剂,在发生I/R 后的脑血管内皮细胞中,Malat1 表达上调,通过海绵吸附抑制miR-26b 表达,靶向上调ULK2 的表达,促进自噬小体GFP-C3 生成和LC3-I 向LC3-II 蛋白转化,诱导自噬,保护细胞免受I/R 所致的死亡[39]。
5 lncRNAs-miRNAs-mRNAs 轴与脑I/R 损伤其他病理过程
lncRNAs-miRNAs-mRNAs调控轴除了参与上述对脑I/R 损伤后细胞凋亡、氧化应激损伤、神经炎症和细胞自噬的调控外,有研究发现它还能参与细胞焦亡的调控。细胞焦亡是近年新发现的一种新的程序性细胞死亡方式,该过程也伴随着大量促炎因子的释放。GSDMD-N被认为是Caspase-1的底物,是一种参与焦亡途径的蛋白。近期,LIANG 等[30]研究发现,lncRNA MEG3 在I/R 损伤后的大鼠脑组织和SH-SY5Y 细胞模型中表达上调,并通过miR-485/AIM2 通路增加GSDMD-N 蛋白的表达,激活Caspase-1 介导的细胞焦亡途径,促进随之而发生的炎症反应,加重神经功能损伤。
脑I/R 损伤机制比较复杂,细胞凋亡、氧化应激损伤、神经炎症、兴奋性氨基酸毒性、细胞自噬和血脑屏障功能受损等病理损伤过程彼此间相互交错或促进,加重了脑组织缺血再灌注后的继发性损伤。而从现有的研究来看,lncRNAs-miRNAsmRNAs 调控轴则通过各自的分子调控网络参与了脑I/R 损伤后细胞凋亡、氧化应激损伤、神经炎症、细胞自噬和焦亡过程的调控(图2)。对该方面分子调控机制的研究将加深对该疾病病理机制的认识,也为治疗缺血性脑卒中分子靶点的筛选拓展了新的视角,但离临床治疗应用还有很长的路要走,仍然需要进行深入研究探索。
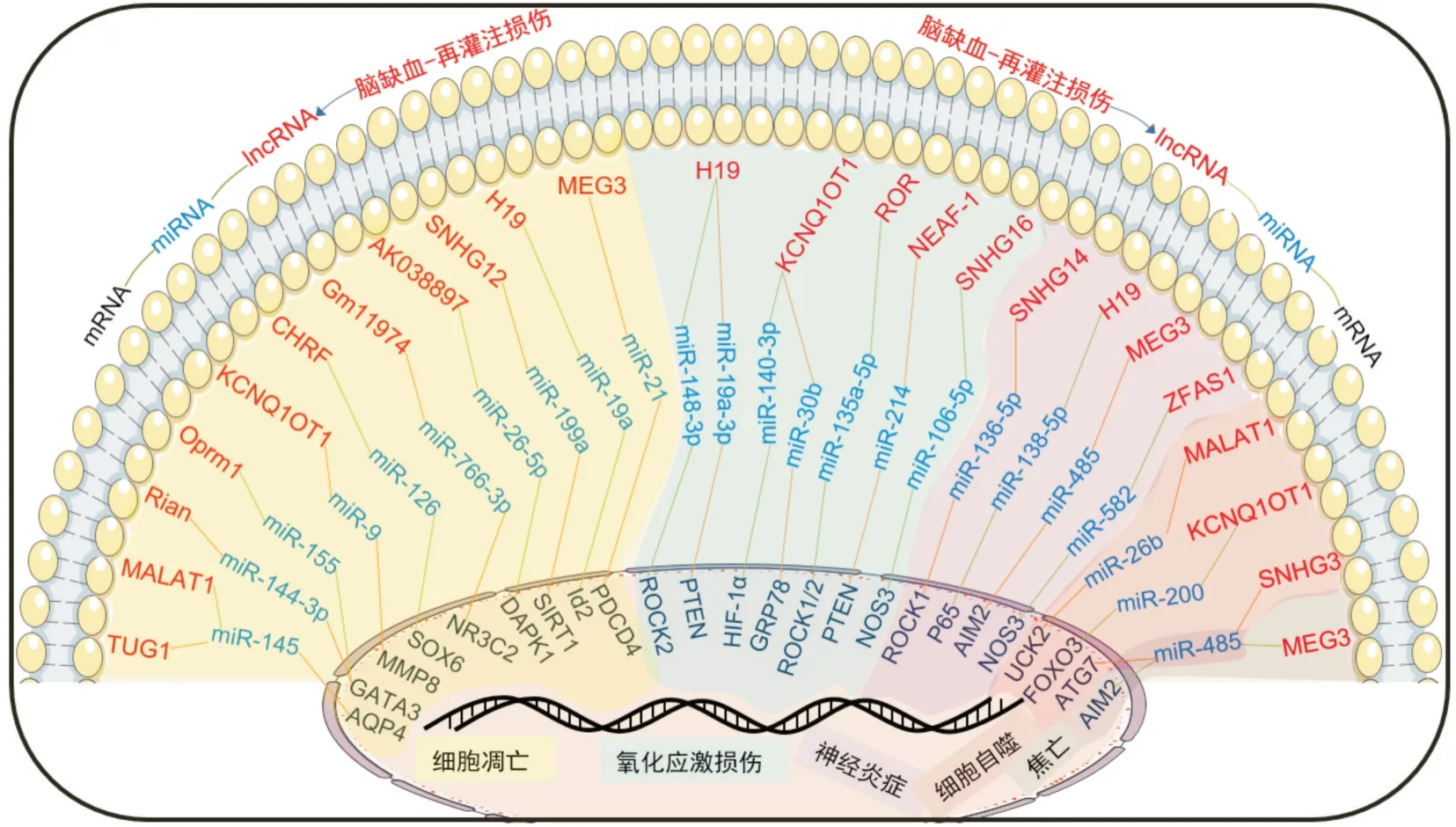
图2 lncRNAs-miRNAs-mRNAs 调控轴在脑缺血/再灌注损伤机制中的作用网络图Fig.2 Network diagram of the role of lncRNAs-miRNAs-mRNAs regulatory axis in the mechanism of cerebral ischemia/reperfusion injury
