Mn-Co/二维TiO2催化剂对甲苯的催化氧化性能
2021-07-16钟少涛陈定盛胡春华陈雄波岑超平
钟少涛,陈定盛,卢 龙*,胡春华,方 平,陈雄波,岑超平
(1.南昌大学资源环境与化工学院,鄱阳湖环境与资源利用教育部重点实验室,江西 南昌 330031;2.生态与环境部华南环境科学研究所,广东省水污染与空气污染控制重点实验室,广东省空气污染控制工程实验室,广东 广州 510655)
随着我国经济社会的高速发展,工业化水平不断提高,能源消耗持续加快,伴随着环境污染日益加重。挥发性有机化合物(VOCs)是重要的大气污染物之一,是二次有机气溶胶(SOA)、PM2.5[1]和O3[2-3]形成的重要前驱体,并且对人体健康危害极大[4]。目前,VOCs主要去除方法包括催化氧化法、吸附法、吸收法、直接燃烧法、生物净化法、等离子体处理法等[5-7]。其中催化氧化法具有节能、高效、无二次污染等优点,从而受到广泛运用[8]。催化氧化法的核心是催化剂,常用的催化剂有贵金属催化剂和过渡金属催化剂[9-10]。虽然过渡金属催化剂的活性低于贵金属催化剂,但其具有价廉,低温还原性好等优点而受到广泛研究[11-13]。
在过渡金属催化剂中,锰和钴催化剂是一类环境友好型催化剂,具有较好的活性,特别是Mn-Co双金属催化剂对VOCs具有良好的催化活性[14-15],这是因为Mn和Co纳米晶紧密接触,改变了晶型结构和金属价态,增强了两者之间的协同作用,提高了催化活性[16-17]。除了催化活性组分之外,催化剂载体在VOCs的催化反应中也起重要作用。负载型催化剂具有较大的比表面积,有利于活性组分分散和提高污染物吸附位点,可极大提高催化活性[18]。此外载体的酸性、孔隙结构也是影响催化活性的重要因素[19]。
TiO2是一种白色粉末状的两性金属氧化物,广泛作为催化剂载体。有研究报道,TiO2作为载体负载活性组分能够形成金属-载体强相互作用,从而提高催化剂的活性[20-21]。此外,有研究表明[22],超薄的二维TiO2纳米片具有高比表面积和更多的活性反应位点,有利于提高催化剂反应活性。本文采用水热法制备二维TiO2纳米片,然后使用浸渍法负载Mn-Co活性组分,制备Mn-Co/TiO2催化剂,研究了不同活性组分配比、负载量、焙烧温度和不同反应空速对催化剂催化氧化甲苯的影响,并采用XRD、SEM、H2-TPR和BET等手段分析对其理化性质进行表征分析。
1 材料制备与方法
1.1 试剂与材料
钛酸异丙酯(上海麦克林生化科技有限公司,97%)、乙二醇(上海麦克林生化科技有限公司)P25(上海麦克林生化科技有限公司,分析纯)、聚醚P123(上海麦克林生化科技有限公司,分析纯)、无水乙醇(上海麦克林生化科技有限公司,分析纯)、六水合硝酸钴(上海麦克林生化科技有限公司,分析纯)、柠檬酸(上海麦克林生化科技有限公司,分析纯)、四水硝酸锰(上海阿拉丁生化科技股份有限公司,分析纯);盐酸(广州化学试剂厂,分析纯)。
1.2 催化剂的制备
1.2.1 二维TiO2纳米片的制备
TiO2纳米片制备:TiO2纳米片是根据水热法制备[22]。首先在剧烈搅拌下,将1.05 g的钛酸异丙酯加入到0.74 g的浓盐酸溶液中;其次将0.2 g的聚醚P123溶于3.0 g的乙醇溶液中搅拌至溶解。再将P123与乙醇混合溶液加入到钛酸异丙酯与浓盐酸混合液中搅拌30 min。然后取2.5 g搅拌后的混合液加入到20 mL乙二醇溶液中继续搅拌30 min,最后将其转移至45 mL的高压反应釜中在150 ℃下加热20 h。将水热反应后的产物用乙醇和去离子水交替洗涤3次,然后在80 ℃下干燥12 h,在550 ℃下焙烧2 h获得TiO2纳米片。
1.2.2 负载型TiO2纳米片催化剂的制备
活性组分的负载采用浸渍法制备。将制备好的TiO2纳米片分散至50 mL去离子水中,并超声处理5 min并搅拌1 h。然后按一定锰钴摩尔量比,取适量的硝酸锰、硝酸钴和柠檬酸(柠檬酸的摩尔量等于两种金属摩尔量之和)加入至溶液中继续搅拌5 h之后放入鼓风干燥箱中80 ℃烘干。将烘干后的样品放入马弗炉焙烧;待样品冷却后研磨,过筛获得催化剂样品。
1.3 催化剂活性评价
催化剂活性评价实验在VOCs固定床反应器中进行,石英玻璃反应管内径6 mm,长50 cm。取200 mg 40~60目的样品用石英棉填入反应管中。利用液相甲苯鼓泡法由载气N2流经装有液态甲苯的玻璃鼓泡瓶带出甲苯气体,通过调节载气N2流量和水浴温度控制甲苯浓度约为2 054 mg·m-3。氮气、氧气和甲苯气体在气体混合罐中充分混合后进入催化床反应器。床层温度由程序加热升温控制仪控制。测试反应温度区间为140 ℃~300 ℃,以20 ℃为温度梯度,在每个温度阶段稳定30 min后再采样。反应前后的气体浓度由气相色谱仪(Agilent 6890N)进行检测分析。催化剂活性采用甲苯转化率T进行评价,计算方法如式(1):
T=(CIN-COUT)/CIN×100%
(1)
式中:CIN进气口中甲苯含量,COUT出气口中甲苯含量,单位:mg·m-3。
1.4 催化剂的表征
采用德国Bruker公司D8 ADVANCE多晶(粉末)X射线衍射仪进行X线衍射分析(XRD);采用日本日立公司S4800型扫描电镜显微镜测定样品形貌;采用美国麦克公司ASAP2020M+C型吸附仪测定样品比表面积、孔径结构参数(BET);采用美国麦克公司AutoChemII2920型化学吸附仪测定样品的氧化还原能力(H2-TPR)。
2 结果与讨论
2.1 催化剂物理化学性质表征
2.1.1 XRD分析
图1为焙烧温度300 ℃,活性组分负载量为16 wt%条件下制备不同锰钴摩尔比(催化剂合成时加入Mn、Co物质的量比)的Mn-Co/TiO2催化剂的XRD图谱。由图1可知,TiO2载体在2θ为25.5°、36.9°、37.9°、38.5°、48.2°、53.8°、55°、63.0°、69.2°、70.89°、75.4°出现锐钛矿型衍射峰[24],说明TiO2载体为锐钛矿相,而Mn8-Co1/P25在2θ为27.4°出现微弱的金红石型衍射峰,说明P25为金红石锐钛矿混合相。有研究表明[25],锐钛矿型TiO2表现出比金红石型更好的催化性能。随着锰钴摩尔比的增加,锐钛矿型衍射峰强度逐渐减弱,推测Mn和Co的掺杂导致TiO2结晶度降低,Mn、Co和Ti物种之间形成强烈的相互作用,使得Mn和Co主要以无定形态或者高度分散的状态存在于TiO2表面,这有助于增加表面氧物种及流动性[26]。而当锰钴摩尔比增至10:1,TiO2的特征衍射峰增强,推测这是Mn过量出现烧结现象,导致Mn、Co和Ti物种之间的相互作用减弱,生成Mn2O3,而Mn2O3分散性较好,XRD难以检测出Mn2O3的结晶相[27]。Mn8-Co1/TiO2表现出最弱的TiO2特征衍射峰,说明锰钴摩尔比8:1时,Mn、Co和Ti物种之间的相互作用最强烈,使得表面氧物种增多和氧的流动性增强,从而显著提高了催化剂催化还原性能,这与2.2.1中Mn8-Co1/TiO2甲苯催化活性最高的实验结果相一致。此外,Mn8Co1Oz在2θ为36.4°出现一个宽的衍射峰,可归属于CoMnO3相[28],并且随着将活性组分负载至TiO2,CoMnO3衍射峰消失,进一步说明Mn、Co可以高度分散在TiO2表面,从而提高催化剂的催化性能。

2θ/(°)图1 不同锰钴摩尔比的Mn-Co/TiO2催化剂的XRD图谱
2.1.2 H2-TPR分析
图2为焙烧温度300 ℃、负载量为16 wt%条件下制备不同锰钴摩尔比的Mn-Co/TiO2催化剂的H2-TPR图谱。由图2可知,TiO2基本没有还原性。对于Mn8Co1Ox在200 ℃~300 ℃出现的峰可归为MnxCoyOz被还原成Mn2O3和Co3O4[29],在300 ℃~400 ℃出现的峰可归为Co3O4和Mn2O3被还原为CoO和MnO[30],在400 ℃~600 ℃之间出现的宽峰可归为Co2+被还原为Co0[29-30]。与Mn-Co混合氧化物相比,Mn-Co/TiO2催化剂的还原曲线有很大的不同。对于Mn-Co/TiO2,还原峰的位置和峰面积与锰钴摩尔比有关,随着Mn含量增加,在200 ℃~250 ℃出现明显的双峰,且峰面积增大,可归为Mn-Co/TiO2表面吸附的氧物种、氧空位和Mn4+物种[30-31],而在250 ℃~350 ℃出现的峰可归为Mn2O3和Co3O4被还原为MnO和CoO,在400 ℃~600 ℃出现的峰可归为CoO被还原为Co[31],并且随着Mn含量的增加,峰位置往高温偏移,说明Mn、Co之间存在强烈相互作用,导致Co2+还原越来越困难。根据先前的研究[29,31],Mn-Co/TiO2在3个温度区间发生的还原反应可归为以下3个步骤。
MnxCoyOZ(s)+H2(g)→Mn2O3+Co3O4(s)+H2O(g)
(1)
Mn2O3-Co3O4(s)+H2(g)→MnO+CoO(s)+H2O(g)
(2)
MnO-CoO+H2(g)→MnO(s)+Co(s)+H2O
(3)
此外,通过对H2-TPR峰拟合得到H2消耗(可还原氧物种量)见表1。由表1可知,Mn8Co1Ox在第1个还原峰的H2消耗为2.41 mmol·g-1,远大于其他催化剂,然而考虑到Mn8-Co1/TiO2中Mn和Co负载量仅16 wt%,因此Mn8-Co1/TiO2中单位重量的H2消耗量比Mn8Co1Oz的消耗量高约245%,先前的研究已表明[30],将Mn-Co负载在载体上,其低温还原性更强。结合图2,锰钴摩尔比增大,Mn-Co/TiO2在低温下的第1个还原峰面积随之增大,H2消耗增多,当Mn/Co为8时,H2消耗量达到最大1.20,而Mn/Co增至10,H2消耗量降至0.70。不同锰钴摩尔比的催化剂在第1个还原峰的H2消耗遵循以下顺序:Mn8-Co1/TiO2>Mn4-Co1/TiO2>Mn10-Co1/TiO2>Mn8-Co1/P25>Mn1-Co1/TiO2,其与它们的甲苯催化活性顺序相一致。研究表明,Mn8-Co1/TiO2催化剂具有更多高价态的Mn离子,并且能形成更多的氧空位以及更强的氧移动性,因此具有更好的低温还原性能。

T/℃图2 不同锰钴摩尔比的Mn-Co/TiO2催化剂的H2-TPR图谱

表1 Mn-Co/TiO2催化剂的H2还原温度和消耗量
2.1.3 BET分析
表2为催化剂锰钴摩尔比8:1,活性组分负载量为16 wt%,其在不同焙烧温度下的比表面积、平均孔径和孔容。由表2可知,随着焙烧温度的升高,催化剂比表面积下降,孔径增加,焙烧温度为300 ℃升至500 ℃,催化剂比表面积从61.9 m2·g-1降至51.9 m2·g-1,这说明,催化剂在高温下出现烧结现象,催化剂结构发生改变,比表面积减小,导致催化剂表面活性位点减少,进而降低催化剂的催化性能,这与2.2.2讨论的结果相吻合。此外,同等焙烧温度下,Mn8-Co1/P25的比表面积小于Mn8-Co1/TiO2,这也说明Mn8-Co1/TiO2催化剂中活性组分分散性更好,有更多的活性位点。

表2 Mn-Co/TiO2催化剂在不同焙烧温度下的比表面积、孔径和孔容
2.1.4 SEM分析
图3为锰钴摩尔比为8:1,焙烧温度300 ℃,不同活性组分负载量的催化剂的SEM图。由图3可知,未负载活性组分的TiO2载体为片状的结构,表面平整,并且无序堆叠在一起,具有丰富的孔隙结构。随着Mn-Co活性组分的负载,催化剂表面形貌发生较大的改变,当活性组分负载量为12 wt%和16 wt%时,活性组分能较为均匀的分布在催化剂表面,而负载量增至20%,催化剂表面出现较多和较大的颗粒状物质,其原因可能是活性组分过量,在催化剂浸渍过程中不能均匀覆盖在载体表面,造成团聚堆积现象。过量的活性组分反而容易堵塞催化剂孔隙,减少活性位点,不利于甲苯的吸附和降解,从而降低催化剂的催化性能。

图3 不同活性组分负载量的Mn-Co/TiO2催化剂的SEM图
2.2 催化剂催化氧化性能
2.2.1 不同锰钴摩尔比对Mn-Co/TiO2催化剂活性的影响
图4为TiO2纳米片为载体,活性组分负载量为16 wt%,焙烧温度为300 ℃条件下制备不同锰钴摩尔比的催化剂在反应空速为32 000 h-1时催化氧化甲苯活性的影响。由图4可知,催化剂在较低温度下呈现出良好的甲苯转化效果,随着锰钴摩尔比从1:1增加到8:1时,催化剂甲苯催化反应活性随之增强。特别是Mn:Co为8:1时,催化剂效果最佳(t50≈227 ℃,t90≈238 ℃,t50、t90分别为甲苯转化率达到50%和90%时所需的反应温度),并且在反应温度为240 ℃,甲苯转化率约为100%,然而,当Mn:Co提高至10:1时,催化活性明显降低。由图可知,催化剂的甲苯催化活性遵循以下顺序:Mn8-Co1/TiO2>Mn4-Co1/TiO2>Mn10-Co1/TiO2>Mn8-Co1/P25>Mn8Co1Oz>Mn1-Co1/TiO2。需要指出的是Mn8-Co1/TiO2(t90≈227 ℃)比Mn8-Co1/P25(t90≈245 ℃)和Mn8Co1Oz(t90≈252 ℃)表现出更好的甲苯催化氧化活性,说明TiO2纳米片比P25具有更好的载体性能。Mn8-Co1/TiO2相比较于贵金属Au催化剂[23]、MnCoOx[14]、Mn-Co/CF[16]催化剂,其甲苯的催化氧化活性更高。以上结果表明,TiO2负载Mn、Co活性组分对甲苯具有良好的催化氧化活性。
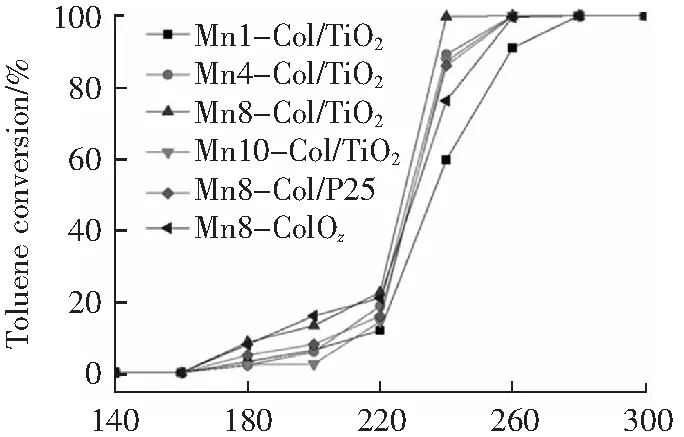
T/℃图4 不同锰钴摩尔比对Mn-Co/TiO2催化剂活性的影响
2.2.2 焙烧温度对Mn-Co/TiO2催化剂活性的影响
图5为锰钴摩尔比为8:1,活性组分负载量为16 wt%在不同焙烧温度下制备的催化剂在反应空速为32 000 h-1时催化剂活性的影响。由图5可知,催化剂在300 ℃焙烧,其甲苯的转化率在反应温度240 ℃下接近100%,而在400 ℃和500 ℃下焙烧的催化剂,甲苯转化率仅73%和28%。这说明焙烧温度可极大的影响催化剂对甲苯的催化活性,催化活性随着焙烧温度的升高而降低。分析认为,在高温焙烧环境中,催化剂表面结构发生改变,进而造成催化剂表面的活性组分分散性降低,活性位点减少,导致催化剂的催化活性降低。结果表明,Mn-Co/TiO2催化剂在较低温度下焙烧,其对甲苯催化活性更好。

T/℃图5 不同焙烧温度对Mn-Co/TiO2催化剂活性的影响
2.2.3 活性组分负载量对Mn-Co/TiO2催化剂活性的影响
图6为锰钴摩尔比为8:1,焙烧温度为300 ℃,不同锰钴活性组分负载量的催化剂在反应空速为32 000 h-1时催化剂活性的影响。由图6可知,不同锰钴负载量的催化剂在反应温度220 ℃~260 ℃区间内对甲苯的催化活性表现出显著差异,其中,Mn-Co负载量为16 wt%的催化剂的催化活性最佳,在反应温度为240 ℃时,甲苯转化率接近100%,其次是20 wt% Mn-Co/TiO2(甲苯转化率92%),12 wt% Mn-Co/TiO2(甲苯转化率64%)。由上述可知,催化剂活性组分负载量存在一个临界值,超过临界值,催化剂的催化活性反而降低。推测活性组分的增加,可以提供更多的催化活性位点,促进更多的甲苯分子与活性组分充分接触,从而提高催化剂的催化活性,然而当负载量超过16 wt%时,催化剂表面活性组分出现堆积,造成分散度降低,活性位点反而减少,不利于甲苯分子吸附和催化,从而导致催化活性的降低。因此,适宜的活性组分负载量可以提高Mn-Co/TiO2催化剂催化氧化甲苯的性能。

T/℃图6 不同活性组分负载量对Mn-Co/TiO2催化剂活性的影响
2.2.4 空速对Mn-Co/TiO2催化剂活性的影响
图7为锰钴摩尔比为8:1,焙烧温度300 ℃,活性组分负载量为16 wt%条件下制备的催化剂在不同空速条件下对催化剂活性的影响。空速的大小直接反映催化剂与污染物分子接触反应时间的长短。由图7可知,当空速从16 000 h-1增加至32 000 h-1,催化剂催化活性并未有明显的降低,两空速条件下的t90≈238 ℃,表明即使空速增加1倍,甲苯分子与催化剂依然可以保持充分接触,在较低温度下实现甲苯的高效去除。然而当空速增加至64 000 h-1,在238 ℃的反应温度下,催化剂活性明显降低,并且其t90≈260 ℃,与低空速下对应的t90相比,升高了近22 ℃。这是因为在此空速下,甲苯分子与催化活性组分之间接触时间极短,催化反应不充分,部分甲苯分子来不及稳定吸附在催化剂表面进行反应就离开了催化剂反应层,而只有更高的反应温度下,才能使甲苯分子完全转化。
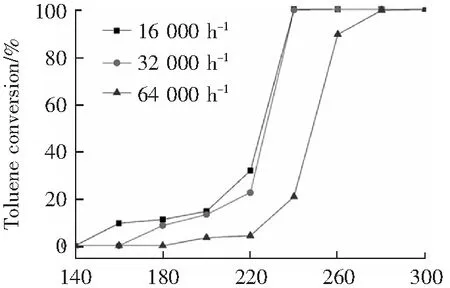
T/℃图7 不同反应空速条件对Mn-Co/TiO2催化剂活性影响
3 结论
采用二维TiO2纳米片为载体制备的Mn-Co/TiO2催化剂对甲苯具有良好的催化性能。在锰钴摩尔比为8:1,负载量为16 wt%,焙烧温度为300 ℃,空速为32 000 h-1的条件下,Mn-Co/TiO2催化剂在240 ℃下甲苯转化率达100%。TiO2的二维片状结构有助于活性组分的分散,提高催化剂比表面积,并且Ti与Mn-Co之间可形成强烈的相互作用,有利于更多高价态Mn离子和氧空位的形成,增强了Mn-Co/TiO2的深度氧化能力,提高了氧化还原性能。与MnCoOx和Mn-Co/P25催化剂相比,Mn-Co/TiO2对甲苯具有更好的催化活性。
