产表面活性素野生菌株的筛选、鉴定及其发酵条件研究
2021-07-16冉新炎齐素敏韩广泉陈丹丹陶宁李圆圆王丽荣
冉新炎,齐素敏,韩广泉,陈丹丹,陶宁,李圆圆,王丽荣
(山东碧蓝生物科技有限公司/泰安市植物微生态制剂重点实验室,山东 泰安 271000)
表面活性素(surfactin)是芽孢杆菌属(Bacillus sp.)菌株产生的次级代谢产物,是由七元肽和1条β-羟基脂肪酸链组成的环状脂肽,有多种同系物,根据碳链长度可分为C12~C16共5种组分[1-3]。与一般化学表面活性剂相比,表面活性素除具有降低表面张力、稳定乳化液和增加泡沫等作用外,还具备热稳定、无毒、生物降解性和更强的表面、界面活性等优点[4];具有多种生物活性,可抑制细菌、真菌、支原体的生长[5,6],其主要作用于病原菌细胞膜的磷脂双分子层,改变细胞膜通透性和功能性,从而抑制病原菌的生长[7],且不易产生耐药性[8,9]。抗菌脂肽作为高效表面活性剂和新型抗菌物质,在农业生物防治[10,11]、食品保鲜[12-14]、石油工业[15,16]等方面具有广泛应用。
surfactin天然合成量相对较低,工业化发酵产率不高,高昂的成本限制了其在多领域的应用。surfactin的产量与菌株有关,因此提高菌株的产脂肽能力一直是研究热点。获得surfactin高产菌株是降低成本的最有效方法[4],从环境中筛选高产野生菌株难度较大,国内外研究大多集中在对原始菌株通过诱变、代谢工程改造、基因组改造等手段来提高其产量。李光等[17]利用常压室温等离子体方法对枯草芽孢杆菌进行快速诱变获得突变菌株B.subtilis SF90-5,其产surfactin能力是原始菌株的5倍。周泽宇等[18]利用代谢工程改造B.amyloliquefaciens后surfactin含量虽提高48%,但其最高产量仅达50.17 mg/L。因此,若通过改造菌株提高其产surfactin能力需要建立在优良野生菌株的前提下,但目前对高产surfactin野生菌株的筛选研究较少。研究者根据surfactin具有较强溶血细胞的能力这一特性建立了通过溶血圈来筛选产surfactin菌株的经典血平板法[17],但该方法单一且具有一定的局限性。
本研究通过血平板初筛、排油活性、抑菌试验、高效液相色谱法等相结合的方法从土壤中分离筛选得到一株高产surfactin且具有广谱抑菌性、应用前景广阔的野生菌株,同时,研究了其发酵条件,旨在为进一步提高菌株产surfactin能力,实现surfactin工业化生产提供更为优质的菌株资源和数据支持,进而为降低开发成本奠定基础。
1 材料与方法
1.1 试验材料
土壤采自山东省泰安市周边菜园。
根腐病病原菌和灰霉病病原菌均由山东宝来利来生物工程股份有限公司菌种资源保藏中心提供。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂2%,水1 000 mL;LB培养基:蛋白胨10 g,酵母粉5 g,NaCl10 g,水1 000 mL,pH=7.0,固体培养基加琼脂粉15 g;血琼脂平板购自上海科玛嘉微生物技术有限公司。
surfactin标准品购自Sigma公司。
1.2 菌株的筛选
1.2.1 菌株的分离筛选 取土壤10 g于90 mL无菌水中,振荡混匀,稀释成合适梯度后涂布于LB固体培养基,在37℃培养箱中培养1 d,每种土壤样品选取1~2个具有典型芽孢杆菌特征菌落划线于LB固体培养基上,37℃培养1 d,挑取单菌落镜检并接种于LB斜面,保存备用。
1.2.2 溶血性检测 将分离、活化菌株接种于血平板上,37℃培养箱中培养2 d,测量菌落直径R1和溶血圈直径R2,计算溶血性(I)。I=(R2-R1)/R1。
1.2.3 发酵上清液的制备 将分离筛选得到的菌株接种于LB液体培养基中,37℃、170 r/min培养48 h,10 000 r/min离心15 min,上清液过0.22 μm孔径滤膜除菌,4℃保存。
1.2.4 排油活性检测[19]取一直径9 cm的培养皿,加入无菌水,再加入0.2 mL大豆油使之在水面形成油膜,然后在油膜中心加入0.01 mL发酵上清液,中心油膜会被挤向四周形成一个圆圈,测量排油圈的直径,每个处理重复3次取平均值。
1.2.5 拮抗性能 以根腐病和灰霉病病原菌为指示菌,采用平板对峙法:抠取病原真菌菌饼置于PDA平板四周,将供试菌株用接种环接种在平板中央,在28℃培养箱中培养2~5 d,用直尺测量抑菌带大小,比较菌株对不同病原真菌的拮抗性能差异。
1.2.6 surfactin含量测定 参考艾嘉[20]液相色谱法并略加修改。HPLC分析系统为岛津AT20,色谱柱为AQ-C18(250 mm×4.6 mm×5μm);流动相A为无水乙腈,流动相B为0.1%三氟乙酸(V/V)。采用梯度淋洗方式分析,变化条件为:0~8 min:A 70%~85%,B 30%~15%;8~30 min:A:B=85:15;31~40 min:A:B=70:30。流速0.8 mL/min,柱温30℃,紫外检测器检测波长205 nm,进样量20μL。
1.3 菌株的鉴定
形态学特征及生理生化性质:将菌株接种于LB固体培养基中,37℃培养24 h,观察菌落形态、大小、边缘、表面、凹凸度、透明度等,并进行革兰氏染色,具体测定方法参照《常见细菌系统鉴定手册》[21]。
将分离菌株接种到LB液体培养基中,37℃、180 r/min过夜培养[22],取1~5 mL菌液利用细菌基因组DNA 提取试剂盒提取菌株基因组DNA。利用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)对细菌的16S rRNA基因进行PCR扩增。PCR反应体系(50μL):DNA模板2μL,Mix 25μL,27F 1μL,1492R 1μL,ddH2O 21 μL。PCR扩增程序:95℃4 min;94℃30 s,52℃80 s,72℃90 s,30个循环;72℃8 min。将纯化后的产物交给上海博尚生物工程股份有限公司进行测序。将得到的序列在NCBI上进行BLAST比对。
1.4 基础发酵培养基的筛选
根据相关文献[23-26],在前期试验的基础上,选取8种有利于抗菌脂肽形成的培养基(表1)进行对比发酵,筛选产surfactin的最佳发酵培养基。

表1 培养基种类及组成
筛选方法:在250 mL三角瓶中,先利用LB培养基活化培养24 h,然后以2%的接种量接种到9种不同发酵培养基中(装液量50 mL),170 r/min、37℃、自然pH条件下进行培养。每种培养基3个重复。培养48 h后,取样检测各瓶发酵液中的surfactin含量,确定最佳培养基。
1.5 surfactin最佳产生时间的确定
首先用LB培养基在37℃、170 r/min条件下培养24 h活化种子液,按照2%接种量接种到含50 mL筛选出的培养基(250 mL三角瓶)中,于37℃、170 r/min下培养,每4 h取样检测surfactin含量,初步确定surfactin最佳产生时间。
1.6 发酵条件的研究
以筛选出的培养基为基础培养基,采用单因素试验研究发酵条件,如pH、发酵温度、转速等对surfactin产量的影响,每组试验3个重复。
2 结果与分析
2.1 菌株的筛选
2.1.1 溶血性、排油活性和拮抗性能 由表2可知,0077、BLK07、BLK09、BLK012、BLK014、K-19、BLK020、BLK021、BLK026、BLK027、BLK030、BLK035、BLK036、BLK041共14株菌的排油圈直径均大于3.0 cm,具有较强的排油活性。上述14株菌均对灰霉病和根腐病病原菌均有一定的拮抗效果,共9株菌对两种病原菌的抑菌带宽均大于0.20 cm,其中有4株菌(BLK09、BLK014、K-19、BLK036)拮抗效果最好,抑菌带宽均大于0.40 cm。部分菌株发酵上清液的排油活性和对根腐病、灰霉病病原菌的拮抗效果见图1和图2。上述14株菌中除BLK026、BLK030、BLK035菌株外基本无溶血性,说明溶血性并不一定是产surfactin菌株的典型特征。根据相关文献,纯生物表面活性剂的含量和透明圈的直径呈线性关系[27],综合考虑,挑选菌株BLK07、BLK09、BLK014、K-19、BLK027、BLK030、BLK035、BLK036进行下一步试验。

图1 菌株K-19发酵上清液的排油圈
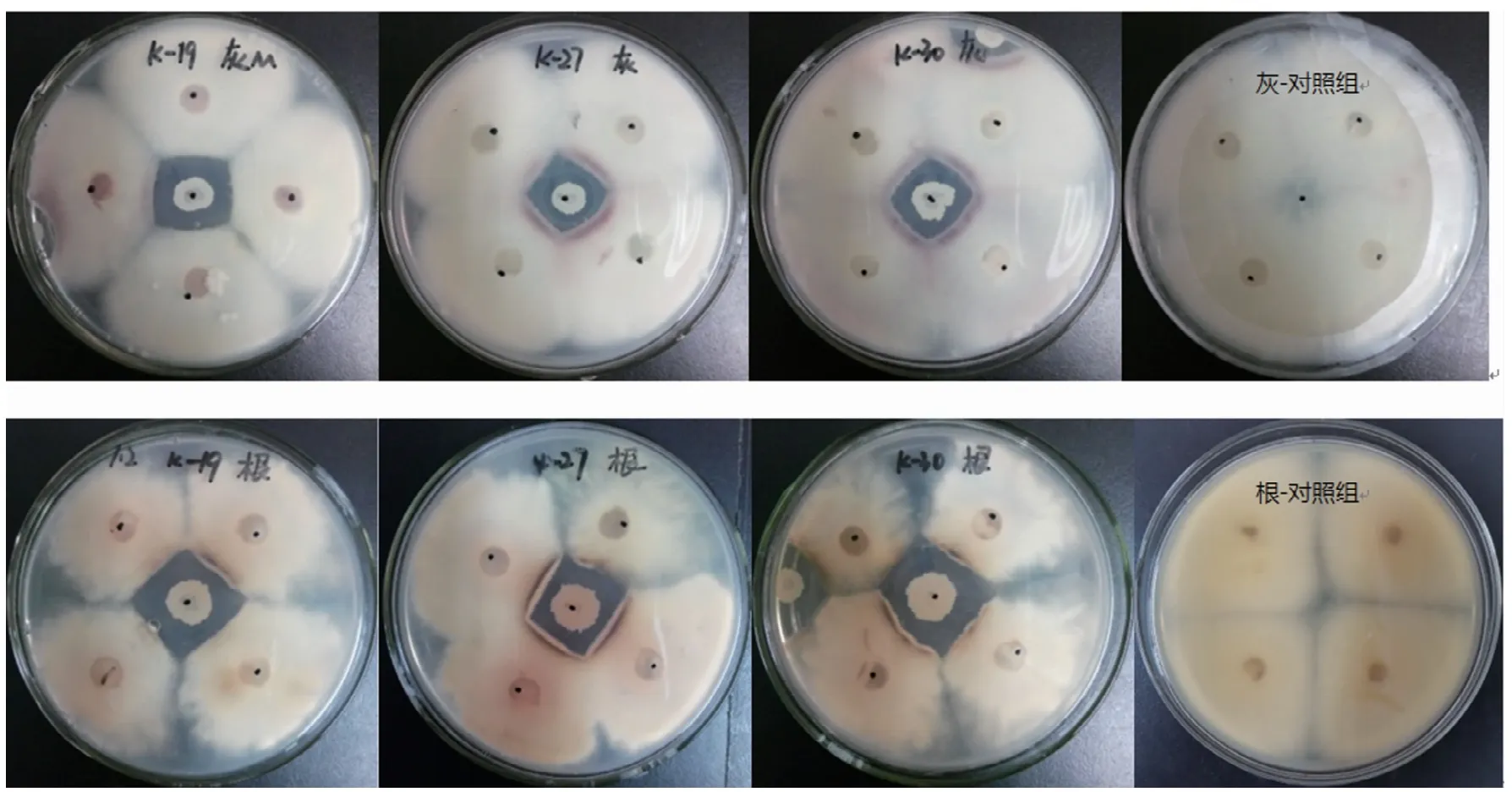
图2 部分菌株对灰霉病和根腐病病原菌的平板对峙试验

表2 分离菌株的溶血性、排油活性及其对常见植物病原菌的拮抗效果
2.1.2 发酵液中surfactin含量检测 从图3中可以看出,BLK09、BLK014和K-19菌株产表面活性素浓度均达200 mg/L以上,其中K-19菌株产surfactin含量最高,达366.58mg/L。在目前关于筛选产surfactin天然菌株的文献中其surfactin产量处于较高水平,具有较强使用价值。对比排油圈直径和HPLC检测结果可知,排油圈直径与surfactin产量有一定的相关性。

图3 筛选菌株发酵液中surfactin含量
2.2 菌株的鉴定
K-19菌株为革兰氏阳性菌,显微镜下观察呈杆状,大小为0.6μm×(1.0~1.4)μm,具有圆形末端,单个或成对分组,形成内生孢子;孢子为椭圆形,中生;孢子囊没有肿胀。培养24 h后其菌落不光滑,不透明,边缘不规则,乳白色,圆形菌落,直径2~4 mm,略有齿状边缘,在中心有明显褶皱突起,质地粘稠(图4)。具体生理生化特征见表3。

表3 K-19菌株的生理生化特性

图4 菌株K-19菌落形态
BLAST比对分析结果表明,K-19菌株与Bacillus velesensis strain EN01、Bacillus velesensis strain LB002、Bacillus amyloliquefaciens strain V167、Bacillus velesensis strain YL17的同源性分别为99.93%、99.93%、99.79%、99.79%。综合形态特征、生理生化特性和16S rRNA基因序列分析,确定该菌株属于贝莱斯芽孢杆菌(Bacillus velesensis)。
2.3 基础发酵培养基筛选
以LB培养基的产量(366.58 mg/L)为对照,在同种发酵条件下,8号培养基的surfactin产量显著提高(843.24 mg/L)(图5),约为LB培养基的2.3倍;其次是6号和7号培养基,培养基成分均含有豆粕和葡萄糖。6号培养基在7号培养基的基础上添加了微量元素,说明铁、镁、锰离子能共同促进抗菌脂肽surfactin的产生。有研究显示[28-31],Mg2+、K+、Mn2+和Fe2+等离子对抗菌脂肽的产量有影响,目前已观察到在B.subtilis中存在铁离子和锰离子的主动运输系统,二者在生物合成过程中参与了酶的合成。此外,Kinsinger等[32]研究表明B.subtilis内用于激活抗菌脂肽合成的PCP区域的Sfp蛋白活性位点需要Mg2+作为辅助因子,因此Mg2+在抗菌脂肽合成中至关重要。对比结果,选择8号培养基为基础发酵培养基进行下一步试验。
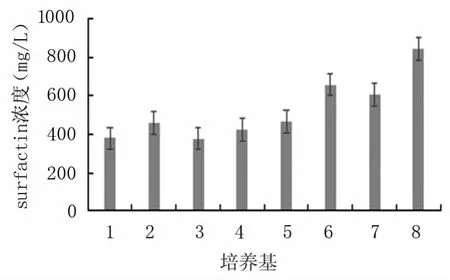
图5 不同培养基对K-19产surfactin的影响
2.4 发酵最佳时间的确定
由图6可知,surfactin产量随着菌体细胞的增加而增加,16~42 h大量、快速合成,42 h时达到最大值,之后略有下降。发酵液的抑菌圈直径与surfactin含量变化呈正相关,随着发酵时间的延长,surfactin产量逐渐增加,发酵液对根腐病病原菌的抑菌性逐渐增加。综合考虑,选择42 h为菌株K-19的最佳发酵时间。
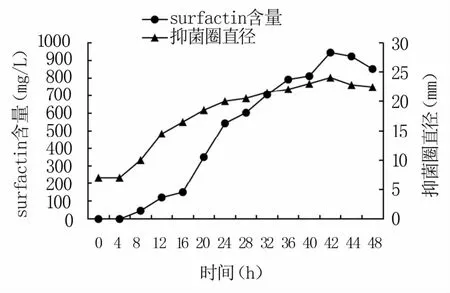
图6 K-19菌株surfactin的合成曲线
2.5 培养条件优化
由图7可知,发酵温度35℃时surfactin产量最高。温度对微生物代谢产物合成具有重要影响,温度过高或是过低都不利于菌体的生长和代谢产物的产生。温度较低时,菌体细胞生长缓慢,导致发酵周期延长;温度过高时,又会影响菌体代谢中某些酶的活性,不利于surfactin合成。因此,发酵温度选择35℃。

图7 温度对surfactin产量的影响
由图8可知,K-19菌株在pH为5~8范围内均能产生surfactin,当pH=7时产量最高。由图9可知,在相同条件下,随着转速的增加,surfactin产量总体呈上升趋势,160 r/min下surfactin的产量最高。超过160 r/min后,呈下降趋势。这是因为芽孢杆菌是好氧性细菌,溶氧量对菌体细胞的生长代谢有重要影响。转速增高时,会增加培养液中的溶氧量,有利于菌体生长代谢;而转速过高不利于surfactin合成。
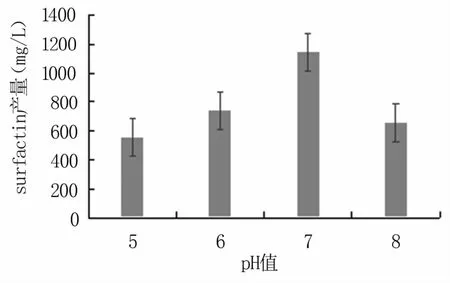
图8 pH值对surfactin产量的影响

图9 转速对surfactin产量的影响
综上,菌株K-19产surfactin的最佳发酵条件为рН=7、发酵温度35℃、转速160 r/min,在此条件下,合成surfactin的产量可达1.40 g/L。
3 讨论与结论
本研究分离筛选得到的菌株发酵液排油圈直径和surfactin产量有一定的相关性,且这些菌株不全具有溶血性。这与龚谷迪等[27]的结论不一致。通过本研究可以看出,排油性为产surfactin菌株的典型特征,而溶血性为非典型特征。因此,用溶血圈法进行初筛有一定的弊端,可能会漏掉产抗菌脂肽较好的菌株。本研究通过多种方法结合筛选得到一株高产脂肽类表面活性素surfactin的贝莱斯芽孢杆菌,弥补了用单一方法进行菌株筛选的不足。
抗菌脂肽一般由多种同系物组成,其产生受环境的影响很大,其中培养基是重要的影响因素[25]。本研究发现,最有利于贝莱斯芽孢杆菌K-19产生surfactin的培养基成分为豆粕40 g/L、葡萄糖9 g/L、MgSO40.2 g/L、MnSO42.5 mg/L、FeSO40.8 mg/L、L-谷氨酸3 mg/L,最佳培养条件为рН =7、发酵温度35℃、转速160 r/min,在此条件下发酵培养42 h,贝莱斯芽孢杆菌K-19合成surfactin的产量可达1.40 g/L。
大量研究表明,脂肽类表面活性剂在芽孢杆菌的生物防治过程中起着重要的作用[7]。贝莱斯芽孢杆菌K-19发酵周期短,易产生脂肽类表面活性剂,对多种植物病原菌有很好的抑制作用,因此该菌株具有进一步开发、生产抗菌脂肽及生物防治产品的潜力。
