AaMcm1基因调控链格孢菌丝生长的转录组初步分析
2021-07-16李珊珊毛胜洁刘琛徐后娟张丽
李珊珊,毛胜洁,刘琛,徐后娟,张丽
(山东农业大学植物保护学院,山东 泰安 271018)
链格孢菌(Alternaria alternata)属链格孢属,为一种重要的致病真菌,其侵染烟草导致的赤星病是一种发生在烟叶成熟后期的真菌性病害,发病快、易于流行,给烟叶生产带来巨大的经济损失[1]。链格孢菌还可侵染多种作物如梨、枣、柑橘、番茄等[2]。MADS box蛋白是高度保守的结合型转录因子家族,在真核生物中广泛存在并参与多种生物学过程[3-5]。在动物和真菌中存在两种类型的MADS box基因,分别为SRF-like(类型Ⅰ)和MEF2-like(类型Ⅱ)[6]。Smp1和Rlm1属于MEF2型,Arg80和Mcm1属于SRF型[7,8]。Mcm1基因目前已在多种真菌中得到研究。在酿酒酵母中,Mcm1在细胞周期转录、微小染色体的维持、一般代谢等方面发挥重要作用[9-11];在白色念珠菌(Candida albicans)中,CaMcm1对菌落的形态建成起着重要作用[12];在稻瘟菌(Magnaporthe oryzae)中,MoMcm1参与雄性不育、小分生孢子的产生及致病等过程[13];在核盘菌(Sclerotinia sclerotiorum(Lib.)de Bary)中,SsMcm1被证明能够调控菌丝生长和毒力[14];在禾谷镰刀菌(Fusarium graminearum)中,FgMcm1基因调控细胞确认、有性和无性生殖、次级代谢和致病力等[15]。本课题组前期将链格孢中的AaMcm1基因进行敲除并得到了突变体△AaMcm1,突变体生长速度严重变缓,与野生菌相比7天的生长降低率达到74.54%,分生孢子产量减少,黑色素和几丁质含量降低,致病力减弱(未发表),构建回补体发现回补体性状基本恢复至野生菌水平。本研究对突变体△AaMcm1及其野生菌进行转录组测序研究,分析差异表达基因和信号通路,以期从转录组层面分析突变体生长变化的原因。
1 材料与方法
1.1 供试菌株
链格孢野生型菌株YS-16(Alternaria alternata YS-16)和突变体△AaMcm1(AaMcm1基因敲除)为课题组前期获得。
1.2 总RNA的提取和转录组测序
分别取等量生长7天的野生菌YS-16和突变体△AaMcm1的菌丝在PDB培养基(马铃薯葡萄糖培养基)中28℃摇菌培养5天,培养完成后进行过滤,取一定量的菌体液氮冷冻后提取RNA。总RNA的提取及cDNA文库的构建均由生工生物工程(上海)股份有限公司完成,每个处理设置3个生物学重复。
1.3 差异表达基因的筛选和功能富集分析
采用DESeq2软件进行差异表达基因的筛选。分别使用topGO及clusterProfiler进行GO富集分析及KEGG通路分析[16]。差异基因的注释通过参考基因组Alternaria alternata strain SRC1lrK2f(https://www.ncbi.nlm.nih.gov/nuccore/LXPP00000000.1)进行。
1.4 AaMcm1基因结合位点分析
通过JASPAR网站预测AaMcm1基因的结合位点[17]。
2 结果与分析
2.1 差异表达基因的筛选
将野生菌与突变体的基因表达量进行比较,根据以下标准筛选差异表达基因:①2个样本至少有一个MeanTPM值大于等于5;②差异倍数log2(Fold Change)的绝对值大于1;③p-value或q-value<0.05。筛选到3 239个差异表达基因,其中上调表达基因有1 917个,下调表达基因有1 322个(图1)。
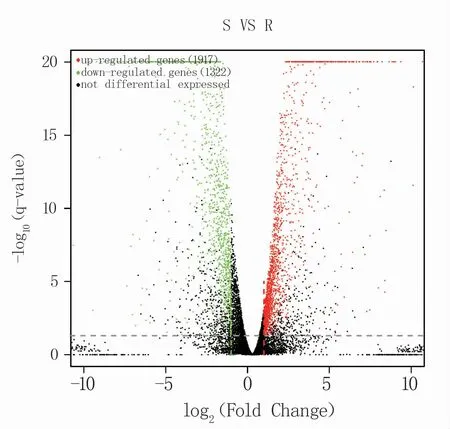
图1 差异表达基因火山图
2.2 GO富集分析
分别对上调差异表达基因和下调差异表达基因进行了GO富集分析,结果表明,在上调差异表达基因中,参与生物学过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)的基因分别有4 057、1 260个和783个(图2)。生物学过程中差异表达基因数目最多的前5个途径分别为细胞过程(cellular process)、代谢过程(metabolic process)、生物调节(biological regulation)、生物过程调节(regulation of biological process)和应激反应(response to stimulus);分子功能中差异表达基因主要参与催化活性(catalytic activity)和结合(binding);细胞组分中差异表达基因主要参与细胞(cell)和细胞部分(cell part)。

图2 上调差异表达基因GO富集分析
在下调差异表达基因中,参与生物学过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)的基因分别有2 825、1 069个和378个(图3)。生物学过程中差异表达基因数目最多的前8条途径分别为细胞过程(cellular process)、代谢过程(metabolic process)、生物调节(biological regulation)、定位(localization)、定位的建立(establishment of localization)、生物过程调节(regulation of biological process)、细胞组分组织或合成(cellular component organization or biogenesis)和应激反应(response to stimulus);分子功能中差异表达基因主要参与催化活性(catalytic activity)和结合(binding);细胞组分中差异表达基因主要参与细胞(cell)和细胞部分(cell part)。
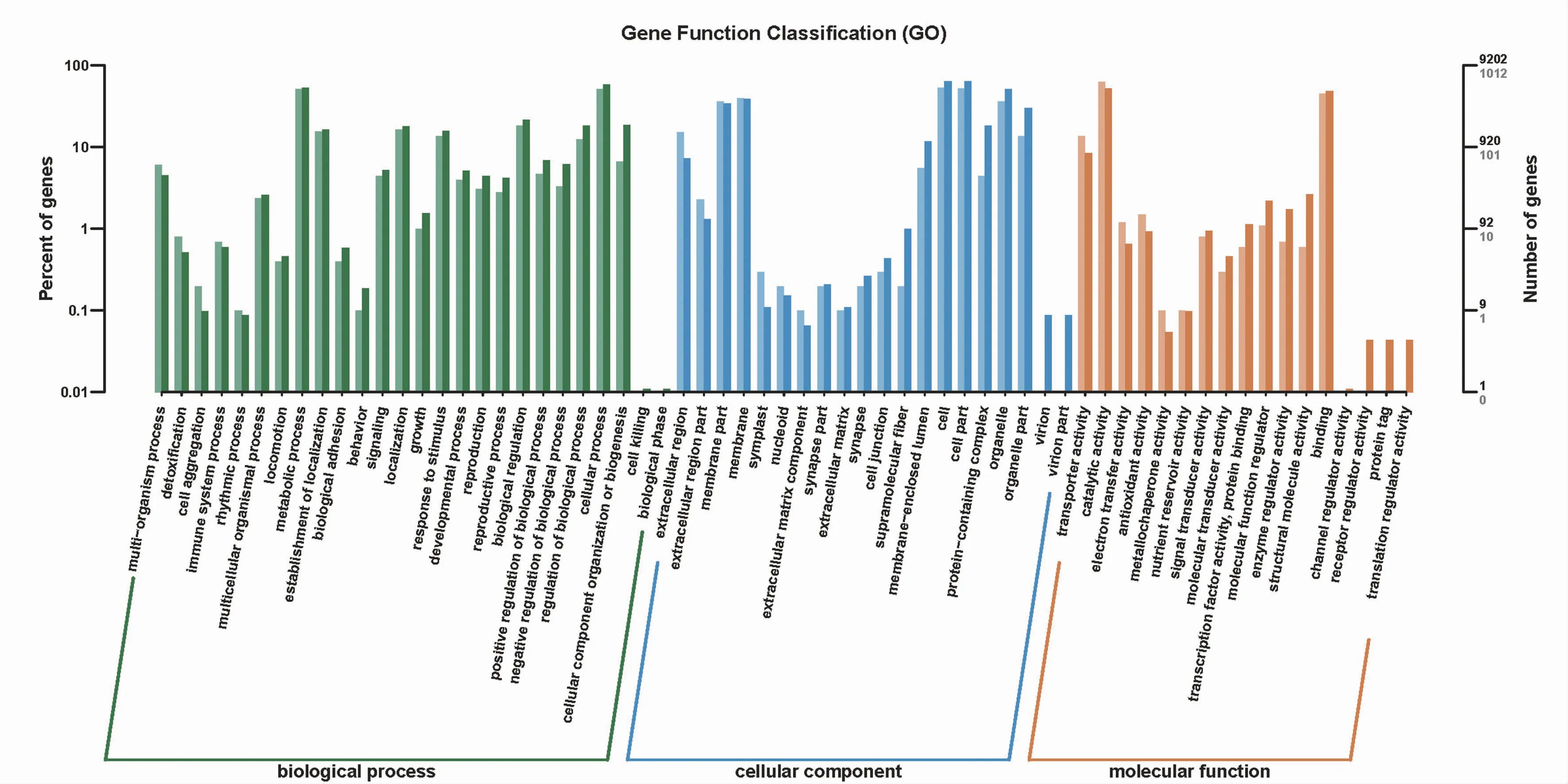
图3 下调差异表达基因GO富集分析
2.3 KEGG通路分析
分别对上调差异表达基因和下调差异表达基因进行KEGG通路分析,结果表明,共有429个上调差异表达基因参与了191条信号通路,参与最多的信号通路包括真核生物核糖体合成(ribosome biogenesis in eukaryotes)、嘌呤代谢(purine metabolism)、细胞周期-酵母(cell cycle-yeast)、核苷酸切除修复(nucleotide excision repair)、DNA复制(DNA replication)等(图4),说明上调差异表达基因主要参与了遗传信息处理过程。207个下调差异表达基因富集到170条信号通路中,其中碳代谢(carbon metabolism),淀粉和蔗糖代谢(starch and sucrose metabolism),甘氨酸、丝氨酸和苏氨酸的代谢(glycine,serine and threoninemetabolism),酪氨酸代谢(tyrosine metabolism)等通路涉及到的差异基因数量较多(图5),表明下调差异表达基因主要参与了真菌的代谢过程,对真菌的生长代谢方面产生重要影响。

图4 上调差异表达基因KEGG通路分析

图5 下调差异表达基因KEGG通路分析
2.4 差异基因功能分析
按照差异倍数从大到小排序,筛选出上调及下调倍数最大的前30个差异基因进行功能注释(表1)。上调基因主要参与了氨基酸代谢(amino acid metabolism)、DNA复制(DNA replication)、淀粉和蔗糖代谢(starch and sucrosemetabolism)、蛋白质降解(protein degradation)等过程,下调基因主要参与了脂肪酸的合成和代谢(fatty acid synthesis and metabolism)、氨基酸的降解(amino acid degradation)、碳代谢(carbon metabolism)、嘌呤代谢(purinemetabolism)等生物学过程。

表1 前30个上调及下调差异表达基因功能注释

表1(续)
2.5 AaMcm1基因影响链格孢菌的碳水化合物代谢
KEGG信号通路富集结果显示,参与碳水化合物代谢途径的下调差异表达基因较多,在250个差异表达基因中上调基因有73个,而下调基因有177个,占70.8%。碳水化合物代谢作为真菌的重要供能方式,在菌丝生长代谢过程中发挥着巨大作用。Mcm1基因的缺失导致糖酵解、三羧酸循环过程中基因下调表达明显,从而导致真菌体内糖分不能正常代谢,有理由认为这是突变体生长速度严重下降的重要影响因素。
三羧酸循环中,柠檬酸合成酶催化的反应是关键步骤,草酰乙酸的供应有利于循环顺利进行[18]。分析结果显示丙酮酸(pyruvate)生成草酰乙酸(oxaloacetate)的过程中基因CC77DRAFT_1020016表达量降低,导致草酰乙酸供应不足。三羧酸循环作为生物体将糖或其他物质氧化而获得能量的最有效方式,其效率的下降导致了突变体获得能量减少,影响了菌丝生长。葡糖酸-6-磷酸(gluconate-6P)转变为5-磷酸核糖(rlbulose-5P,CC77DRAFT_1031635)和异柠檬酸(isocitrate)生 成 琥 珀 酸(succinate,CC77DRAFT_926519)这两个放能反应中差异基因表达下调,导致生物体供能受限;而葡萄糖(glucose)生成葡萄糖-6-磷酸(glucose-6P,CC77DRAFT_648740)、葡糖酸-1,5-内酯(glucono-1,5-lactone)生成葡糖酸(gluconate,CC77DRAFT_948992和CC77DRAFT_1021942)、葡糖酸(gluconate)生成葡糖酸-6-磷酸(gluconate-6P,CC77DRAFT_594108)、琥珀酸(succinate)生成延胡索酸(fumarate,CC77DRAFT_979964)、草酰乙酸(oxaloacetate)生成磷酸烯醇式丙酮酸(phosphoenolpyruvate,CC77DRAFT_1021809)等反应中差异基因表达也下调。以上结果有力说明突变体中有氧呼吸过程受到限制,产能减少。
2.6 AaMcm1基因影响链格孢菌的氮代谢
KEGG富集结果显示,在所有的氮代谢过程中有158个差异表达基因上调,175个差异表达基因下调,97%的下调基因都富集在氨基酸的代谢过程中。表明敲除AaMcm1基因严重影响了链格孢的氨基酸代谢,进而影响了链格孢体内蛋白质的合成过程。蛋白质作为构成细胞的基本有机物,是生命活动的主要承担者,其合成过程发生任何变化,都会导致链格孢生长产生不同程度的变化。
2.7 AaMcm1基因结合位点分析
通过JASPAR网站,利用AaMcm1基因的氨基酸序列预测得到该基因的两个结合位点(图6)。
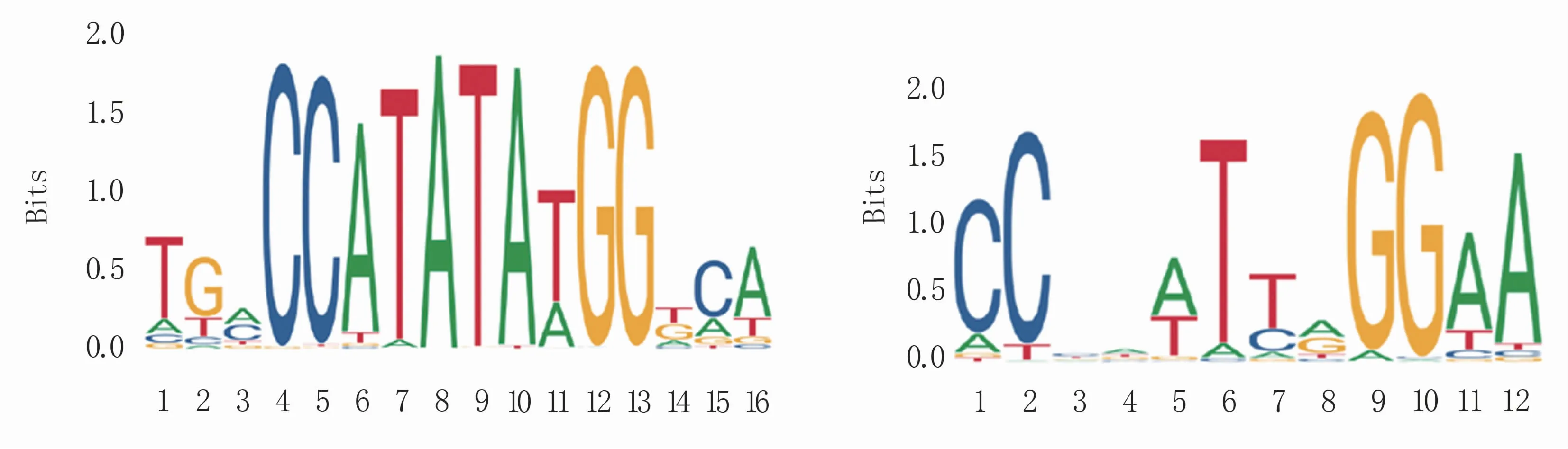
图6 AaMcm1结合位点分析
3 讨论与结论
应用RNA-seq技术可以研究特定生长状态下不同真菌的基因表达情况,目前RNA-seq技术已被应用于Mcm1基因的功能研究。在球孢白僵菌(Beauveria bassiana)中,转录组测序分析表明对BbMcm1基因进行破坏会导致122个基因表达上调,118个基因表达下调,分别与致病性、细胞壁、细胞周期及DNA加工等过程相关[19];在大丽轮枝菌中,差异表达分析表明,与野生型菌株相比,在VdMcm1敲除突变体中有351个基因上调,823个基因下调,GO和KEGG分析显示823个下调的基因参与了各种细胞过程[20]。本课题组前期得到链格孢菌Mcm1基因敲除突变体,发现其生长速度严重降低,分生孢子产量减少,黑色素和几丁质含量降低,致病力减弱,对其进行转录组测序研究后,发现1 917个基因表达上调,1 322个基因表达下调,GO分析表明下调基因参与了2 825个生物学过程,主要为细胞过程和代谢过程,KEGG通路分析结果显示下调基因主要参与碳代谢、淀粉和蔗糖代谢等过程。由此推测AaMcm1基因通过调控不同代谢通路的基因表达控制菌丝的生长等功能[21]。
真菌菌丝的生长主要通过碳水化合物的供能来获得营养。研究发现,AaMcm1基因的敲除导致参与碳水化合物代谢过程中70.8%的基因表达下调,在三羧酸循环中基因下调明显,参与有氧呼吸的基因如CC77DRAFT_1020016、CC77DRAFT_1031635、CC77DRAFT_926519、CC77DRAFT_648740、CC77DRAFT_948992、CC77DRAFT_1021942、CC77DRAFT_594108、CC77DRAFT_979964、CC77DRAFT_1021809等均下调表达。有氧呼吸作为生物体利用有机物、产生ATP的方式,产生的多种中间产物也可以作为其他反应化合物所需的原料[22]。有氧呼吸被抑制,导致生物体内产能减少,各种有机物合成受到抑制,进而影响生物体的各种代谢过程,使其生长变慢,生命活动降低。
AaMcm1基因的敲除导致全基因组中部分基因表达上调或者下调,其原因可能是某些基因是该基因直接作用的靶基因或者是靶基因表达异常间接导致的基因表达差异[23]。本研究对该基因的结合位点进行了分析,推测在链格孢中该基因有两个结合位点,后续将对这两个结合位点进行进一步的试验验证,找到可以与其结合的下游靶标基因,进行基因敲除验证。
AaMcm1基因在MAPK级联信号通路中的HOG及FUS3途径中发挥功能,HOG途径主要与细胞壁的合成和细胞渗透压有关,FUS3则与菌丝生长、孢子的产生及致病性相关[24,25]。转录组测序结果显示,参与几丁质和黑色素合成、细胞壁降解酶合成、分生孢子产生、致病力的部分基因均有表达下调现象,表明AaMcm1基因的敲除影响了链格孢体内MAPK信号通路功能的行使。后续将会对这些方面的差异基因进行深入分析,以期更全面地了解链格孢AaMcm1基因的调控网络。
