巨噬细胞的极化与脊髓胶质瘢痕形成的一般规律研究
2021-07-15杨明坤张旭党晓谦吴登普刘泯邑
杨明坤,张旭,党晓谦,吴登普,刘泯邑
(1.四川省巴中市中心医院骨科,四川 巴中 636000;2.西安交通大学第二附属医院骨二科,陕西 西安 710000)
脊髓损伤是常见的疾病,尤其是完全性脊髓损伤,常出现多种并发症,甚至导致患者死亡[1]。截止目前,脊髓损伤的治疗方法及效果仍然有限,究其原因是脊髓损伤后胶质瘢痕形成阻碍了神经轴突的修复,而脊髓胶质瘢痕的形成是复杂的病理变化过程[2-4]。
炎症反应是中枢神经系统损伤后最为重要的病理过程之一。巨噬细胞是炎症反应中最为重要的炎症细胞,具有加重炎症反应和促进组织再生的双重作用[5-7]。巨噬细胞之所以表现出这种双重作用,与巨噬细胞在脊髓损伤后表现为不同极化的亚型有关,目前已证实在脊髓损伤后巨噬细胞可极化为不同的亚型[8-10]。但是巨噬细胞的极化与胶质瘢痕形成的关系规律未见相关报道。本研究拟通过实验探讨巨噬细胞与胶质瘢痕形的一般规律,为后期通过调控巨噬细胞极化过程,促进脊髓损伤治疗提供新的思路。
1 资料与方法
1.1 实验动物分组及伦理学审查 实验小鼠随机分为实验组和对照组;实验组分为脊髓损伤后1 d、7 d、14 d、28 d组,每组5只,对照组20只,共计40只。实验动物为SPF级雄性级小鼠(C57BL/6,鼠龄45~56 d)由三峡大学购进。实验实施前经相关伦理委员会审查通过。
1.2 脊髓损伤模型的构建 所购小鼠适应性饲养3 d后,采取腹腔注射4%水合氯醛麻醉。手术区域脱毛后,皮肤消毒,采取纵行切口,切除T9~10棘突及椎板,暴露硬脊膜。实验组使用砸伤装置将10 g重锤固定于5 cm高度,自由落下撞击T9~10脊髓组织[11]。造模成果的标志为:砸伤瞬间小鼠出现痉挛性摆尾及双后肢回缩后瘫痪。对照组仅切除T9~10棘突及椎板,不损伤脊髓。所有小鼠术后给予保暖,麻醉苏醒后移入动物房,正常喂养,术后前3天每日1次腹腔注射青霉素2万单位,人工挤压挤膀胱尿2次。实验过程中出现死亡小鼠及时再次造模补充。
1.3 胶质瘢痕的观察 分别于实验组脊髓损伤后1 d、7 d、14 d、28 d取损伤区域脊髓标本进行如下检测观察胶质瘢痕。(1)HE染色:将标本经75%、85%、90%、95%酒精及无水乙醇脱水后,再进行透明、浸蜡、包埋、切片、烤片、脱蜡后染色,将切片入Mayer氏苏木素染液染色5 min,自来水洗浸洗返蓝。1%的盐酸酒精染色2~5 s,入1%水溶性伊红染液染色5 min,自来水洗浸洗30 s。风干后中性树胶封片,最后镜检。(2)免疫组化检测:将标本经75%、85%、90%、95%酒精及无水乙醇脱水,再进行透明、浸蜡、包埋、切片、烤片、脱蜡后,进行抗原修复、阻断内源性过氧化物酶、血清封闭、加一抗、加酶标二抗、加显色剂、复染、脱水、封片等步骤后,将封好的切片平放于通风橱中晾干后进行镜检。
1.4 实时荧光定量聚合酶链式反应(realtimequantitative polymerase chain reaction,RT-qPCR)检测巨噬细胞不同极化类型标记物 RT-qPCR分别检测M1型巨噬细胞标记物肿瘤坏死因子(tumor necrosis factor,TNF)-a、白细胞介素(interleukin,IL)-1β和M2型巨噬细胞标记物Arginase-1、IL-10的表达量。Trizol试剂提取总RNA(美国赛默飞公司),使用PrimeScriptTM逆转录试剂盒逆转录合成cDNA。RT-qPCR检测指标包括内参(β-actin)、巨噬细胞表型标志物(M1型标记物IL-1β、TNF-α和M2型标记物IL-10、Arginase-1的表达水平),使用UltraSYBRRT-qPCR预混体系,反应体系10 μL。反应程序:95℃预变性10 min,95℃变性15 s加60℃退火/延伸1 min。共35个循环。溶解曲线分析为95℃ 15 s、60℃ 1 min、95℃ 15 s、60℃ 15 s。从ViiA7RT-qPCR系统自带软件中调取每个反应管的荧光信号到达设定阈值的循环数(CT值),在Excel软件上进行计算。根据相应内参(β-actin)的CT值求出各自△CT值,再根据对照组中假手术对照小鼠△CT值的均数求得各自△△CT值,最后求出2-△△CT数值用于被检测基因相对表达量的比较。
1.5 ELISA检测巨噬细胞不同极化类型标记物 ELISA分别检测M1型巨噬细胞标记物TNF-a、IL-1β和M2型巨噬细胞标记物Arginase-1、IL-10的表达量。(1)将待测标本按说明书制备好以后,用封板膜封板后置37℃温育30 min;(2)小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次,拍干;(3)每孔加入酶标试剂50 μL,空白孔除外;(4)置37℃温育30 min;(5)按上述步骤(2)重复一次;(6)每孔先加入显色剂A50 μL,再加入显色剂B50 μL,轻轻震荡混匀,37℃避光显色15 min;(7)每孔加终止液50 μL,终止反应;(8)于450 nm波长依序测量各孔的OD值。

2 结 果
2.1 实验动物数量分析 实验组造模过程中死亡小鼠1只,术后观察阶段死亡2只,死亡小鼠及时予以补充。对照组无死亡小鼠,补充小鼠重新计算实验时间。两组小鼠术后均未出现感染。最终共有40只小鼠进入结果分析。
2.2 胶质瘢痕的观察结果 (1)HE染色显示实验组脊髓损伤1 d后出血均非常明显,前角运动神经元肿胀,炎症细胞聚集;损伤7~14 d时神经元死亡较多,星形胶质细胞活化增生,对照组未观察到上述现象(见图1)。(2)免疫组化染色后经Image-proplus软件分析,实验组中棕褐色细胞(炎症细胞)数量占总细胞数的95.0%,对照组棕褐色细胞(炎症细胞)数量占总细胞数少于10%(见图2)。
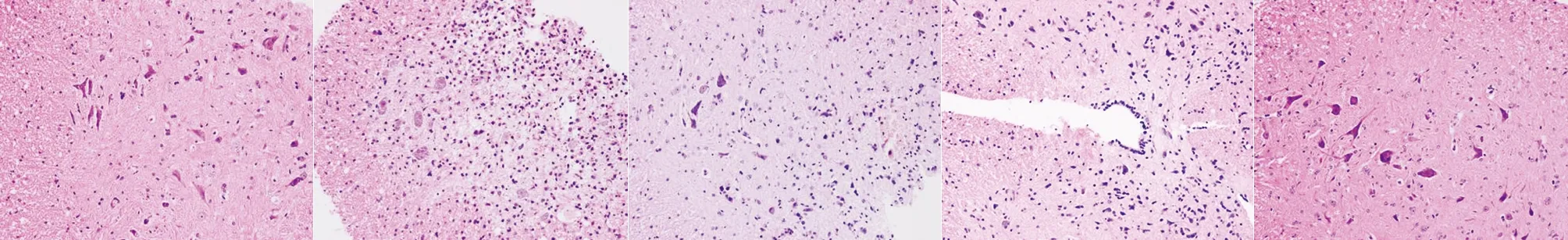
a 实验组1 d b 实验组7 d c 实验组14d e 实验组28 d f 对照组
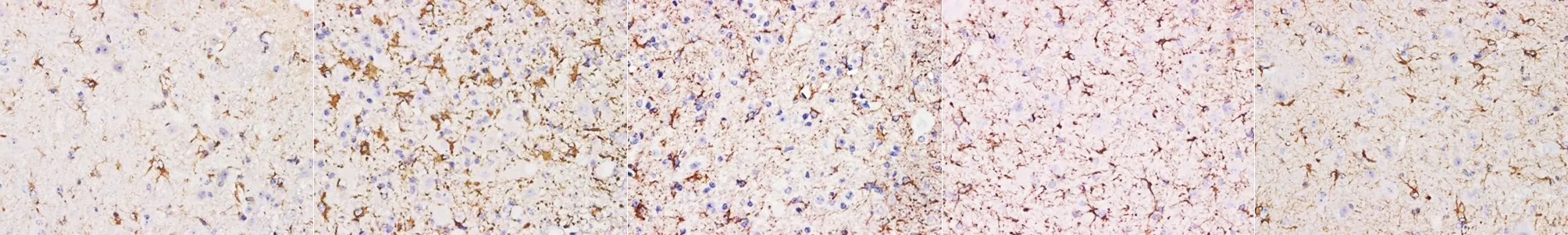
a 实验组1 d b 实验组7 d c 实验组14 d e 实验组28 d f 对照组
2.3 RT-qPCR检测巨噬细胞标记物结果 经IPP6.0软件对免疫荧光照片进行光密度分析,实验组M1型巨噬细胞的标记物IL-1β、TNF-α在脊髓损伤后各时间点较对照组高,差异有统计学意义(P<0.01);脊髓损伤后第7天表达最高,随后逐渐下降,至28 d趋于稳定。对照组各时间点的IL-1β、TNF-a表达无明显变化,差异无统计学意义(P>0.05)。实验组M2型巨噬细胞的标记物IL-10、Arginase-1在脊髓损伤后各时间点较对照组高,差异有统计学意义(P<0.01);脊髓损伤后第14天表达最高,随后逐渐下降,至28d趋于稳定;对照组各时间点的IL-10、Arginase-1表达无明显变化(P>0.05,见表1)。
表1 RT-qPCR检测巨噬细胞标记物结果
2.4 ELISA检测巨噬细胞标记物结果 ELISA检测提示M1型巨噬细胞的标记物IL-1β、TNF-α在实验组的各时间点表达较对照组明显增高,差异有统计学意义(P<0.01);实验组IL-1β、TNF-α表达在脊髓损伤后第7天表达最高,随后逐渐下降,至28 d趋于稳定。对照组各时间点的IL-1β、TNF-α表达差异无统计学意义(P>0.05)。M2型巨噬细胞的标记物IL-10、Arginase-1在实验组的表达较对照组明显增高,实验组各时间点均高于对照组,差异有统计学意义(P<0.01)。实验组IL-10、Arginase-1表达在脊髓损伤后第14天表达最高,随后逐渐下降,至28 d趋于稳定;对照组各时间点的IL-10、Arginase-1表达差异无统计学意义(P>0.05,见图3)。

图3 ELISA检测巨噬细胞标记物结果
2.5 巨噬细胞极化与胶质瘢痕形成的一般规律 通过HE染色、免疫组化、免疫荧光等检测发现小鼠脊髓损伤后胶质瘢痕于损伤后28 d趋于稳定,在这个过程中IL-1β、TNF-α的表达随胶质瘢痕形成而增加,于脊髓损伤后第7天达到峰值,而Arginase-1、IL-10在脊髓损伤后第14天达到峰值,损伤后28 d趋于稳定。这说明脊髓损伤后胶质瘢痕形成的前7天巨噬细胞主要极化为M1型巨噬细胞,7d后巨噬细胞逐渐极化为M2型巨噬细胞,均于28d达到稳定状态。
3 讨 论
脊髓损伤的治疗是临床医生面临的一个难题。尽管近年来采用移植替代法治疗脊髓损伤取得了很大的进步[2-3],但仍未根本解决脊髓功能的恢复问题。其主要原因在胶质瘢痕形成的原因未完全阐明,因此探讨胶质瘢痕形成的原因是治疗脊髓损伤不可逾越的步骤。随着基础研究的深入,发现胶质瘢痕的形成与炎症反应存在关联,其中炎症反应是胶质瘢痕形成过程中最重要的病理过程[10]。既往研究发现鼠类脊髓损伤后,胶质瘢痕形成一般在28 d左右即达到稳定状态[12],因此本次研究将观察时间点终止为脊髓损伤后28 d。
胶质瘢痕形成的病理过程主要是神经修复与抑制的过程。基础医学研究发现,脊髓损伤的病理过程可以分为原发性损伤和继发性损伤病理过程[13-14],继发性损伤的损伤范围及严重程度远大于原发性损伤[15],胶质瘢痕形成主要在继发性损伤病理过程中出现。继发性损伤的主要原因有:损伤区域受损细胞的兴奋性毒性、自由基、血管的破坏及炎症反应等[16-18],其中炎症反应是胶质瘢痕形成的主要原因,对脊髓损伤的预后至关重要[19]。
炎症反应主要影响脊髓损伤后轴突的再生及脊髓功能的恢复。脊髓损伤后局部微环境迅速发生改变,首先是嗜中性粒细胞浸润和小胶质细胞活化,随后出现单核细胞来源的巨噬细胞累积[12-13],巨噬细胞识别并清除受损部位不利于神经修复的物质,并促进组织再生[14],为胶质瘢痕形成创造条件,减轻或防止继发性损伤进行扩大。本次研究中我们发现M1型巨噬细胞标记物IL-1β、TNF-α在脊髓损伤前7天表达量逐渐上升,并于第7天达到峰值,这与脊髓胶质瘢痕形成前7天炎症反应逐渐增加具有一致性;而M2型巨噬细胞标记物IL-10、Arginase-1从脊髓损伤后7~14 d表达量逐渐增加,且14 d达到峰值,这与胶质瘢痕形成于第7天炎症反应逐渐减轻具有一致性。有学者[19]通过构建小鼠创伤性脑损伤模型,发现7 d后同侧大脑皮质分离的巨噬细胞由于还原型辅酶Ⅱ的表达被激活,可明显抑制神经元生长并增强炎症反应发生。说明中枢神经损伤后,巨噬细胞介导的炎症反应在损伤后也有阻碍神经修复的作用。因此,巨噬细胞在脊髓损伤后的修复扮演了双重角色,无论是本次我们的研究还是上述其他研究,均提示其机制可能与脊髓损伤后局部微环境的改变导致巨噬细胞呈不同极化类型有关。
巨噬细胞的极化受不同的刺激因素和损伤区域的微环境差异而表现出不同的极化类型,分泌不同的细胞因子和趋化因子,产生不同的作用[20]。根据巨噬细胞极化的类型一般分为经典活化M1型巨噬细胞和替代活化M2型巨噬细胞[21]。研究[16]发现脊髓损伤后,损伤部位存在M1和M2型巨噬细胞混杂并存的现象,通过对M1型和M2型巨噬细胞与脊髓组织共同培养,发现Ml型巨噬细胞可促进星形胶质细胞增殖和硫酸软骨素蛋白聚糖的分泌,有利于胶质瘢痕的形成;M2型巨噬细胞无增殖星形胶质细胞的作用,因而无促进胶质瘢痕形成的作用。本次研究中,我们发现脊髓损伤后7 d,M1型巨噬细胞的标记物IL-1β、TNF-α呈最高表达,而M2型巨噬细胞的标记物IL-10、Arginase-1在脊髓损伤后14 d才呈最高表达,这提示脊髓损伤后胶质瘢痕形成过程中M1型和M2型巨噬细胞发挥了不同的作用。Fan等[22]认为,脊髓损伤后M1型巨噬细胞通过Toll样受体(Toll-like receptors,TLR)/MyD88信号途径诱导反应性星形胶质细胞凋亡,促进胶质瘢痕形成。M2型巨噬细胞在脊髓损伤后较M1型巨噬细胞滞后,通过在脊髓损伤处移植M2型巨噬细胞,发现明显有促进神经轴突生长的作用[23]。其机制可能为极化后M2型巨噬细胞分泌大量纤维蛋白和基质相关蛋白,抑制脊髓损伤后巨噬细胞浸润和炎症因子表达及其受体的活化,减轻氧化应激反应和继发的脊髓损伤,促进脊髓损伤后内皮细胞增生、血管形成和神经功能恢复[24]。
胶质瘢痕的形成和巨噬细胞的极化相辅相成,共同作用于脊髓损伤后的修复。脊髓损伤后形成的胶质瘢痕主要由活化、增殖的星形胶质细胞及其分泌的硫酸软骨素蛋白聚糖组成[25]。在脊髓损伤早期胶质瘢痕形成可以阻碍兴奋性氨基酸、活性氧和自由基等有害分子对神经元的进一步破坏,抑制继发性损伤扩大[26],这与巨噬细胞在脊髓损伤早期主要表现为促炎作用,清除局部坏死组织作用一样。脊髓损伤后期,M2巨噬细胞通过一系列信号通路的调控,使促炎因子分泌减少,神经营养因子分泌增加,促进残存神经再生和功能恢复[27-28],但是随着胶质瘢痕形成区域稳定,残存的轴突很难穿越瘢痕区域促进脊髓功能的恢复。因此,如何通过调控巨噬细胞的极化,减轻胶质瘢痕的形成是促进脊髓功能恢复的一个研究方向。
综上所述,本次研究阐明了脊髓损伤后胶质瘢痕形成与巨噬细胞极化的关系,即在胶质瘢痕形成早期主要为M1型巨噬细胞,胶质瘢痕形成后期主要为M2型巨噬细胞,这将为通过调控巨噬细胞极化类型促进脊髓功能恢复提供一定的理论参考。但是,本研究也存在不足之处,胶质瘢痕形成的过程是多个因素参与的生物化学过程,本次仅探索了巨噬细胞这一个因素,因而存在一定的不足;通过实验我们可以发现整个胶质瘢痕形成过程中M1型和M2型巨噬细胞标记物均有表达,这说明M1型和M2型巨噬细胞或者更多的细胞参与了胶质瘢痕的形成,如只对某一因素进行干预,其效果可能有限。因此,后续实验将进一步研究巨噬细胞不同极化类型是如何影响胶质瘢痕形成的。
