隔山消提取物对功能性消化不良模型大鼠脑肠肽及胃肠道功能的作用机制研究*
2021-07-15游景瑞刘春花林昌虎
秦 兰 ,游景瑞 ,潘 洁 ,孙 佳 ,刘春花 ,彭 梅 ,林昌虎 △
(1. 贵州医科大学民族药与中药开发应用教育部工程研究中心·省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550004; 2. 贵州医科大学药学院,贵州 贵阳 550004; 3. 贵州医科大学贵州省药物制剂重点实验室,贵州 贵阳 550004)
1 材料与方法
1.1 仪器、试药与动物
仪器:Allegra X30 型离心机(美国贝克曼库尔特有限公司);Model 680 型酶标仪(美国 Bio -Rad 公司);IMS-20 型全自动雪花制冰机(常熟市雪科电器有限公司);UV-2401PC 型紫外可见分光光度计(日本岛津仪器公司);AE240 型电子天平(梅特勒-托利多仪器<上海>有限公司,精度为十万分之一);Nikon Eclipse Cl 型正置光学显微镜,Nikon DS-U3 型成像系统,均购自日本尼康公司。
试药:隔山消药材产地为贵州凯里,经贵州医科大学药学院生药学教研室刘春花副教授鉴定为萝科植物耳叶牛皮消 Cynanchum auriculatum Royle ex Wight 的干燥块根;盐酸(国药集团化学试剂有限公司,批号为20180628);多潘立酮(西安杨森制药有限公司,批号为90301693);苏木精-伊红染液(HE,武汉市皮诺飞生物科技有限公司,批号为 P10011);血浆 MTL 试剂盒,GAS 试剂盒,VIP 试剂盒,肿瘤坏死因子 -α(TNF -α)试剂盒,批号均为20191220,均购于上海酶联生物科技有限公司。
动物:健康SPF级雄性SD大鼠48只,体质量220~240g,由长沙市天勤生物技术有限公司提供,生产许可证号为SCXK (湘)2014 -0011。均适应性饲养 1 周,饲养于温度为(22±2)℃、相对湿度为45% ~60%的动物房内。试验方案均通过贵州医科大学动物伦理委员会批准。
1.2 实验方法
药物制备:取干燥隔山消块根,粉碎成粗粉,用70% 乙醇回流提取 3 次,第 1 次 8 倍量(m / V)70% 乙醇回流提取 1.5 h,第 2 次、第 3 次 6 倍量(m / V)70%乙醇回流提取1.0 h,过滤,合并滤液,减压,浓缩得稠膏,将稠膏加水溶解成每1 mL 含1 g 生药的溶液,加热溶解,静置过夜,取上清液浓缩,过D-101 大孔吸附树脂柱,依次用3 倍柱体积水、60%乙醇洗脱,收集60%乙醇洗脱液,减压,浓缩得稠膏[9]。
分组、建模及给药:将48 只SPF 级雄性SD 大鼠随机分为正常组(A 组),模型组(B 组,0.5 mol/L 冰盐酸),多潘立酮组(C 组),隔山消提取物低、中、高剂量组(D1组、D2组、D3组),各 8 只。除 A 组外,其余大鼠均不规则喂养(隔1 d 不定时提供食物),同时按8 mL/kg 的容量灌胃 0.5 mol/L 冰盐酸 21 d,1 d 1 次,以诱发脾胃虚寒型FD 大鼠模型,A 组大鼠仅灌胃等量生理盐水。造模第 11 天后,D1组、D2组、D3组大鼠分别灌胃 0.5,1.0,2.0 g/kg 隔山消提取物,C 组大鼠灌胃 31.5 mg/kg多潘立酮,A 组和B 组大鼠均灌胃10 mL/kg 生理盐水,所有大鼠均给药10 d,1 d 1 次;造模第21 天后,禁食不禁饮24 h,口服灌胃2 mL 10%阿拉伯树胶+5%活性炭,30 min 后股动脉取血,解剖,取出胃及小肠。
小肠推进率测定:将小肠置含有少量生理盐水的培养皿上,用镊子分离肠系膜,铺展于少量生理盐水润湿的玻璃板上,用直尺测量小肠总长度( L,幽门前端至回盲部)及从幽门前端到碳墨最前端的距离( S,即碳墨推进距离),按公式计算小肠推进率。
小肠推进率(%)= L / S × 100%[10]
大鼠胃窦部组织病理变化观察:采用HE 染色法,取大鼠胃窦部(距幽门上端0.5 cm)组织,用4%多聚甲醛固定,逐级脱水,包埋,切片,染色,封片,在200 倍显微镜下观察胃窦组织的病理变化。
血浆 MTL,GAS,VIP,TNF -α 水平测定:造模成功后,股动脉取血,置肝素化的离心管中,离心(3 000 r/min)30 min,取上层澄清液体,储存于-20 ℃ 冰箱中待用,临用前取出,采用酶联免疫吸附法,按试剂盒说明书操作,用酶标仪于450 nm 波长处检测,读取各样品的吸光度值(A),测定血浆中 MTL,GAS,VIP,TNF - α 水平。
1.3 统计学处理
2 结果
2.1 小肠推进率
与A 组比较,B 组大鼠的小肠推进率显著降低(P < 0.05);与 B 组比较,C 组、D1组、D2组、D3组大鼠的小肠推进率均显著升高(P <0.05)。结果见表 1。
表1 隔山消提取物对各组大鼠小肠推进率的影响(,%,n =8)Tab.1 Effect of the extract of Cynanchum auriculatum Radix on the small intestine propulsion rate of rats in each group(,%,n =8)
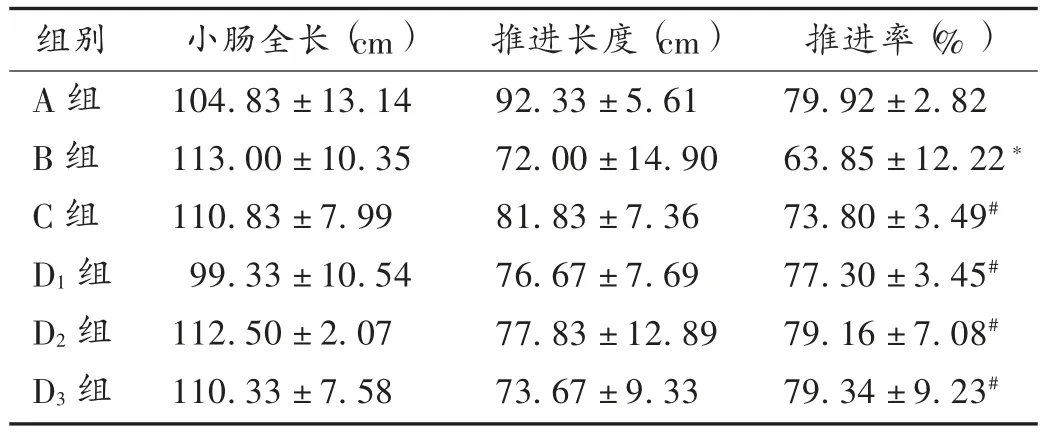
表1 隔山消提取物对各组大鼠小肠推进率的影响(,%,n =8)Tab.1 Effect of the extract of Cynanchum auriculatum Radix on the small intestine propulsion rate of rats in each group(,%,n =8)
注:与 A 组比较,*P < 0.05;与 B 组比较,#P < 0.05。Note:Compared with those in group A,*P < 0.05;compared with those in group B,#P < 0.05.
组别A 组B 组C 组D1 组D2 组D3 组小肠全长(cm)104.83 ± 13.14 113.00 ± 10.35 110.83 ± 7.99 99.33 ± 10.54 112.50 ± 2.07 110.33 ± 7.58推进长度(cm)92.33 ± 5.61 72.00 ± 14.90 81.83 ± 7.36 76.67 ± 7.69 77.83 ± 12.89 73.67 ± 9.33推进率(%)79.92 ± 2.82 63.85 ± 12.22*73.80 ± 3.49#77.30 ± 3.45#79.16 ± 7.08#79.34 ± 9.23#
2.2 血浆中 MTL,GAS,VIP,TNF -α 水平
与A 组比较,B 组大鼠血浆MTL 和GAS 水平均显著降低,VIP 和 TNF -α 水平均显著升高(P <0.001);与B 组比较,C 组、D3组大鼠血浆 MTL 水平均显著升高(P < 0.01),C 组、D1组、D2组、D3组大鼠 GAS 水平均显著升高,TNF - α 水平均显著降低(P < 0.05 或P < 0.01),C 组、D2组、D3组大鼠 VIP 水平均显著降低(P < 0.01);且 D3组与 C 组药效相当。结果见表 2。
表2 隔山消提取物对各组大鼠胃肠激素及炎性因子的影响(,pg /mL,n =8)Tab.2 Effect of the extract of Cynanchum auriculatum Radix on gastrointestinal hormones and inflammatory factors of rats in each group(,pg /mL,n = 8)
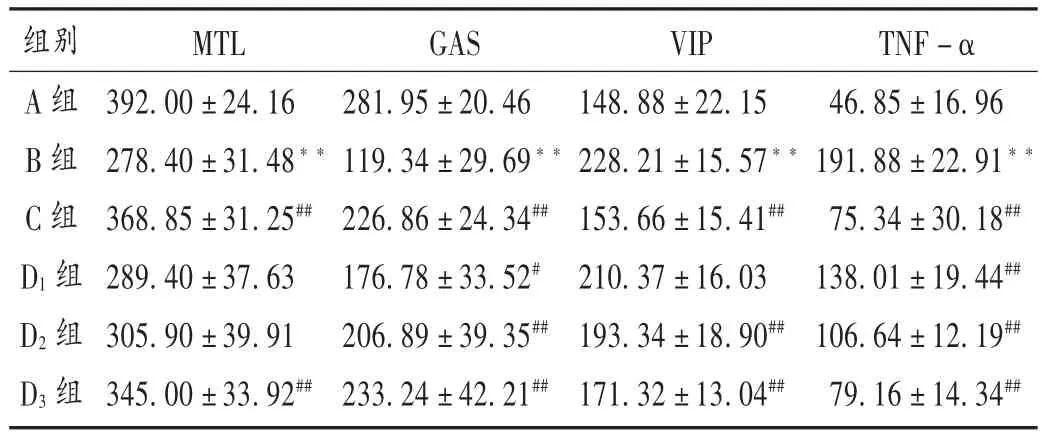
表2 隔山消提取物对各组大鼠胃肠激素及炎性因子的影响(,pg /mL,n =8)Tab.2 Effect of the extract of Cynanchum auriculatum Radix on gastrointestinal hormones and inflammatory factors of rats in each group(,pg /mL,n = 8)
注:与 A 组比较,**P <0.01;与 B 组比较,#P <0.05, ##P <0.01。Note: Compared with those in group A, ** P < 0.01;compared with those in group B,#P < 0.05, ##P < 0.01.
组别A 组B 组C 组D1 组D2 组D3 组MTL 392.00 ± 24.16 278.40 ± 31.48**368.85 ± 31.25##289.40 ± 37.63 305.90 ± 39.91 345.00 ± 33.92##GAS 281.95 ±20.46 119.34 ±29.69**226.86 ± 24.34##176.78 ±33.52#206.89 ±39.35##233.24 ±42.21##VIP 148.88 ±22.15 228.21 ±15.57**153.66 ± 15.41##210.37 ±16.03 193.34 ±18.90##171.32 ±13.04##TNF-α 46.85 ±16.96 191.88 ±22.91**75.34 ± 30.18##138.01 ±19.44##106.64 ±12.19##79.16 ±14.34##
2.3 大鼠胃窦部组织病理变化
A 组大鼠胃窦部组织未见明显变化;B 组大鼠整体轻度异常,部分黏膜层细胞空泡变性,黏膜上皮细胞无明显脱落,黏膜层未见明显炎性细胞浸润及坏死,基本排除器质性损伤,符合FD 病变特征,说明建模成功。其余各组大鼠胃组织结构整体正常,黏膜上皮细胞无明显脱落,黏膜层未见明显炎性细胞浸润及坏死。详见图1。
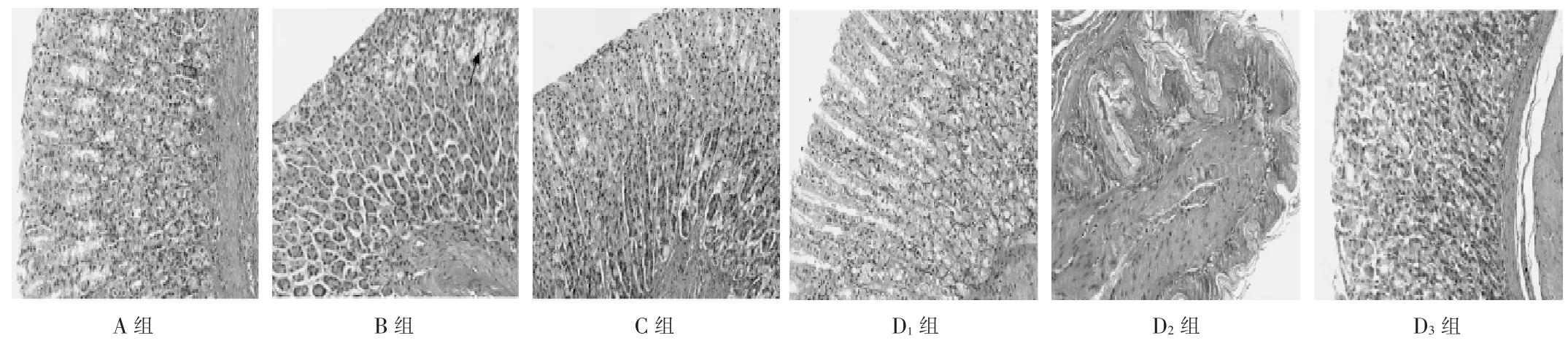
图1 大鼠胃窦部组织病理切片图(HE 染色,×200)Fig.1 The pathological section of the tissue of gastric antrum of the rats(HE staining,× 200)
3 讨论
FD 模型有动力障碍型,如吗啡、抗肿瘤药物抑制胃肠蠕动;另一种常见模型为内脏高敏型,常采用碘乙酰胺造模法、胃酸刺激法、夹鼠尾法及复合因素造模法(不规则喂养、夹尾刺激、光刺激等)[11]。研究表明,FD 的发病与内脏敏感性增高有关[12]。本研究中前期试验时,采用了致内脏高敏的造模方式,如夹鼠尾刺激法和复合因素造模法,结果在单纯采用外部刺激的方式下,大鼠个体差异及对环境刺激改变的耐受性差异较大,导致结果重复性差。故本研究中采用口服灌胃冰稀盐酸加不规律喂养法造模,盐酸可以进入胃黏膜下层,刺激胃肠平滑肌收缩,延缓胃内压恢复,减慢胃排空,刺激胃液分泌,致胃寒胀满[13]。李杲《兰室秘藏·中满腹胀门》提出:“多食寒凉之人,胃中寒则胀满,或脏寒生满病。”不规则喂养可致饮食失律,日久则脾胃虚弱,气机不畅,符合中医学中脾胃虚弱证型。通过观察大鼠造模成功后的状态,模型大鼠出现倦卧少动、扎堆、拱背、反应迟钝,捉拿时反抗无力,饮水、饮食量逐渐减少,体质量呈下降趋势,皮毛粗糙、稀疏,便溏等现象。有研究表明,该方法导致的内脏敏感性增加受神经及脑肠肽共同调控,一方面通过酸刺激迷走神经通路,产生抑制性胃肠反射;另一方面氢离子可激活十二指肠传入通道的酸感受器受体释放一氧化氮[14]。一氧化氮是非肾上腺能神经和非胆碱能神经递质,介导胃容受性舒张的反射活动,并具有抗乙酰胆碱对胃的收缩作用,影响胃的舒张、蠕动和排空。可见,该造模方法更贴合现代人群FD 的发病机制,且操作简单,造模重复性好,存活率较高。
研究发现,FD 患者普遍存在脑肠肽分泌异常和胃肠道黏膜炎症,胃肠动力障碍疾病与胃肠道的免疫细胞浸润有关,免疫细胞释放炎性介质可能介导了胃肠动力的改变[15]。TNF-α 是一种诱导细胞化学趋势表达的机体炎性因子,主要与肿瘤相关的巨噬细胞分泌,在肿瘤炎性微环境中发挥启动慢性炎症的作用,对于促进炎性细胞在病变部位聚集和释放中起重要作用,而FD 患者血清中炎性因子水平显著高于正常人群[16]。MTL 是一个由22 个氨基酸所组成的多肽,可使胃体、胃窦收缩,幽门松弛,在消化间期对胃排空起促进作用。GAS 属胃分泌的一种胃肠激素,有刺激胃壁细胞分泌胃蛋白酶原、促进胰液和胆汁分泌的作用。如果GAS 分泌不足,会引起消化功能方面的问题,导致胃肠道功能紊乱,引起慢性胃炎、消化不良。VIP 是一种神经肽,主要来自肠道神经元,可抑制下食管括约肌、胃、胆囊、小肠环形肌和血管平滑肌收缩,其分泌增加会抑制胃肠道运动。研究表明,胃肠道功能障碍小鼠体内胃肠激素MTL 和GAS 的水平会降低,而 VIP 水平会升高[9]。
综上所述,隔山消提取物改善FD 的作用机制除可能与升高 MTL 和 GAS 水平,降低 VIP 和 TNF - α 水平有关外,还可能影响了十二指肠的化学敏感性传入通路,减弱了因酸刺激对周围或脊髓水平的致敏而引起胃的牵张敏感性增强。
