鲜切西瓜水渍化损伤转录组测序分析
2021-07-15郑雪梦王雪敏
郑雪梦,时 月,张 超,王雪敏
(1.河北工程大学,河北 邯郸056006;2.北京市农林科学院 蔬菜研究中心,北京100097;3.果蔬农产品保鲜与加工北京市重点实验室,北京100097;4.农业农村部蔬菜产后处理重点实验室,北京100097)
0 引言
鲜切西瓜是以新鲜西瓜为原料,经清洗、去皮、切块和包装等工序生产的即食果蔬制品,具有新鲜、营养、方便、无废弃物等优点[1-3]。在欧美发达国家,鲜切西瓜是主要的消费形式,消费量占西瓜消费量的60%以上;在我国鲜切西瓜仅占西瓜总消费量的1%以下,主要供应于商超。目前,我国的鲜切西瓜产业正处于快速发展阶段,有望在未来5年成为西瓜主要消费形式,但水渍化损伤阻碍鲜切西瓜产业的发展。
水渍化损伤的特征是果肉溶质泄漏增加,果肉颜色变深变软[4],常见于葫芦科植物的果实。果实经鲜切处理后,组织发生应激反应,从而引起一系列的生理紊乱现象。研究表明,鲜切甜瓜呼吸速率增加,伴随活性氧的积累,其能量水平提高,在贮藏过程中伴随产生了较高的氧化应激和膜损伤[5]。鲜切西瓜水渍化损伤表现为果实颜色显著增加,硬度显著降低,口感和气味均发生劣变,严重影响其商品性[2,6-7]。目前,关于西瓜水渍化损伤的研究都集中在外源乙烯诱导和1-MCP预防[8-11],对果实硬度、相对电导率、磷脂酶、脂氧合酶活性进行测定,缺乏对果实分子代谢方面的研究。
随着高通量测序平台发展和西瓜全基因组测序完成,RNA-Seq已经成为了监测研究对象在各种环境条件下转录组水平的工具[12]。该技术通过对不同成熟期黄皮和绿皮西瓜样品分析,明确了与西瓜果皮色泽相关差异基因[13]。通过对西瓜果实含糖量性状QTL精细定位,明确西瓜果实糖分积累的相关机制[14]。该技术结合权重共表达网络分析筛选出与乙烯信号通路及上游调控的关键基因,阐明西瓜成熟与乙烯调控的关系[15]。该技术通过对西瓜果实发育期的RNA样品分析,明确了西瓜果肉硬度和果实有机酸积累的关键调控因子[16],分析了西瓜抗裂果和感裂果的差异表达基因,为西瓜裂果的分子机理提供基因信息[17]。但是,关于鲜切西瓜货架期内水渍化损伤的分子机制方面的还鲜有报道。
以京欣3号西瓜为材料,以未水渍化西瓜作为对照组,通过转录组测序分析水渍化果肉和未水渍化果肉的差异基因,探讨鲜切西瓜水渍化损伤机制,挖掘出与水渍化相关的关键基因,为保持鲜切西瓜品质提供理论基础。
1 材料与方法
1.1 材料
京欣3号西瓜,京研益农(北京)种业科技有限公司提供;选择新鲜、果实大小适中、成熟度一致、无生理病害、无机械损伤的西瓜作为试验材料。
1.2 鲜切西瓜处理方法
使用蒸馏水清洗西瓜表面灰尘,再使用150 μL/L次氯酸钠溶液清洗2 min,蒸馏水漂洗2次,静置沥水。在超净工作台下,将西瓜纵向切开,去除果皮等不可食用部位,将果肉切割成边长约3 cm的小果块,混合均匀,装入聚乙烯保鲜盒内,每盒约300 g,放置于4℃的冷藏柜中贮藏,观察水渍化损伤情况。
京欣3号西瓜4℃贮藏表型鉴定见图1。
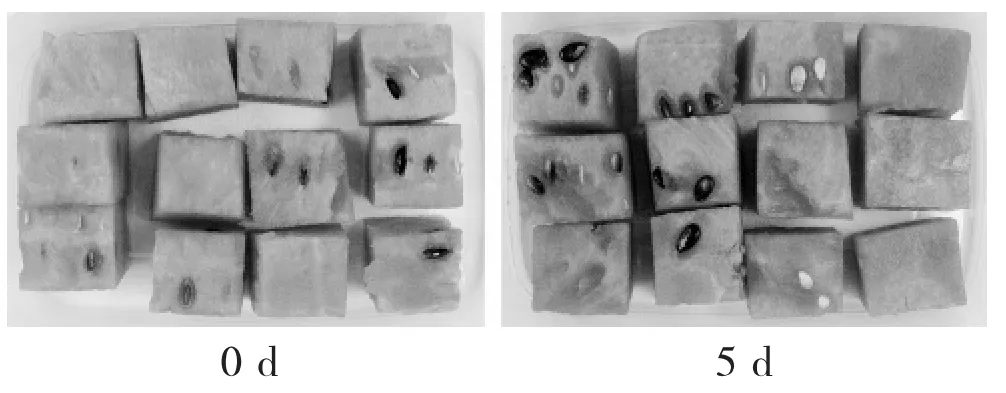
图1 京欣3号西瓜4℃贮藏表型鉴定
由图1可知,贮藏第5天的鲜切京欣西瓜果肉呈现出明显的水渍化现象,果肉颜色加深、果块边缘及瓜子周围呈现水渍状、果肉软化。取冷藏5 d的西瓜果块于无菌操作台内分别取样水渍化果肉和未水渍化果肉,液氮速冻,保存于-80℃冰箱,备用。以未水渍化果肉作为CK组,水渍化的果肉作为WS(water-soaking)组进行转录组测序,为确保转录组测序的准确性和可靠性,每个处理组作3次重复,分别标记为CK1,CK2,CK3,WS1,WS2和WS3。
1.2.1 总RNA提取、cDNA文库构建和测序
采用TRIzol法提取组织中的总RNA,利用Nanodrop2000对所提RNA的浓度和纯度进行检测,琼脂糖凝胶电泳检测RNA完整性,Agilent2100测定RIN值[18]。RNA检测合格后,由上海美吉生物医药科技有限公司完成转录组文库构建、高通量测序和序列组装工作。
1.2.2 测序数据
对各样本的原始测序数据进行过滤,得到高质量的测序数据(clean data),与西瓜97103基因组进行序列比对,获得用于后续转录本组装、表达量计算等的mapped reads,同时对转录组测序的比对结果进行质量评估。使用软件RSEM分别对基因和转录本的表达水平进行定量分析,定量指标为TPM(Transcripts Per Millionreads)。利用基于负二项分布模型的DESeq2软件,以p-adjust<0.05 &|log2FC|≥1为标准筛选差异表达基因(differentially expressed gene,DEG)。
1.2.3 差异表达基因的GO功能注释和KEGG富集分析
GO数据库(Gene Ontology,基因本体数据库)可将基因按照生物过程(Biological Process)、细胞组分(Cellular Componen)t和分子功能(Molecular Function)进行分类。
KEGG数据库(Kyoto Encyclopedia of Genes and Genomes,京都基因与基因组百科全书)可系统分析基因功能,将基因按照参与的pathway通路或行使的功能分类。
2 结果与分析
2.1 转录组数据质控分析
通过Illumina平台对果肉样本测序,使用SeqPrep和Sickle软件对原始测序数据进行质控,测序结果显示6个样品共获得48.53 Gb原始数据,通过过滤和质控后,共得到47.02 Gb Clean Data,各样品Clean Data均在7.16 Gb以上,测序碱基平均错误率均在0.025 3%以下,Q30碱基比例在93.89%以上,测序质量具有较高的可靠性,可用于下一步的分析。
西瓜果肉样本转录组测序数据统计见表1,转录组测序数据与参考基因组比对结果统计见表2。
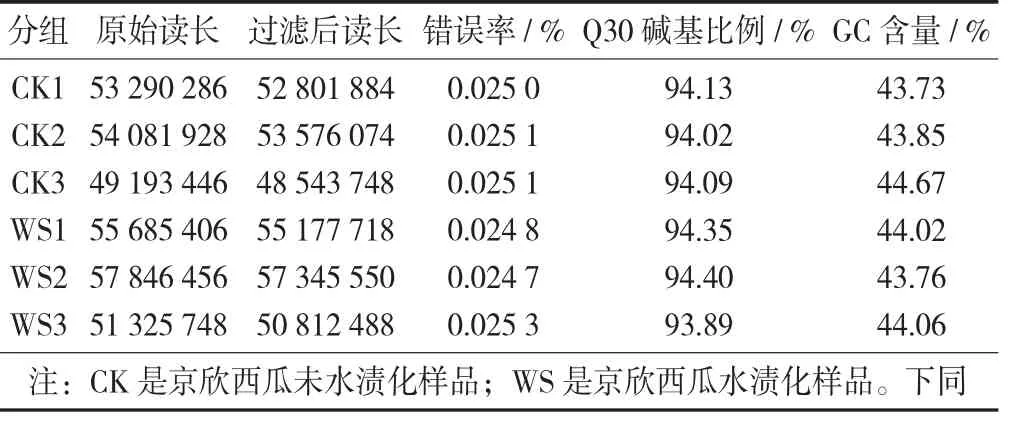
表1 西瓜果肉样本转录组测序数据统计
分别将各样品的过滤后读长与西瓜97103基因组(Watermelon_97103)进行序列比对,表2显示样品比对率均大于74.00%,比对效率较高。测序质控和序列比对数据说明,6个样本转录组测序数据质量较好,可以用于后续生物学分析。
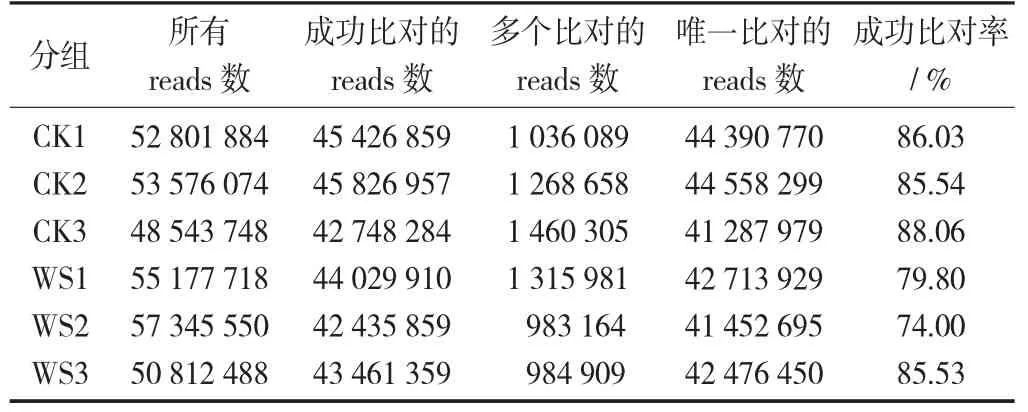
表2 转录组测序数据与参考基因组比对结果统计
2.2 基因表达量分析
西瓜样本关系分析见图2。
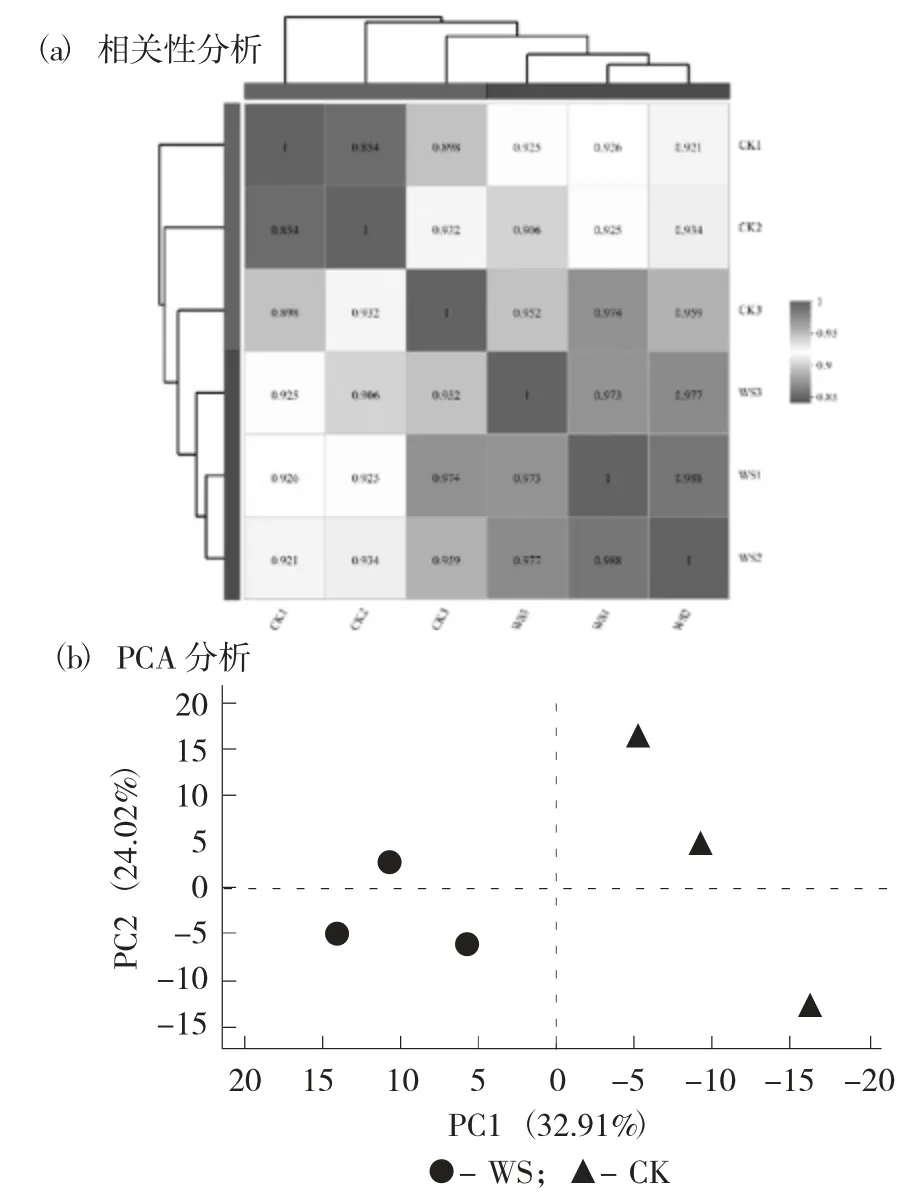
图2 西瓜样本关系分析
通过相关性热图,对样本间基因表达量的生物学重复相关性进行评估,将皮尔逊相关系数r作为评估指标,r2越接近1,说明2个重复样品相关性越强。图2(a)显示每个样本间的3次生物学重复的相关性较强,且对照组与水渍化组之间相关性较强,其中京欣西瓜水渍化样本的3个组间重复相关性最好。同时,对6个样本的基因表达量进行主成分分析,找出离群样本,判别相似性高的样品簇。如图2(b)所示,相同处理的样本之间聚集在一起,相似度较高,而不同处理之间基因表达差异显著,分别形成不同的集群,与图2(a)结果一致。
2.3 差异表达基因分析
利用基于负二项分布模型的DESeq2软件,以p-adjust<0.05 &|log2差异倍数|≥1为标准筛选差异表达基因。结果如表3所示,2组间共有491个基因差异表达,其中305个基因上调表达、186个基因下调表达。
差异基因表达量差异统计见表3。
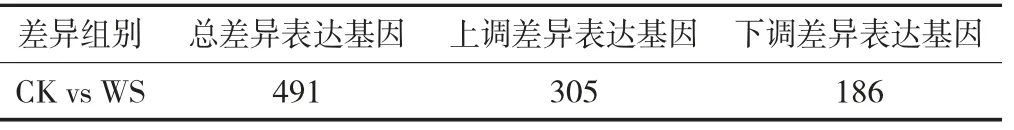
表3 差异基因表达量差异统计/个
2.4 差异表达基因的GO功能注释
差异表达基因的GO功能分类见图3。
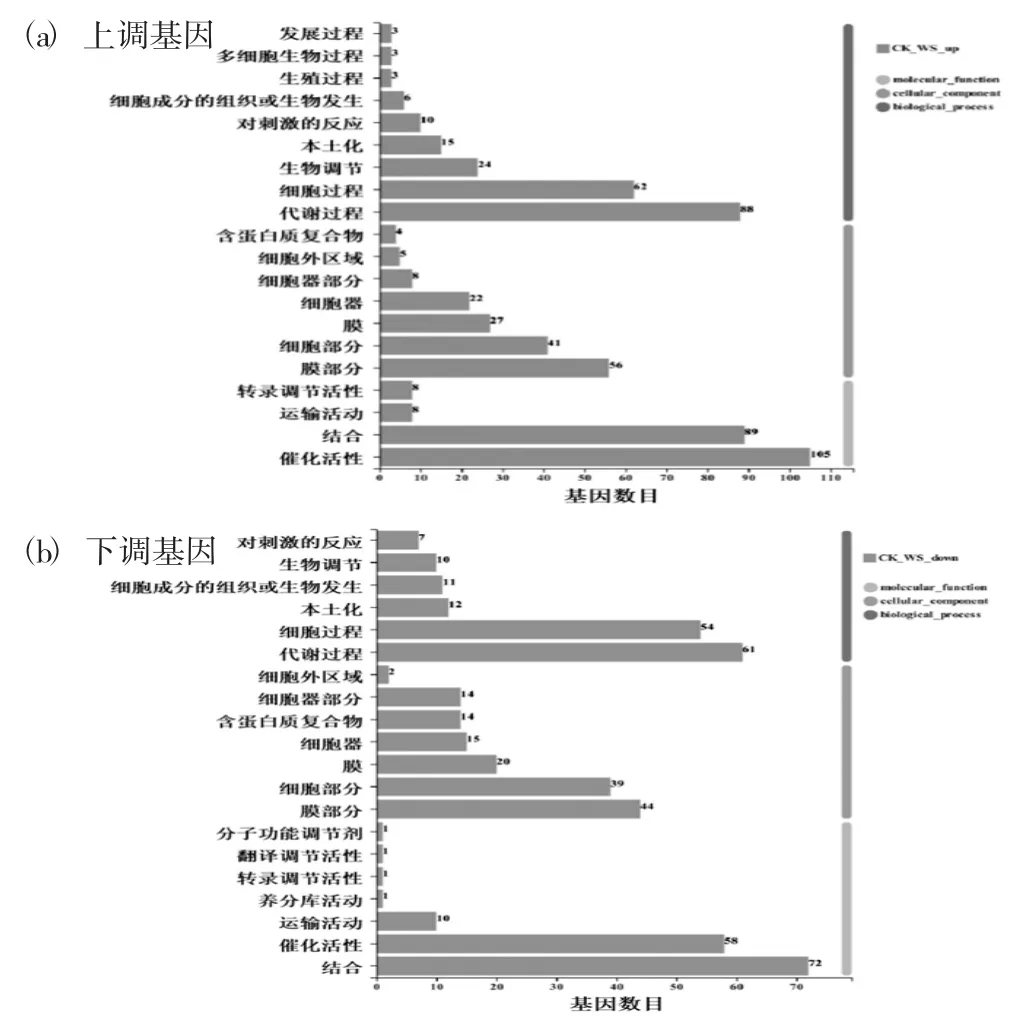
图3 差异表达基因的GO功能分类
利用GO数据库对差异表达的基因进行了GO功能注释分类。上调基因主要注释在催化活性、结合、代谢过程、细胞过程、膜部分、细胞部分、膜、生物调节条目。下调基因主要注释在结合、代谢过程、催化活性、细胞过程、膜部分、细胞部分、膜、细胞器条目。
2.5 差异表达基因的KEGG富集分析
生物个体在行使其生物学功能时,往往需要不同层面的基因共同协调完成,通过对代谢通路的分析,可以更好地揭示差异表达基因的生物学功能。对京欣水渍化与京欣未水渍化的差异表达基因进行KEGG功能注释,共注释在代谢(Metabolism)、遗传信息处理(Genetic Information Processing)、环境信息处理(Environmental Information Processing)、细胞过程(Cellular Processes)、生物体系统(Organismal Systems)五大类别。
差异表达基因的KEGG功能分类见图4。

图4 差异表达基因的KEGG功能分类
上调基因主要注释在碳水化合物代谢、脂质代谢、其他次生代谢产物的生物合成、信号转导、氨基酸代谢、能量代谢、细胞生长与死亡、环境适应等通路。下调基因主要注释在能量代谢、碳水化合物代谢、信号转导、复制和修复、氨基酸代谢、环境适应、脂质代谢、其他氨基酸的代谢、核苷酸代谢、其他次生代谢产物的生物合成、膜运输、细胞生长与死亡等通路。
差异表达基因的KEGG富集分析见图5。
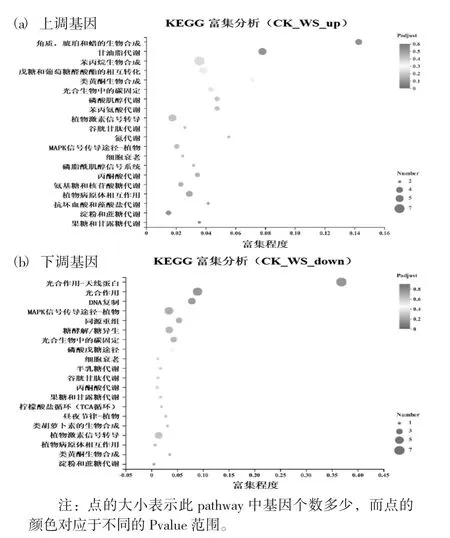
图5 差异表达基因的KEGG富集分析
进一步对差异基因代谢通路进行显著性富集分析。上调基因在角质、琥珀和蜡的生物合成、甘油脂代谢通路上显著富集,在苯丙烷生物合成、戊糖和葡萄糖醛酸酯的相互转化、类黄酮生物合成、光合生物中的碳固定、磷酸肌醇代谢、苯丙氨酸代谢、植物激素信号转导、MAPK信号传导途径-植物、细胞衰老等通路也有较高富集。下调基因显著富集在光合作用-天线蛋白、光合作用、DNA复制代谢通路上,在MAPK信号传导途径-植物、同源重组、糖酵解/糖异生、光合生物中的碳固定、磷酸戊糖途径、细胞衰老等通路也有较高富集。
2.6 与水渍化损伤相关的候选基因筛选
与水渍化损伤有关差异基因的表达分析见表4。
由表4可知,筛选了可能与水渍化损伤有关的差异基因。
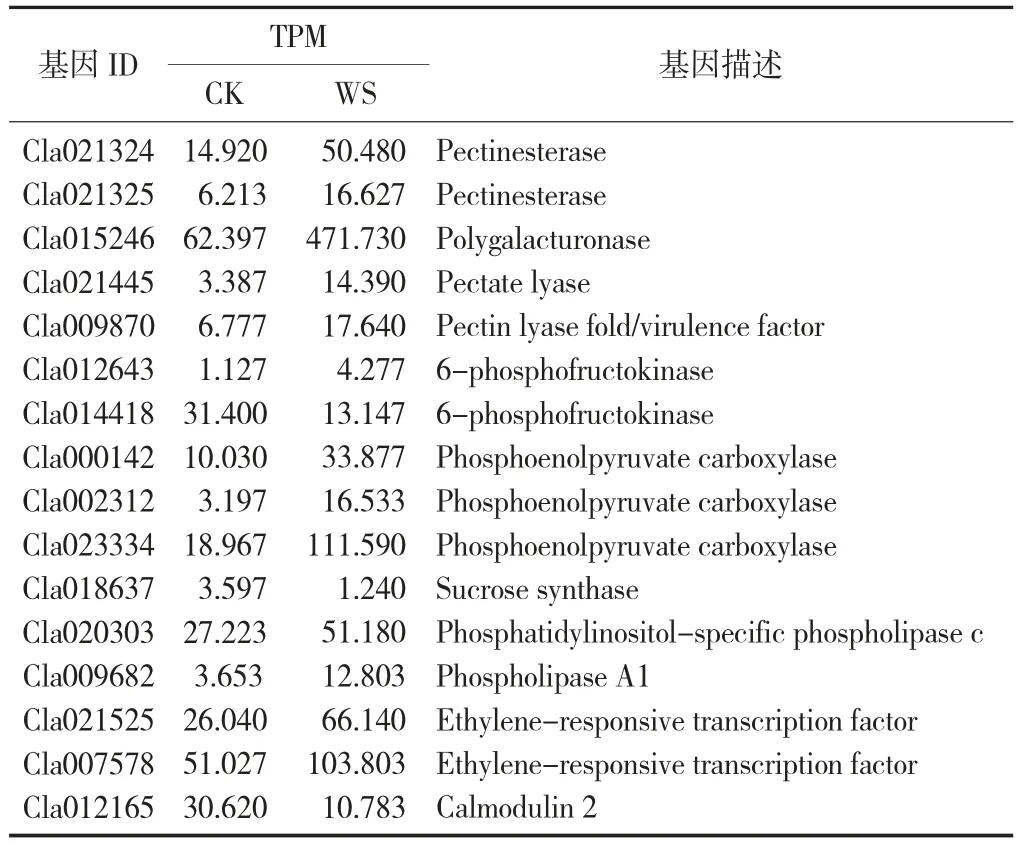
表4 与水渍化损伤有关差异基因的表达分析
果胶、半纤维素、纤维素是植物细胞壁的主要成分,决定了果实硬度。果胶酯酶、多聚半乳糖醛酸酶和果胶裂解酶是植物细胞壁降解的关键酶,参与蓝莓[19]、梨[20]、甜瓜[21]、樱桃[22]细胞壁降解,促进果实软化。在研究中发现在水渍化西瓜中上调了果胶酯酶(Cla021324,Cla021325)、果胶裂解酶(Cla021445,Cla009870)、多半乳糖醛酸酶(Cla015246)基因的表达,促进西瓜果肉细胞壁降解、果肉硬度下降。
乙烯有促进器官脱落和衰老的作用,钙参与维持细胞的动态形状和细胞膜的完整性,钙通过在果胶聚合物之间建立桥梁来稳定细胞壁。乙烯响应转录因子是植物中广泛存在的一类转录因子,对植物的生长发育、次生代谢过程和植物的抗胁迫能力具有重要的调控作用[23]。钙调蛋白可以调节细胞内钙离子的浓度,介导细胞活动。发现2个乙烯响应转录因子(Cla021525,Cla007578)基因表达上调,一个钙调蛋白(Cla012165)基因表达下调,参与信号转导通路。
碳水化合物是生命细胞结构的主要成分及主要供能物质,并且有调节细胞活动的重要功能。磷酸果糖激酶是糖酵解作用的限速酶,丙酮酸是糖酵解途径的最终产物,蔗糖合酶是植物糖代谢过程的关键酶,催化蔗糖的合成与分解。发现2个6-磷酸果糖激酶(Cla012643,Cla014418)、3个磷酸烯醇丙酮酸羧化酶(Cla000142,Cla002312,Cla023334)、1个蔗糖合酶基因(Cla018637)参与糖代谢过程。
磷脂双分子层是构成细胞膜的的基本支架,磷脂酶在磷脂分解代谢中起重要作用,参与细胞膜代谢[24]。发现有2个磷脂酶(Cla020303,Cla009682)基因上调表达,参与细胞衰老。
3 结论
鲜切西瓜水渍化损伤是一个多基因参与、多种代谢过程相互影响的复杂过程,Mao L等人[10]发现50 μL/L外源乙烯处理的20℃贮藏的西瓜果实呈现水渍化状,果实电导率、游离汁液增加、组织软化,且经乙烯处理的西瓜中ACC合成酶、ACC氧化酶、磷脂酶C、磷脂酶D和脂氧合酶的活性明显提高,推测西瓜果实的水渍化败坏是一种由乙烯诱导的衰老现象。利用RNA-seq分析了鲜切京欣3号西瓜4℃货架期贮藏5 d的水渍化果肉/未水渍化果肉的基因表达差异。与CK相比,水渍化样本有305个上调基因和186个下调基因。差异基因GO注释发现,差异表达基因主要注释在代谢过程、细胞过程、催化活性、结合这4个GO条目,上调基因数目大于下调基因数目。差异基因KEGG注释发现,差异基因主要富集在碳水化合物代谢、信号转导、能量代谢、脂质代谢等途径上。
碳水化合物是一类广泛存在于植物体内的一类重要有机物,占植物干质量的50%以上,主要由植物进行光合作用产生。糖在生物体内经一系列的降解而释放大量的能量供生命活动之需要。差异基因主要注释在戊糖和葡萄糖醛酸酯的相互转化、糖酵解/糖异生、磷酸戊糖途径、淀粉和蔗糖代谢通路,未水渍化损伤果肉中上调果糖激酶基因和蔗糖合酶基因的表达,促使6-磷酸果糖磷酸转化,催化蔗糖合成和分解,生成更多能量,维持细胞生命活动。
成熟植物细胞壁主要由纤维素、半纤维素和果胶质组成。这些多糖化合物在果胶酯酶、多聚半乳糖醛酸酶、果胶裂解酶等细胞壁降解酶作用下分解,促进果实软化。研究中发现,在水渍化西瓜中上调了果胶酯酶、果胶裂解酶、多半乳糖醛酸酶基因的表达。
植物激素信号转导和MAPK信号传导途径-植物是差异基因富集的重要代谢通路。曹声海[25]发现乙烯可能通过转录因子调节月季花朵衰老。钙调蛋白能与钙结合,调节细胞功能[26]。与CK相比,水渍化果肉上调了乙烯响应转录因子基因的表达,下调了钙调蛋白基因的表达,促进细胞衰老。
磷脂酶在植物对环境的应答中都起着重要的作用,研究发现组织受伤或遭受病原侵染后,磷脂酶介导的磷脂快速水解反应在伤口处被激发[27]。与CK相比,水渍化果肉中磷脂酶基因上调表达,可能与细胞应对水渍化损伤相关。
目前,研究发现西瓜水渍化损伤与碳水化合物代谢、能量代谢、信号转导、脂质代谢相关,研究结果从转录水平为解析鲜切西瓜水渍化的分子机理提供参考,为挖掘鲜切西瓜水渍化的关键功能基因提供基因资源。
