应用TLC-CMS技术检测核桃青皮中吲哚类生物碱
2021-07-15杨卫民杜京旗路文静
杨卫民,杜京旗,路文静
(吕梁学院,吕梁林果植物化学省市共建山西省重点实验室培育基地,山西省特色植物功能成分工程研究中心,山西吕梁033001)
核桃(Juglans regia L).又称胡桃,羌桃,为胡桃科植物。核桃青皮、花、叶中均含有一定量的不同种类的生物碱成分。作为一类来源于生物界的含氮有机物质,大部分生物碱分子的结构特性一般较为复杂,多具有显著的生理药理效应,呈现不同程度的碱性,是中草药的重要有效成分。一些生物碱由于在生物制药和卫生等方面具有很强的实用性潜能和开发市场,正逐渐成为人们研究热点,具有抗肿瘤、抗病毒、消炎等医学方面的作用。
吴茱萸碱结构式见图1。
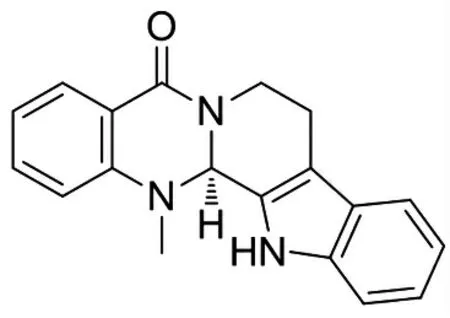
图1 吴茱萸碱结构式
吲哚类生物碱是具有吲哚分子骨架的一类化合物,具有多种良好的生理活性。目前,吲哚类生物碱的研究成为抗肿瘤药物研发的热点之一,特别是在新药及其新药先导化合物发现中具有不可替代的作用[1-3]。吲哚类生物碱抗肿瘤机制一般可分为2类,一类是直接杀伤肿瘤细胞,另一类是干扰细胞周期的有丝分裂阶段,抑制肿瘤细胞的分裂和增殖。此外,吲哚类生物碱抗肿瘤成分在诱导肿瘤细胞分化、促进肿瘤细胞凋亡和提高机体免疫力方面也表现出一定的作用。核桃青皮等是一种具有前景的抗肿瘤新药[4]。
核桃青皮、花、叶内均富含多种生物活性物质,关于青皮中有效化学成分的提取已被报道[4]。然而,目前生物碱的获取途径仍然比较单一,生物碱中的许多种类还没有得到深层次的研发。从当前的研究发展来看,局限性主要表现为某些分离技术的不成熟,比如较高的纯化成本、较低的分离产量等问题,尤其是大部分分离纯化技术尚处在实验室研究阶段。试验以核桃不同部位为原料,75%的甲醇为提取剂,经微波超声波组合萃取仪辅助处理,用薄层层析分离纯化获得三萜类化合物,用TLC-CMS技术对其进行了检测与表征,该技术可直接从TLC薄层板上获取质谱图,其优点是不经过样品前处理,可快速从复杂混合物中获得目标物分子质量信息,并对其进行鉴定。
1 材料与方法
1.1 材料、试剂及主要仪器
材料:核桃青皮、叶、枝条,均采集于吕梁。
试剂:甲醇、石油醚、氯仿、苯、冰乙酸、氢氧化钠、盐酸、环己烷等,均为分析纯;色谱甲醇;薄层硅胶板色谱分析板;吴茱萸碱(CAS:518-17-2;纯度>99%),购买于中检所。
仪器:ALB-224型电子天平,赛多利斯科学仪器有限公司产品;XH-300B型微波-超声波组合合成/萃取仪,北京祥鹄科技发展有限公司产品;KH-3000Plus型薄层色谱仪,上海科哲生化科技有限公司产品;Expressions型质谱仪、Plate ExpressTLC-质谱接口,美国Advion公司产品;Tensor-11型傅里叶红外光谱仪,德国布鲁克公司产品。
1.2 试验方法与步骤
1.2.1 总生物碱的粗提取
核桃青皮阴干、粉碎、过80目筛,称取7.2 g核桃青皮粉,以料液比1∶30加75%甲醇溶液,恒温振荡24 h,温度45℃。
超声波微波组合萃取仪分3个阶段提取,每阶段10 min,共30 min。在超声波恒定的条件下,分别设置温度为40,45,50℃;超声波功率为850,900,800 W;微波功率为100,200,300 W;超声波频率为50 kHz,模式15∶10,电机转速900 r/min。
提取液以转速4 000 r/min离心10 min,3次,合并上清液,上清液用0.45 μm微膜减压过滤,于水浴温度为65℃下浓缩至体积的1/4。
等量石油醚除杂3次,用盐酸酸化至pH值2~3时,等量氯仿萃取3次。用氢氧化钠碱化至pH值9~10时,用等量的氯仿∶甲醇溶液(3∶1,V/V)混合液体萃取3次,获取氯仿甲醇相后。浓缩至固体状,用色谱甲醇定容至10 mL。
核桃叶和枝处理方法与上述相同。
1.2.2 样液中吴茱萸碱含量检测
配制0.010 000,0.005 000,0.002 500,0.001 250,0.000 625 mg/mL质量浓度梯度的吴茱萸碱甲醇溶液,在最大吸收峰下测定其吸光度,绘制标准曲线。
分别检测新鲜核桃青皮和叶、陈叶、枝提取液的吸光度,计算其含量。
1.2.3 薄层色谱分离纯化
用微量进样器吸取25 μL吲哚类生物碱对照品溶液,置于全自动点样机上,设置点样参数(点样间距10 mm,点样宽度8 mm,点样数目4,点样量分别为2,4,6,点样速度5 s/μL),在聚酰胺薄膜上进行点样;再吸取25 μL供试品溶液,点样20 μL。
配制甲醇∶氯仿∶苯∶石油醚展开剂,倒入展开缸后盖等待20 min,将点样完成的硅胶板轻轻放入展开剂液面高2~3 mm的平卧式展开缸内,待到展开剂前沿距离硅胶板顶端约1 cm处时,取出晾干。将晾干的层析板放入薄层色谱成像系统,在365 nm的紫外光灯下观察层析情况,并拍照记录[5-6]。
1.2.4 红外光谱仪检测
将仪器和软件打开使其处于工作状态,在测量每一个样品之前,都需要测量单通道背景光谱,然后将样品用毛细管点样至光学台的金刚石上,再进行单通道样品光谱的测量。每一个样品测量后,都需要进行谱图处理,如进行气氛补偿,可消除CO2、H2O的干扰。然后将检测出来的光谱转换成倒峰,选择单峰检索标出每一个特征峰,保存并进行分析[7-9]。
1.2.5 质谱仪检测
标准品的质谱检测:用色谱甲醇和超纯水作为流动相。将仪器和软件打开使其处于工作状态,用微量进样器吸取10 μL的吴茱萸碱标准品溶液插入到进样口处,打到load档开始进样,进完样后打回到inject档。点开谱图界面对谱图进行分析并保存。
待测液的质谱检测:流动相与测标准品的流动相相同。使仪器和软件处于工作状态,将待测品薄层板置于TLC-质谱接口上,使激光对准圈出的吴茱萸碱斑点中心处[10]。用软件操作进行取样,点开谱图界面对谱图进行分析并保存。
1.2.6 样液比旋光度和熔点检测
通过对TLC的图谱色谱的分析,判定所分离的物质是有效分离,将分离物放入旋光仪中先用甲醇进行校正,然后将溶液倒入,调节模式,测定其旋光度和比旋光度,记录数值及其平均值。
将提取的样液放入蒸发皿中,在电热板上蒸发结晶成为固体,然后将固体放入一端封口的毛细管中,插入熔点仪中,调节适当的电压来升温,当固体变为固液平衡的状态时,温度计上显示的温度即为该物质的熔点[11-12]。
2 结果与分析
2.1 吲哚类生物碱的粗提取
吴茱萸碱标准品紫外光谱图见图2,吴茱萸碱的标准曲线见图3。
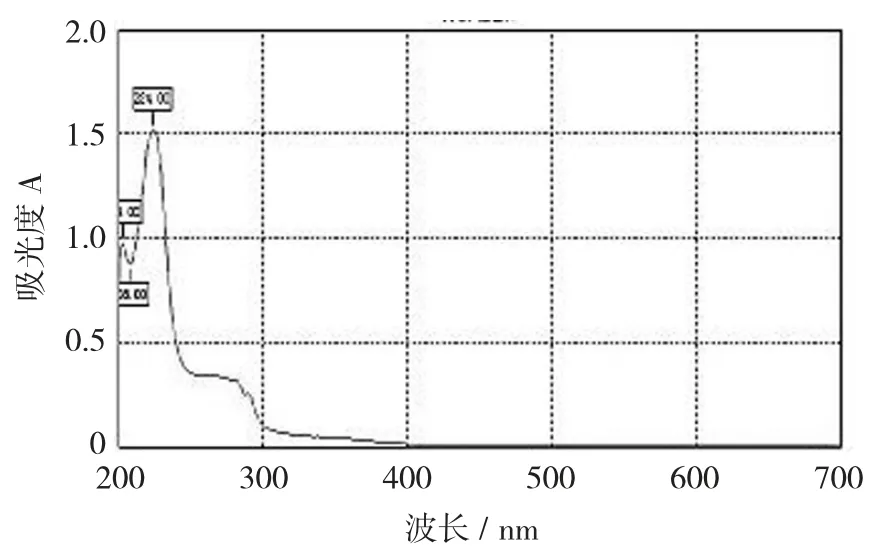
图2 吴茱萸碱标准品紫外光谱图
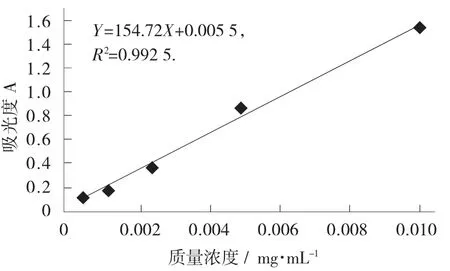
图3 吴茱萸碱的标准曲线
由图2可以看出,吴茱萸碱标准品于波长200~700 nm时进行光谱波峰扫描,于波长224 nm处有最大吸收波峰。
由图3可以看出,吴茱萸碱在最大吸收波峰下的标准曲线为:
Y=154.72X+0.005 5,相关系数为0.992 5,线性关系良好。
核桃供试样品中总生物碱的提取率和吴茱萸碱含量见表1。
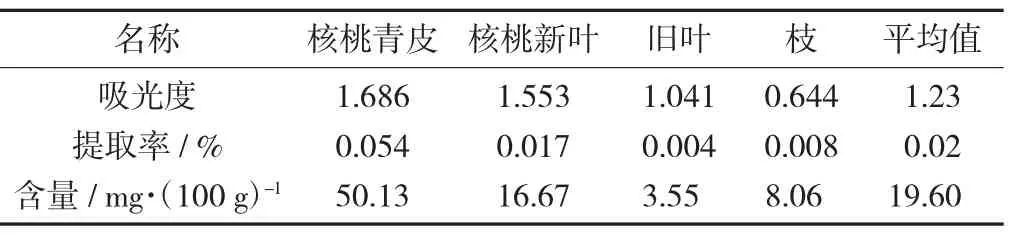
表1 核桃供试样品中总生物碱的提取率和吴茱萸碱含量
由表1可以看出,无论总生物碱的提取率还是吴茱萸碱的含量,核桃青皮中为最高,新鲜叶其次,枝条和陈叶中为最低[13]。
2.2 薄层色谱分离与分析
核桃青皮样液TLC成像图见图4,核桃新鲜叶样液TLC成像图见图5,核桃陈叶样液TLC成像图见图6,核桃嫩枝样液TLC成像图见图7。
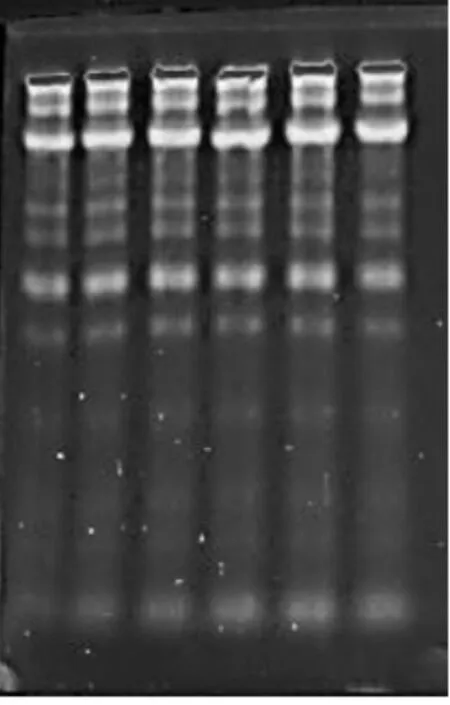
图4 核桃青皮样液TLC成像图
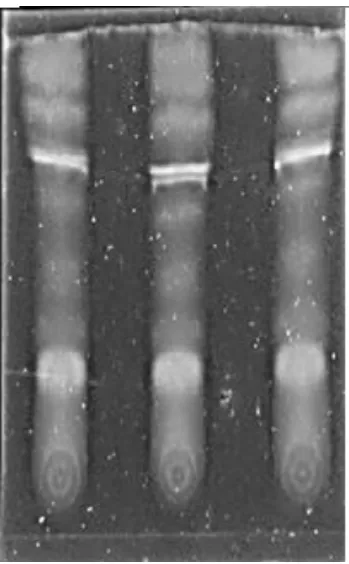
图5 核桃新鲜叶样液TLC成像图

图6 核桃陈叶样液TLC成像图

图7 核桃嫩枝样液TLC成像图
由图4~图7可以看出,在不同配比的展开剂下,核桃青皮和新鲜叶样液色谱斑点较多,展开效果良好,色谱斑点清晰。核桃陈叶和枝条样液色谱斑点较少,展开效果一般,陈叶样液色谱斑点有拖尾现象[14-16]。
该检测结果与紫外分析结果一致。
核桃青皮样液与吴茱萸碱标准品TLC成像图见图8,新鲜核桃叶与吴茱萸碱标准品TLC成像图见图9。
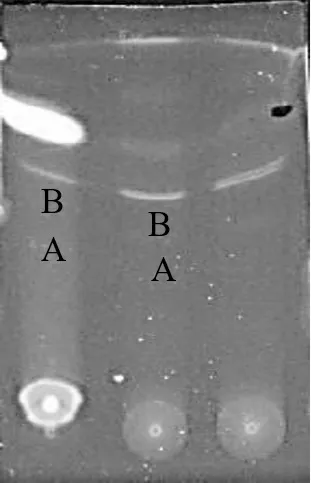
图8 核桃青皮样液与吴茱萸碱标准品TLC成像图
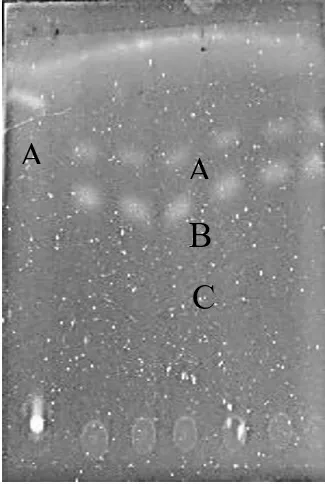
图9 新鲜核桃叶与吴茱萸碱标准品TLC成像图
核桃青皮等4种原料提取液所选用的4种展开剂是经过优化试验条件确定的。由于核桃各部分所含化学成分不同,选取的原料在储存上也有较大差异,因此选择了不同的展开剂。
经过对核桃青皮等提取液的光谱扫描,以及与吴茱萸碱光谱波峰比对,可初步确定提取的样品中含有吲哚类生物碱。但是,核桃青皮等提取液到底含有哪一种生物碱,需要对其与标准品进行比对,若有大致相同Rf值的物质出现,即可进一步确定所提取的物质是吲哚类生物碱[17]。
由图8可以看出,用甲醇∶氯仿∶苯∶石油醚(2∶16∶2∶5,V/V)作为展开剂,核桃青皮样品与吴茱萸碱标准品在同一硅胶板上展开,晾干后在紫外光下观察拍摄。结果显示,核桃青皮样品展开后色谱斑点很多,标记斑点A、B和C,其中斑点A吴茱萸碱标准品的Rf值基本一致,且非常清晰。可初步确定所提取的样品中含有吴茱萸碱,以及与吴茱萸碱极性相近的其他生物碱类化合物[18-19]。
由图9可以看出,在展开剂为甲醇∶氯仿∶苯∶石油醚(1∶9∶2∶5,V/V)下,出现较为明显的色谱斑点3个,其中斑点A与吴茱萸碱标准品展开位置基本相同,Rf值也大致相同。斑点B和C与吴茱萸碱标准品位置邻近,可能是极性相近的生物碱。
2.3 质谱检测结果与分析
吴茱萸碱标准品质谱图见图10,色谱斑点A质谱图见图11。
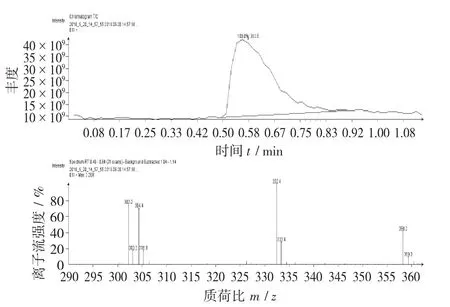
图10 吴茱萸碱标准品质谱图
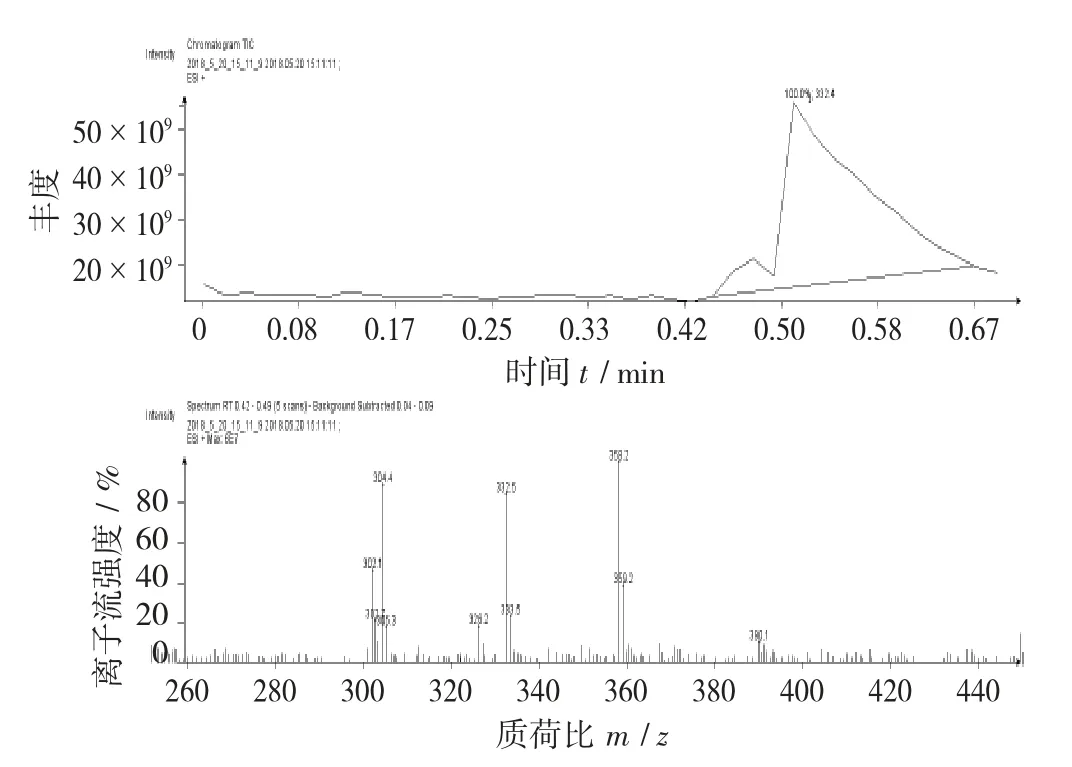
图11 色谱斑点A质谱图
通过查阅相关文献[20]可以得知,分子离子峰的识别首先是该离子峰范围内最大的峰值(m/z),其次需要判断该物质是否符合氮规划,不含N或含偶数N的有机分子,其分子离子峰的m/z(即分子量)为偶数。含奇数N的有机分子,其分子离子峰的m/z(即分子量)为奇数,这两点是识别离子峰的关键。
吴茱萸碱分子式为C19H17N3O,分子量为303,含3个氮原子,其分子离子峰m/z 303左右,为奇数。
由图11可以看出,色谱斑点A的分子离子峰为m/z 305.3,其分子离子峰满足氮规则。分子离子峰与较小的碎片离子峰产生了合理的碎片丢失(Δm),Δm=305.3-304.4≈1,表示在电子轰击下打掉了1个H,因此为合理丢失。
色谱斑点B质谱图见图12。
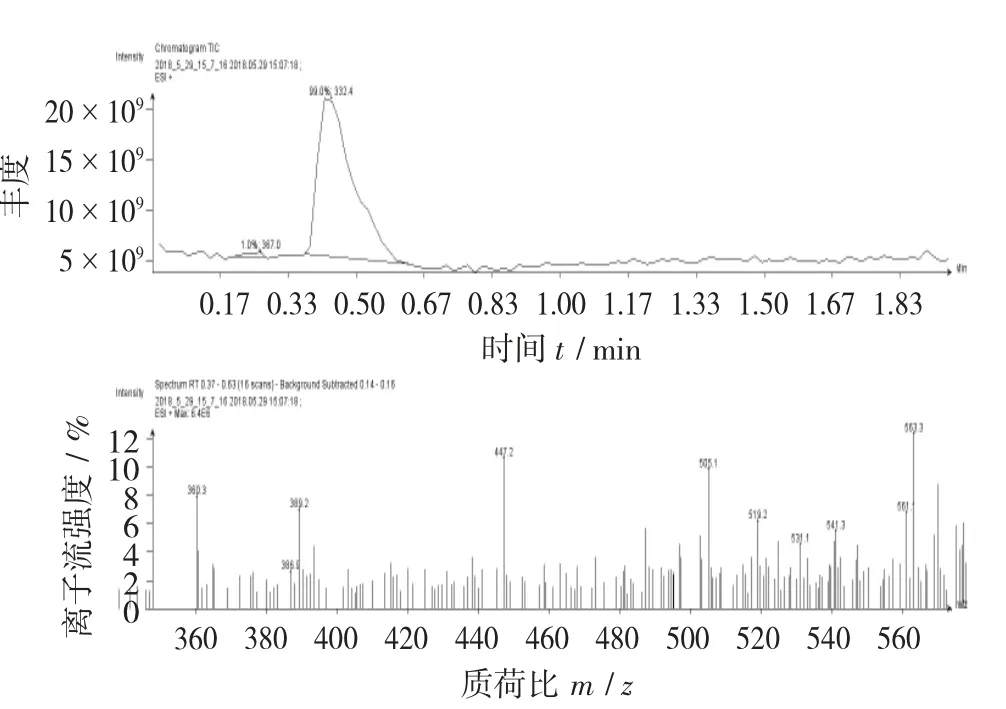
图12 色谱斑点B质谱图
由图12可以看出,色谱斑点B的质荷比(m/z)在360以上,而吴茱萸碱的相对分子质量为303,色谱斑点B不是吴茱萸碱,可能为其他吲哚类化合物。
色谱斑点C质谱图见图13。
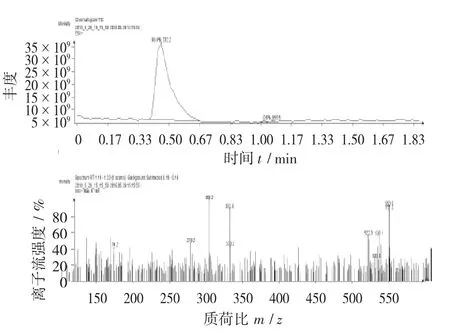
图13 色谱斑点C质谱图
由图13可以看出,色谱斑点C与吴茱萸碱标准品质谱图有相近的分子离子峰(304.2,332.1,333.2),故推测斑点C与吴茱萸碱可能有相似的分子组成,具体结构有待进一步分析。
2.4 红外检测结果与分析
吴茱萸碱标准品的红外光谱图(甲醇,第一次)见图14,吴茱萸碱标准品的红外光谱图(甲醇,第二次)见图15。
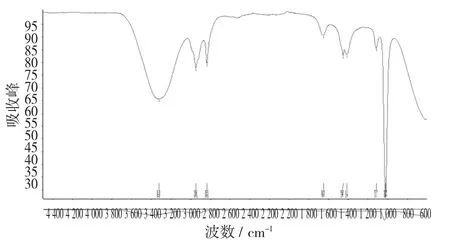
图14 吴茱萸碱标准品的红外光谱图(甲醇,第一次)
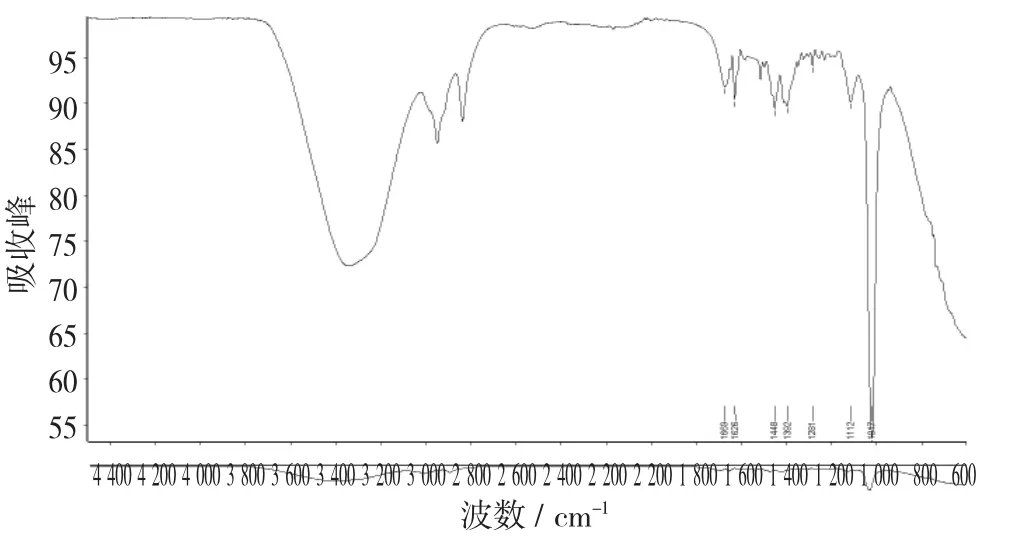
图15 吴茱萸碱标准品的红外光谱图(甲醇,第二次)
由图14和图15可以看出,吴茱萸碱标准品(甲醇)2次红外检测的结果大致一致,但存在差异(1 650 cm-1和1 669 cm-1,1 449 cm-1和1 448 cm-1,1 411 cm-1和1 392 cm-1,1 113 cm-1和1 112 cm-1,1 019 cm-1和1 017 cm-)1,可视为试验误差。
吴茱萸碱标准品的红外光谱图(氯仿)见图16。
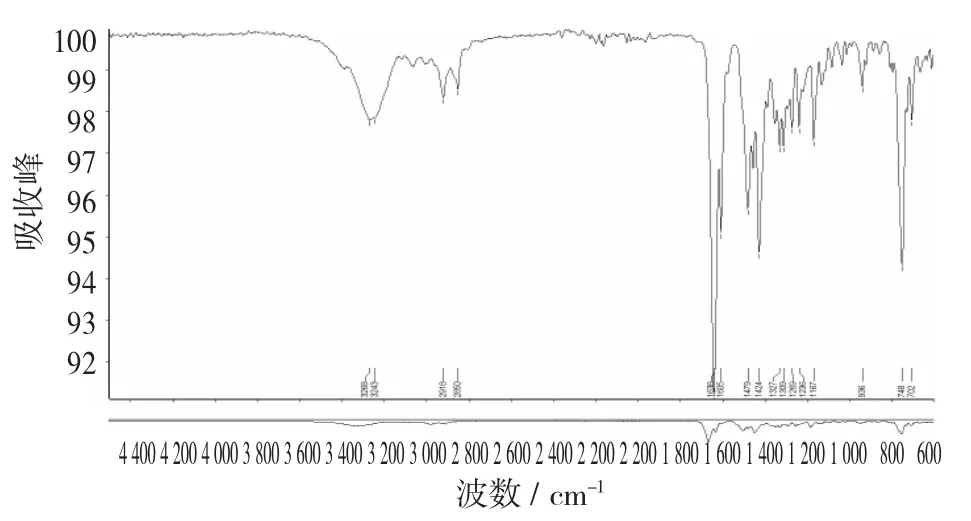
图16 吴茱萸碱标准品的红外光谱图(氯仿)
由图16可以看出,吴茱萸碱标准品(氯仿)和甲醇溶的吴茱萸碱,两者共同的峰值为吴茱萸碱的特征峰。(2 945 cm-1和2 918 cm-1,2 833 cm-1和2 850 cm-1,1 650 cm-1和1 638 cm-1,1 449 cm-1和1 479 cm-1,1 411 cm-1和1 424 cm-1,1 281 cm-1和1 269 cm-)1。
色谱斑点A的红外光谱图(甲醇)见图17,色谱斑点B的红外光谱图(甲醇)见图18。
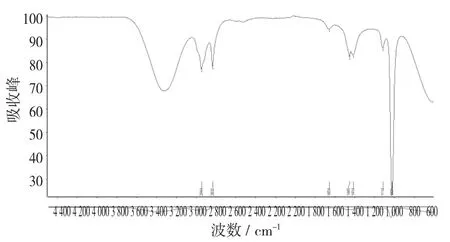
图17 色谱斑点A的红外光谱图(甲醇)

图18 色谱斑点B的红外光谱图(甲醇)
由图17可以看出,色谱斑点A在3 280 cm-1处出现了N-H的伸缩振动吸收峰,在1 654 cm-1处出现了C=O的特征吸收峰,在2 944 cm-1和2 832 cm-1处的吸收峰可以分别为CH3和CH2上的C-H伸缩振动吸收峰,在1 654,1 449,1 414,1 021 cm-1的吸收峰为苯环的特征吸收峰。这些光谱数据与标准品数据一致,也与文献报道[20]的大致一致,说明为吴茱萸碱。
由图18可以看出,色谱斑点B与吴茱萸碱标准品有相似之处。在2 943 cm-1和2 832 cm-1处的吸收峰可以分别归属为CH3和CH2上的C-H伸缩振动吸收峰,在1 449,1 415,1 115,1 022 cm-1的吸收峰为苯环的特征吸收峰,这与吴茱萸碱标准品有相似之处。但不完全相同,在2 318 cm-1处的峰可能为甲醇中的羟基峰,在1 654 cm-1左右没有出现的C=O的特征吸收峰。故推测斑点2可能为吲哚类其他物质。
色谱斑点C红外光谱图(甲醇)见图19。
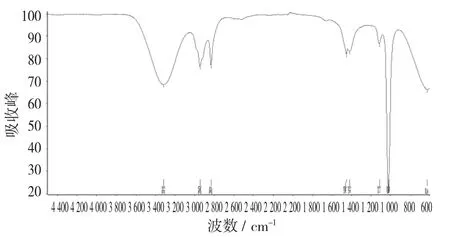
图19 色谱斑点C红外光谱图(甲醇)
由图19可以看出,色谱斑点C与斑点B的红外光谱图相似,同样有归属为CH3和CH2上的C-H伸缩振动吸收峰(2 943 cm-1和2 832 cm-)1,在1 449,1 415,1 115,1 022 cm-1的苯环的特征吸收峰。没有在1 654 cm-1左右出现的C=O的特征吸收峰。所以,推测斑点3可能为吲哚类其他物质,也可能为别的生物碱化合物。
2.5 比旋光度和熔点检测与分析
谱斑点的旋光度及比旋光度见表2,色谱斑点及吴茱萸碱标准品的熔点见表3。
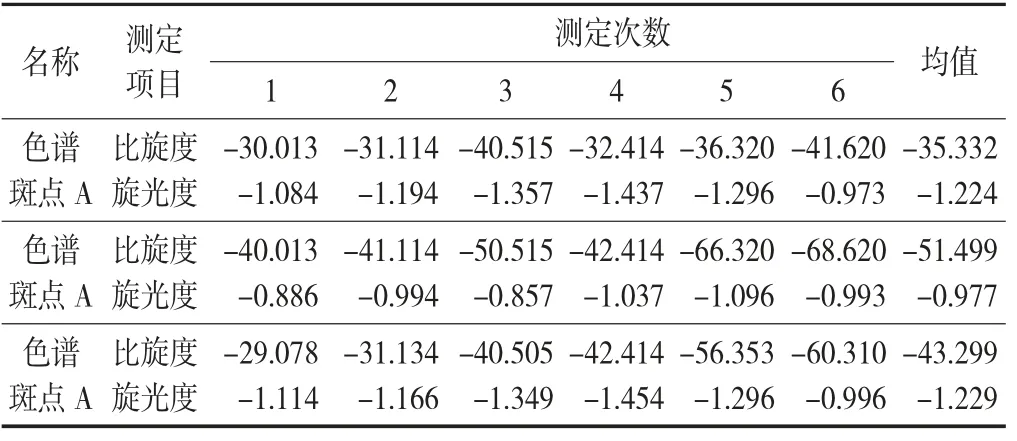
表2 色谱斑点的旋光度及比旋光度

表3 色谱斑点及吴茱萸碱标准品的熔点
3 结论
按料液比1∶30(m/V)加75%甲醇溶液,于超声波微波组合萃取仪中分3个阶段处理。每阶段10 min,共30 min。在超声波恒定的条件下,分别设置温度为40,45,50℃;超声波功率为850,900,800 W;微波功率为100,200,300 W;超声波频率为50 kHz,模式15∶10,电机转速900 r/min。新鲜核桃青皮、叶和枝中的吴茱萸碱含量依次是50.13,16.67,8.06 mg/100 g。新鲜核桃青皮和叶中所含物质种类较多,枝和陈叶中物质单一。试验过程中发现旧叶中几乎全是红色物质,而新叶中物质比较丰富,枝中物质较少。旧叶和新叶的不同,可能是旧叶被氧化的缘故。
在甲醇∶氯仿∶苯∶石油醚展开剂配比为2∶16∶2∶5(V/V);1∶9∶2∶5(V/V);1∶8∶2∶6(V/V)和1∶8∶2∶6(V/V)下,核桃青皮、新叶、旧叶和枝条样品展开效果良好,色谱斑点清晰;供试样品与吴茱萸碱标准品色谱斑点位置一致。TLC分离、纯化技术能适应不同物化特性的溶剂体系和多样性的操作条件,具有较强的适应性,为从复杂的天然产物粗制品中提取不同特性(如不同极性)的有效成分提供了有利条件。
供试样品与吴茱萸碱标准品的最大质荷比(m/z)为305,有相同的碎片丢失。质谱图中除包含与吴茱萸碱相符的碎片离子峰外,存在其他多个碎片离子峰或者基峰,推测原因有三:其一选择的离子源不合适,导致打出的碎片杂多;其二在电轰击过程中,产生了成倍的碎片离子峰;其三分离纯化程度不够,进入质谱的样液尚存在杂质。
供试样品与吴茱萸碱标准品在3 280 cm-1处有N-H的伸缩振动吸收峰,1 654 cm-1处有C=O的特征吸收峰,2 944 cm-1和2 832 cm-1处分别归属为CH3和CH2上的C-H伸缩振动吸收峰,1 654,1 449,1 414,1 021 cm-1处出现苯环的特征吸收峰;与吴茱萸碱Rf值相近的未知斑点,可能是其他吲哚类化合物。红外图谱中,洗脱物的特征峰除与对照品一致外,还有其他峰,但峰面积较小,影响较小,分析可能是TLC分离物中还有些许杂质,或者是吲哚类化合物中以吴茱萸碱为母核以外的结构,这需要进一步查阅文献并进行后续的研究。
薄层层析-质谱-红外(TLC-CMS-IR)在生物活性物质分离纯化中具有操作简便、容易掌握、回收率高、重现性好、分离效率高、分离量较大等特点。TLC-CMS-IR联用有望在标准品的制备、天然产物化学成分研究及新药筛选、评价、分析或质控需求等领域得到更广泛的应用。
