酪蛋白激酶1α1在脑胶质瘤中的表达及其临床意义
2021-07-15李欢刘关政刘雪娇张旭于如同
李欢,刘关政,刘雪娇,张旭,于如同
多形性胶质母细胞瘤(glioblastoma,GBM)是最常见的原发性中枢神经系统恶性肿瘤[1]。尽管已有许多治疗方式与靶点用于治疗其他癌症,但GBM的治疗仍然以手术为主,辅助放疗和化疗(替莫唑胺为主)。由于脑胶质瘤具有自我保护、快速增长以及先天药物抗性等特点,所以脑胶质瘤仍然是预后最差的肿瘤之一,其中位生存期仅为14个月[2-4]。此外,GBM患者生存期超过2年之后的复发率高达50%,患者的5年生存率仅为5.5%[5]。因此亟须寻找一个有效的治疗靶点方式来改善GBM患者的预后。酪蛋白激酶(casein kinase,CK)是催化肽链中邻近酸性氨基酸残基的丝氨酸/苏氨酸磷酸化的酶,包括酪蛋白激酶1(CK1)和酪蛋白激酶2(CK2)。CSNK1A1,即CK1α,是CK1的六个亚家族成员(α,γ1,γ2,γ3,δ和ε)之一。研究发现,敲除CSNK1A1可以降低急性髓系白血病细胞Rps6磷酸化,诱导p53的表达,进而抑制肿瘤细胞增殖[6]。除此之外,研究还发现抑制CSNK1A1可以抑制NF-κb信号通路,在非小细胞肺癌中降低了EGFR突变型对埃罗替尼的抵抗,进而改善非小细胞肺癌的预后[7]。目前酪蛋白激酶1α1(casein kinase 1 alpha 1,CSNK1A1)已经成为多种肿瘤治疗的靶点,包括慢性淋巴细胞白血病[8]和急性髓细胞白血病[6]。但关于CK1家族在脑胶质瘤中的作用,目前研究仅发现CK1ε的表达与GBM的疾病进展密切相关,抑制CK1ε基因可以抑制GBM细胞的增殖侵袭[9]。而CK1其他亚家族成员在脑胶质瘤中的作用尚不明确。有关CSNK1A1在脑胶质瘤表达的研究报道很少。为此,本研究运用生物信息学方法分析中国胶质瘤基因组图谱计划(Chinese glioma genome atlas,CGGA)数据库中的信息资料,以探讨CSNK1A1在脑胶质瘤中的表达及其临床意义。
1 材料与方法
1.1 一般资料 本研究共包含325例脑胶质瘤患者的信息,肿瘤相关基因信息及对应的临床资料均从CGGA(www.cgga.org.cn)中获取[10-11]。其中有13例患者的总生存时间未统计,在统计总生存时间的312例患者中,男197例,女115例;年龄8~79岁;胶质瘤WHO分级Ⅱ级者98例、Ⅲ级74例、Ⅳ级136例,有4例患者的肿瘤等级未明确。为区分CSNK1A1低表达与高表达,将患者按照CSNK1A1表达水平的中位数(72.86)分为CSNK1A1表达水平高于中位表达水平组(高表达组)和低于中位表达水平组(低表达组),每组各156例患者。为分析CSNK1A1表达与放疗的关系,将240例接受放疗的患者按照CSNK1A1中位表达水平(72.19)分为高表达组和低表达组,每组各120例患者。同样,将180例接受化疗患者按CSNK1A1中位表达水平(77.74)分为高表达组和低表达组,每组各90例患者。
1.2 方法
1.2.1 生存分析 生存期是指患者自病理学确诊之日起,至死亡或末次随访之间的时间。运用Kaplan-Meier分析法分析低表达组和高表达组患者的生存期。
1.2.2 相关性分析 用生物信息学方法整理CGGA数据库的数据;采用Pearson相关分析筛选325例脑胶质瘤患者与CSNK1A1表达相关的基因,筛选条件为相关系数(r>0.4,P<0.05)。
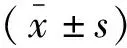
2 结 果
2.1 不同分级、分型脑胶质瘤的CSNK1A1表达水平 CGGA数据库的数据分析显示,CSNK1A1表达于各WHO分级脑胶质瘤中,WHO Ⅱ级、Ⅲ级、Ⅳ级脑胶质瘤的CSNK1A1表达水平比较,差异无统计学意义(P=0.27)。在各脑胶质瘤的传统病理分型中,CSNK1A1表达水平的差异也无统计学意义(P=0.43)。根据2016年WHO中枢神经系统肿瘤分类,星型细胞肿瘤(IDH野生型/突变型)、间变型星型细胞肿瘤(IDH野生型/突变型)、少突胶质细胞肿瘤(IDH野生型,1p19q联合缺失)和胶质母细胞肿瘤(IDH野生型/突变型)的CSNK1A1表达水平比较,差异无统计学意义(P=0.32)。见图1-3。

WHO Ⅱ级、Ⅲ级、Ⅳ级脑胶质瘤CSNK1A1表达水平的差异无统计学意义(P=0.27) 各种病理分型脑胶质瘤的CSNK1A1表达水平的差异无统计学意义(P=0.43) 各型胶质瘤的CSNK1A1表达水平的差异无统计学意义(P=0.32)
2.2 CSNK1A1表达水平对脑胶质瘤患者生存期的影响 对312例统计了总生存时间的患者进行Kaplan-Meier生存分析显示,CSNK1A1低表达组患者的生存时间明显长于高表达组患者(P<0.001);见图4。将患者的CSNK1A1表达水平及有关因素纳入多因素Cox风险比例回归模型分析,结果显示CSNK1A1的表达水平、患者确诊时的年龄、IDH突变型及染色体1p19q联合缺失与否是脑胶质瘤患者生存期的独立影响因素(HR分别为1.440、1.869、0.729、0.374;P=0.008,P<0.001,P=0.038,P<0.001);见表1。

CSNK1A1低表达组患者的生存时间明显长于高表达组患者(P<0.001)

表1 脑胶质瘤患者生存影响因素的COX回归分析(n=325)
2.3 CSNK1A1表达水平对放疗与化疗患者生存时间的影响 Kaplan-Meier生存分析显示,240例接受放疗的脑胶质瘤患者中,CSNK1A1低表达组患者放疗后的生存时间明显长于高表达组患者(P<0.001)。180例接受了化疗(以替莫唑胺为主)的脑胶质瘤患者中,CSNK1A1低表达组与高表达组患者化疗后生存时间的差异无统计学意义(P=0.157)。见图5、6。
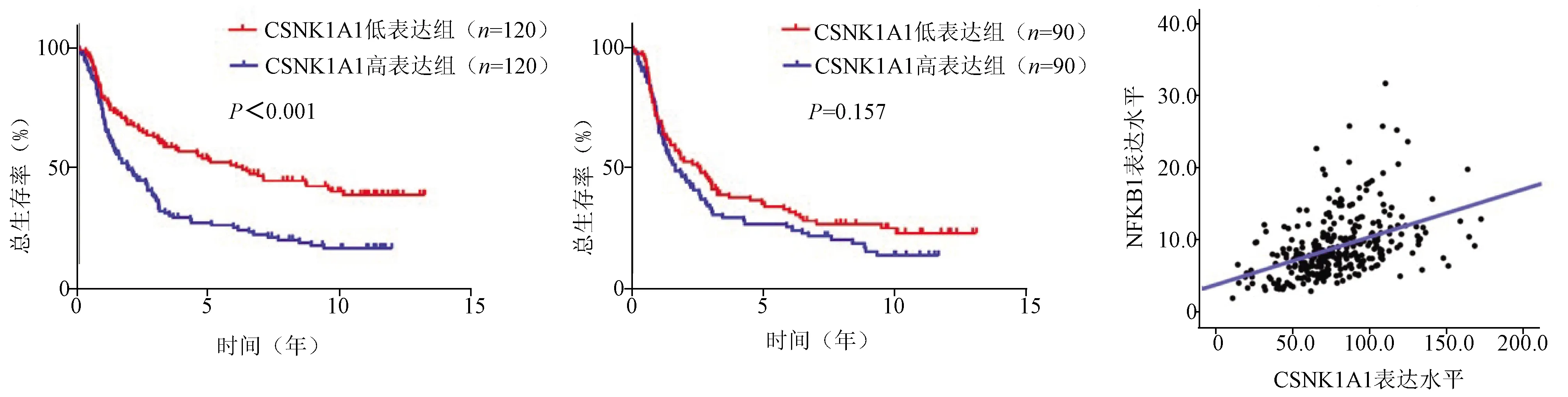
CSNK1A1低表达组患者的生存时间明显长于高表达组患者(P<0.001) CSNK1A1低表达组与高表达组患者的生存时间差异无统计学意义(P=0.157) NFKB1与CSNK1A1的表达水平呈正相关(r=0.44,P<0.001)
2.4 NFKB1与CSNK1A1表达水平的相关性 见图7。Pearson相关性分析显示,NFKB1的表达水平与CSNK1A1表达水平呈正相关(r=0.44,P<0.001)。
3 讨 论
CSNK1A1隶属于丝氨酸/苏氨酸蛋白激酶家族,存在于各类真核生物中,其序列结构呈高度保守[6]。近年来研究表明,CSNK1A1是慢性淋巴细胞白血病[8]和急性髓细胞白血病[6]的治疗靶点;其在肺癌中的作用机制也被深入研究[7]。目前CSNK1A1在脑胶质瘤的表达和具体作用尚未完全阐明。本研究首次通过CGGA数据库对325例脑胶质瘤患者的信息进行大数据分析,发现CSNK1A1广泛表达于脑胶质瘤中,且表达水平不会随着脑胶质瘤的病理级别或分型而改变。2016年WHO中枢神经系统肿瘤分类整合了表型和基因型特征进行肿瘤分类,有助于增加诊断的准确性,改善患者的诊疗与管理。本研究发现,按新分类各型脑胶质瘤的CSNK1A1表达水平也无明显差异。大量研究表明,脑胶质瘤的病理级别和分型对患者的预后影响极大。而本研究显示,无论是传统病理分型,还是纳入分子病理特征的最新版WHO中枢神经系统肿瘤分类,CSNK1A1表达水平都与脑胶质瘤的分子和病理分型无关。基于此推测,CSNK1A1有可能是一个独立于其他已知因素的新的影响因子。
关于CSNK1A1对脑胶质瘤患者的预后影响尚无文献报道。本研究对CGGA数据库中312例脑胶质瘤患者的生存时间,通过Kaplan-Meier生存分析显示,CSNK1A1低表达组患者的预后明显好于高表达组患者(P<0.001);并且通过COX风险比例回归模型进一步证实CSNK1A1是影响胶质瘤患者生存的独立影响因子。基于以上结果推测,CSNK1A1具有促进脑胶质瘤发生发展的作用,抑制CSNK1A1的表达可以改善脑胶质瘤患者的预后。
为进一步探讨抑制CSNK1A1表达改善脑胶质瘤预后的作用机制,本研究通过Pearson相关分析发现NFKB1的表达水平与CSNK1A1表达水平呈正相关(r=0.44,P<0.001)。NFKB1是NF-κB复合蛋白的重要组成蛋白,NF-κB是被真核细胞广泛用作控制细胞增殖和细胞存活的基因调节因子。在癌症中,控制NF-κB信号传导通路的蛋白质发生突变或异常表达,可以导致恶性细胞与其他生物体之间的协调缺陷,进而导致肿瘤的发生发展与侵袭。在肿瘤细胞中,NF-κB具有活性,这是由于编码NF-κB转录因子本身的基因突变或控制NF-κB活性的基因突变或异常表达所致。此外,一些肿瘤细胞分泌导致NF-κB活跃的因子也可导致NF-κB信号通路的激活。阻断NF-κB可导致肿瘤细胞停止增殖侵袭,引起肿瘤细胞的凋亡或对抗肿瘤药物的作用更敏感[17]。本研究的结果表明,NFKB1与CSNK1A1的表达水平呈正相关性;而NFKB1是NF-κB信号通路的标志基因,CSNK1A1表达水平越低,NFKB1的表达水平也越低,使NF-κB信号通路被抑制,进而抑制脑胶质瘤细胞的增殖与侵袭。但CSNK1A1低表达改善脑胶质瘤患者预后的机制尚需要进一步的实验研究来证实。
本研究显示,在接受放疗的患者中,CSNK1A1低表达组患者的生存期明显比高表达组患者长(P<0.001);而在接受化疗的患者中,CSNK1A1低表达组与高表达组患者的生存时间的差异无统计学意义(P=0.157)。基于此结果推测,CSNK1A1低表达组患者对放疗的敏感性要高于CSNK1A1高表达组患者,抑制CSNK1A1表达可能会改善脑胶质瘤的放疗抵抗性,增强脑胶质瘤患者的放疗敏感性。放疗是临床治疗脑胶质瘤的重要方法之一。但高级别胶质瘤具有对放疗的抵抗能力,从而导致肿瘤对放疗不敏感,患者治疗后很快复发[18]。以往文献报道,DNA损伤应答(DNA damage response,DDR)通路在脑胶质瘤放疗抵抗中具有重要作用;该通路主要参与检测DNA损伤、启动DNA修复以及调节细胞周期和凋亡等进程。DDR通路的缺陷会导致GBM的发生,并增强GBM的放疗抵抗[19-20]。以往研究表明,肿瘤微环境在肿瘤的发生发展与肿瘤细胞侵袭过程中被认为起到关键作用,细胞因子存在于许多肿瘤的微环境中,其主要来源于肿瘤细胞、激活的组织和肿瘤浸润的免疫细胞[12]。细胞因子是细胞间传导信号的基础媒介,这些细胞因子有些可以抑制肿瘤的增殖,有些却能促进肿瘤细胞的增殖侵袭。在乳腺癌中白细胞介素(interleukin,IL)-6和IL-8在血清及组织中的表达水平是临床预后的指标;在脑胶质瘤中,IL-1β、IL-6和IL-8促进肿瘤增殖,保留干细胞源性,促进肿瘤血管生成及侵袭;IL-6、IL-8、CXCL1、GM-CSF、TGFβ2普遍被认为与肿瘤的进展密切相关[13-16]。近年来的研究表明,放疗不仅可以直接杀伤肿瘤组织及其血管,还可以调节肿瘤微环境中细胞因子分泌进而抑制肿瘤的进展[21]。但是这一过程分泌的某些细胞因子,如IL-6却可以引起放疗抵抗,从而降低放疗的疗效[22]。而NF-κb信号通路可以促进IL-6的合成分泌[17];CSNK1A1低表达患者的NFKB1表达水平也低,进而可能通过抑制NF-κb信号通路减少IL-6的分泌,起到增强放疗敏感性的作用。故推测CSNK1A1有可能通过NF-κb信号通路调节IL-6的合成分泌,参与胶质瘤细胞DNA的损伤修补,在DDR中起重要作用。
综上所述,CSNK1A1的表达水平是影响胶质瘤患者预后的独立影响因素;CSNK1A1可能成为胶质瘤一个新的有效治疗靶点。而且CSNK1A1表达水平可以影响放疗患者的预后,因而CSNK1A1抑制剂可能成为放疗的增敏剂,从而改善胶质瘤患者的预后。但CSNK1A1表达与胶质瘤患者预后的具体作用机制尚需要进一步的临床及实验研究证实。
