PTEN表达对恶性脑胶质瘤细胞放射敏感性的影响及其机制研究
2021-07-15李欣欣杨永辉李京任秉辉王辉朱雁冰
李欣欣,杨永辉,李京,任秉辉,王辉,朱雁冰
恶性脑胶质瘤是临床上常见的颅脑肿瘤,其占颅脑肿瘤的比例高达60%[1],主要以浸润性方式生长,与脑组织无明确分界,通过手术难以彻底切除;并且扩散速度快,复发性高。目前,手术切除后联合放疗是恶性脑胶质瘤极为重要的治疗方法,但大部分脑胶质瘤对放疗不敏感,导致治疗效果仍不理想[2]。因此,增强恶性脑胶质瘤的放射敏感性成为了优化治疗,改善患者预后的一个重要途径。近年来研究发现,第10号染色体缺失性磷酸酶和张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)是一种具有磷酸酶活性的肿瘤抑制因子,在各种肿瘤的发生发展中发挥作用[3]。目前研究发现,PTEN在肺癌、晚期乳腺癌、晚期结直肠癌中均异常表达[4-5]。另外有研究显示,PTEN失活及survivin高表达是胃癌发展及预后的关键因素[6];中华龙胆总黄酮通过PI3K/AKT/PTEN信号通路诱导肝癌细胞凋亡[7]。然而,PTEN对恶性脑胶质瘤放射敏感性的影响目前尚不清楚。为此,本研究采用细胞实验方法探讨PTEN对恶性脑胶质瘤放射敏感性的影响及其机制,以进一步阐明PTEN在恶性脑胶质瘤T98G细胞中的关键作用。
1 材料与方法
1.1 材料 恶性脑胶质瘤组织(20例)以及距病变部位≥2 cm的癌旁正常组织标本(10例)来自开滦总医院;采集的标本经过患者和家属同意,保存在液氮中备用。恶性脑胶质瘤U251细胞和T98G细胞,正常脑胶质HEB细胞(上海中国科学院细胞库);DMEM(Dulbecco’s-modified Eagle’s medium)培养基,胎牛血清(fetal bovine serum,FBS)(美国Sigma公司);CCK-8试剂盒(上海碧云天生物科技有限公司);PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)和LipofectamineTM2000(大连Takara公司);PI3K抑制剂LY294002、AKT抑制剂CCT128930(美国Selleck生物科技公司);PI3-kinase p110γ抗体,GAPDH多克隆抗体(上海圣克鲁斯生物公司);Anti-pan-AKT,Anti-GSK3β抗体(英国abcam公司);siRNA NC,PTEN siRNA,pcDNA-PTEN质粒(北京擎科生物有限公司合成)。
1.2 方法
1.2.1 细胞培养 在含10% FBS的DMEM培养基中培养U251细胞、T98G细胞和HEB细胞,于37 ℃、5% CO2饱和湿度条件下培养。当细胞汇合度约为90%时,用0.25%的胰蛋白酶进行传代培养。取处于对数生长期的细胞用于后续实验。
1.2.2 细胞转染 取处于对数生长期的细胞铺于12孔板中,细胞汇合至75%~80%时,将培养基更换成无血清培养基;用无FBS培养基稀释各组重组质粒和LipofectamineTM2000,将稀释后的重组质粒和脂质体混匀,室温孵育20 min;将混合物滴加到细胞中,或转染重组质粒后,采用0、2、4、6 Gy的X线垂直照射细胞,所用剂量率为3 Gy/min;48 h后收集各组细胞RNA和蛋白进行生物学功能实验。
1.2.3 细胞增殖测定 取处于对数生长期的细胞,用胰蛋白酶消化细胞制成细胞悬液,接种于96孔板中;细胞汇合达70%~80%时,使用LipofectamineTM2000转染质粒,或转染后用6 Gy X线照射细胞,于37 ℃、5% CO2培养箱中培养48 h后弃上清,每孔加入10 μL浓度为5 mg/mL的四甲基偶氮唑盐(tetramethylazozolium salt,MTT)溶液;孵育4 h后去上清,加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO)终止反应,用酶标仪读取490 nm处每孔细胞的吸光度值。
1.2.4 细胞侵袭实验 将-20 ℃保存的matrigel置于4 ℃融化,用无FBS DMEM培养基稀释matrigel浓度为1 mg/mL。每个上室中加入100 μL稀释后的matrigel,室温孵育干成胶状。细胞汇合达95%时,用6 Gy X线照射细胞,0.25%的胰酶消化后,用无FBS的DMEM培养基稀释为细胞悬液,加入Transwell小室中;下室中加入完全培养基,37 ℃、5% CO2培养箱培养24 h后,PBS洗3次,4%多聚甲醛固定15 min,0.1%结晶紫染色20 min,在显微镜下选取5个视野细胞观察并计数。
1.2.5 细胞凋亡率检测 用LipofectamineTM2000转染试剂将各组重组质粒转染至T98G细胞,用6 Gy X线照射细胞,0.25%胰酶消化后,用完全培养基进行中和,1 000 r/min离心15 min,弃上清。将沉淀置于70%的乙醇中,4 ℃固定过夜,采用流式细胞仪检测各组细胞的凋亡水平。
1.2.6 PTEN mRNA表达量检测 采用实时荧光定量PCR方法。将恶性脑胶质瘤组织和癌旁组织从液氮中取出,加入液氮进行研磨,破碎后按RNA提取试剂盒说明书的步骤提取各组织中总RNA。取各对数生长期的恶性脑胶质瘤细胞,使用Trizol提取细胞RNA。用Nanodrop检测总RNA的浓度和纯度,使用Takara反转录试剂盒反转成cDNA,逆转录得到的cDNA为模板,进行RT-qPCR;反应程序为95 ℃ 10 min,95 ℃ 15 s,60 ℃ 1 min,40个循环;用2-△△Ct法分析实验结果。实验所用的引物为:GAPDH-F:CAAGGACCTCTACGCCAACAC;GAPDH-R:TGGAGGCGCGATGATCTT;PTEN-F:CACAGA-ATTCCAGACATGACAGCCATCATC;PTEN-R:GTG-GATCCTCATGGTGTTTTATCCCTCTTG。
1.2.7 PTEN蛋白表达水平检测 采用Western blot法。从液氮中取出肿瘤组织和癌旁组织剪碎,加入RIPA裂解液后研磨成组织匀浆,从组织蛋白中提取总蛋白。T98G细胞根据提取蛋白说明书提取总蛋白,使用BCA试剂盒测定蛋白质浓度,取适量样品进行点样,以5%的浓缩胶、12%的分离胶进行电泳,结束后采用湿转将蛋白湿转到PVDF膜上。用50 g/L脱脂奶粉配制封闭液,将膜置于封闭液中在摇床上室温封闭120 min。加入一抗在4 ℃下过夜反应,TBST清洗5次,每次5 min,再与辣根过氧化物酶标记的二抗室温孵育2 h,采用ECL法进行蛋白显影。
2 结 果
2.1 恶性脑胶质瘤组织和细胞的PTEN表达量 恶性脑胶质瘤组织的PTEN mRNA和蛋白表达量明显低于瘤旁正常组织(均P<0.01)(图1A-C)。脑胶质瘤U251细胞和T98G细胞的PTEN mRNA和蛋白表达量明显低于正常脑胶质HEB细胞(P<0.05~0.01),且在恶性脑胶质瘤T98G细胞中的表达量最低(P<0.01)(图1D-F)。因此选择恶性脑胶质瘤T98G细胞用于后续实验。
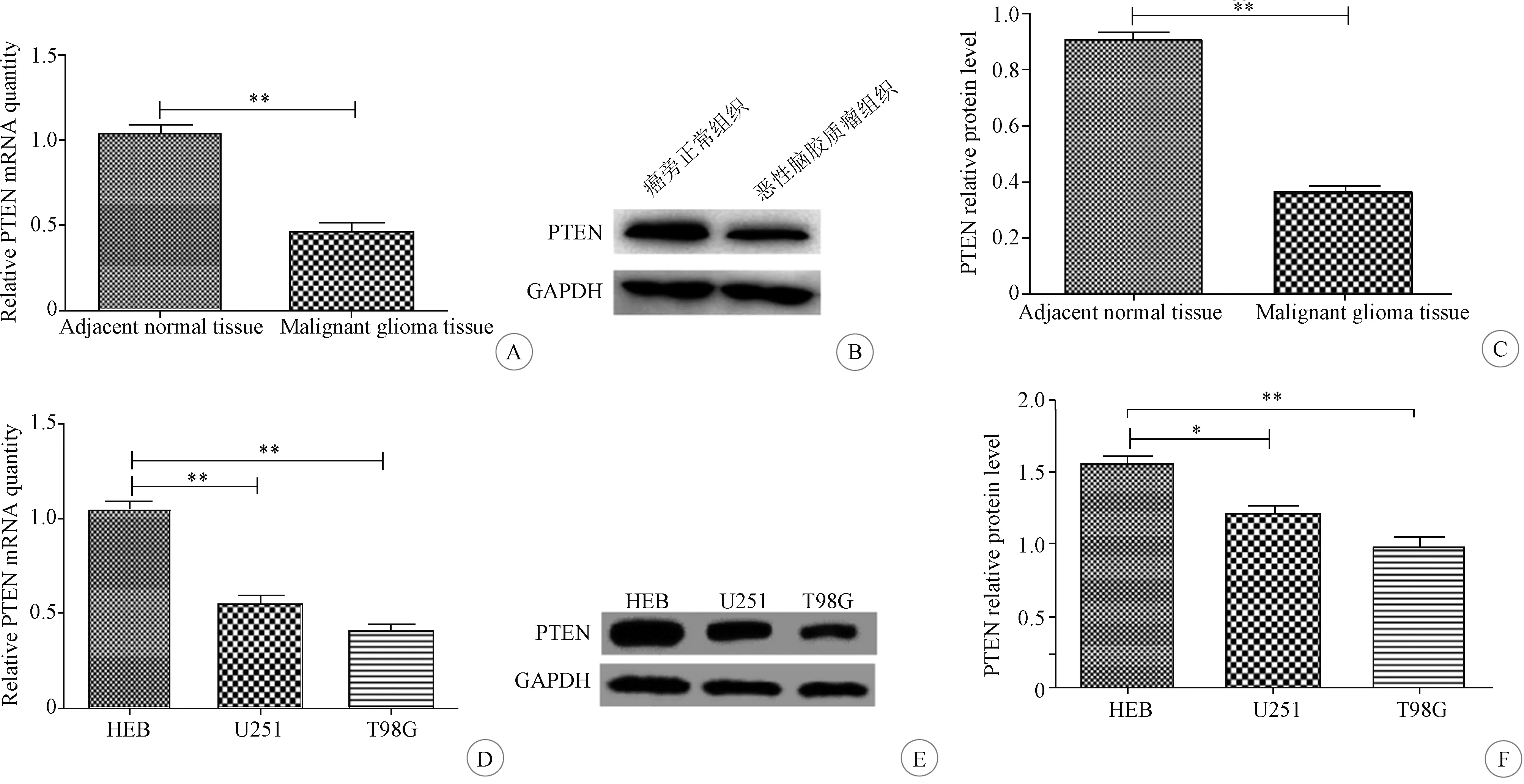
A:恶性脑胶质瘤与癌旁正常组织的PTEN mRNA表达量比较;B:恶性脑胶质瘤与癌旁正常组织的PTEN蛋白表达水平检测;C:恶性脑胶质瘤与癌旁正常组织的PTEN蛋白表达水平比较;D:HEB、U251和T98G细胞的PTEN mRNA表达量比较;E:HEB、U251和T98G细胞的PTEN蛋白表达水平检测;F:HEB、U251和T98G细胞的PTEN蛋白表达水平比较(*P<0.05,**P<0.01,***P<0.001,n=3)
2.2 不同剂量X线照射T98G细胞的PTEN表达量比较 2 Gy、4 Gy、6 Gy X线照射T98G细胞的PTEN mRNA和蛋白表达量明显高于无X线照射(0 Gy)T98G细胞(P<0.05~0.001);并且随X线照射剂量增高,T98G细胞的PTEN表达量亦升高。见图2。

A:不同剂量X线照射T98G细胞的PTEN mRNA表达量比较;B:不同剂量X线照射T98G细胞PTEN蛋白表达水平检测;C:不同剂量X线照射T98G细胞的PTEN蛋白表达水平比较(*P<0.05,**P<0.01,***P<0.001,n=3)
2.3 过表达PTEN对T98G细胞放射敏感性的影响 与pcDNA-3.1(+)组相比,pcDNA-PTEN组和pcDNA-3.1(+)+6 Gy组细胞的PTEN mRNA表达量均明显升高(P<0.001,P<0.01);与pcDNA-3.1(+)+6 Gy组相比,pcDNA-PTEN+6 Gy组细胞的PTEN mRNA表达量明显升高(P<0.001)(图3A)。与pcDNA-3.1(+)组相比,pcDNA-PTEN组和pcDNA-3.1(+)+6 Gy组T98G细胞活力明显下降、细胞侵袭数明显减少、细胞凋亡率明显增高(P<0.05~0.01);与pcDNA-3.1(+)+6 Gy组相比,pcDNA-PTEN+6 Gy组T98G细胞活力下降、细胞侵袭数明显减少、细胞凋亡率明显增高(P<0.05~0.01)(图3B-F)。
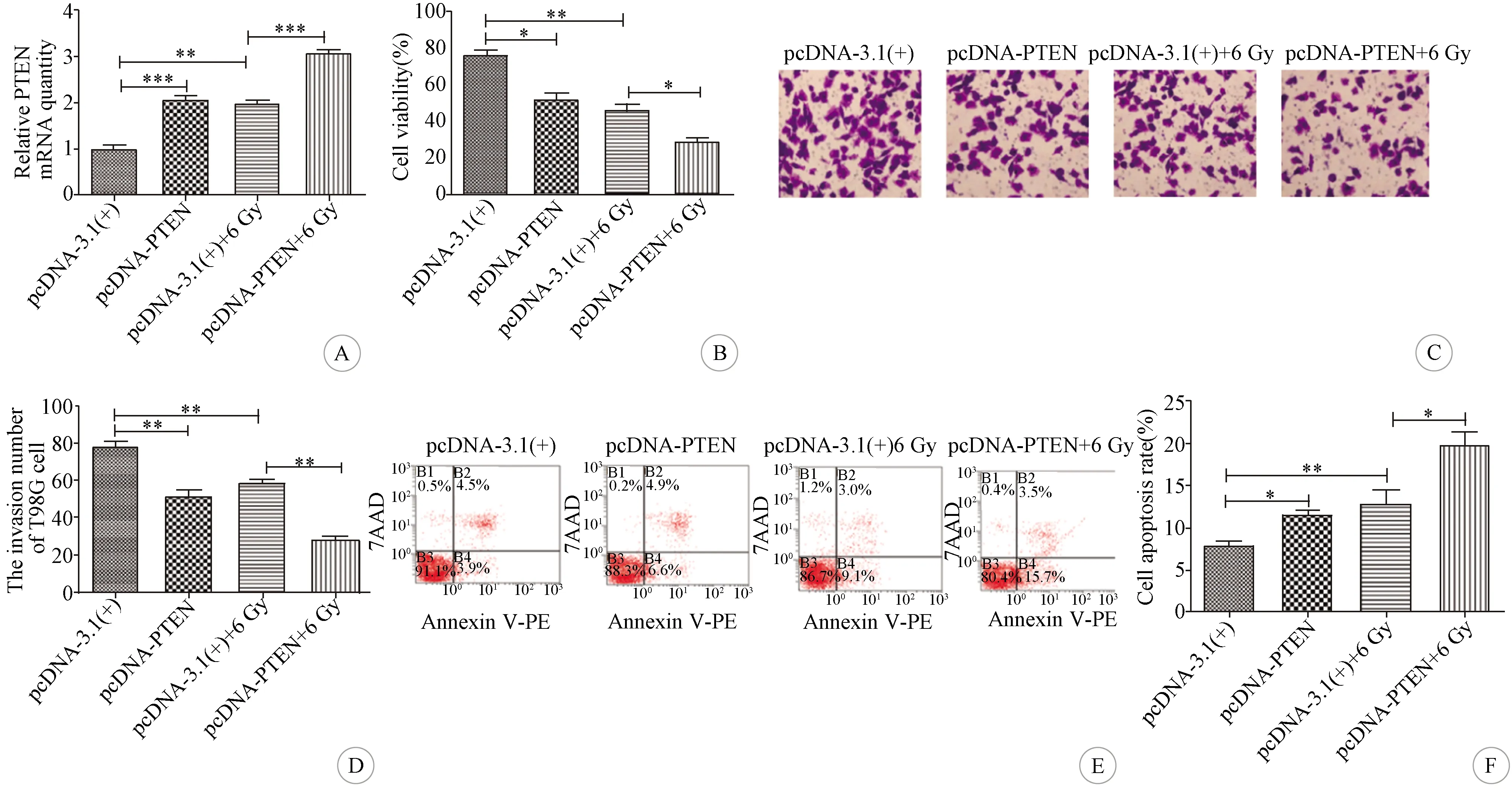
A:各组细胞的PTEN mRNA表达量比较;B:各组细胞的生长活性比较;C:各组细胞侵袭实验的结果(结晶紫染色,×200);D:各组细胞侵袭数比较;E:流式细胞仪检测各组细胞凋亡数;F:各组细胞的凋亡率比较(*P<0.05,**P<0.01,***P<0.001,n=3)
2.4 下调PTEN对T98G细胞放射敏感性的影响 PTEN siRNA组T98G细胞的PTEN mRNA表达量显著低于siRNA NC组,siRNA+6 Gy组细胞的PTEN mRNA表达量明显高于siRNA NC组和PTEN siRNA+6 Gy组(均P<0.01)(图4A)。与siRNA NC组相比,PTEN siRNA组T98G细胞活力明显升高、细胞侵袭数明显增加、细胞凋亡率明显降低(P<0.05~0.01),siRNA+6 Gy组T98G细胞活力明显降低、细胞侵袭数明显减少、细胞凋亡率明显升高(P<0.05~0.01);与siRNA+6 Gy组相比,PTEN siRNA+6 Gy组T98G细胞活力升高、细胞侵袭数明显增加、细胞凋亡率明显降低(P<0.05~0.01)(图4B-F)。
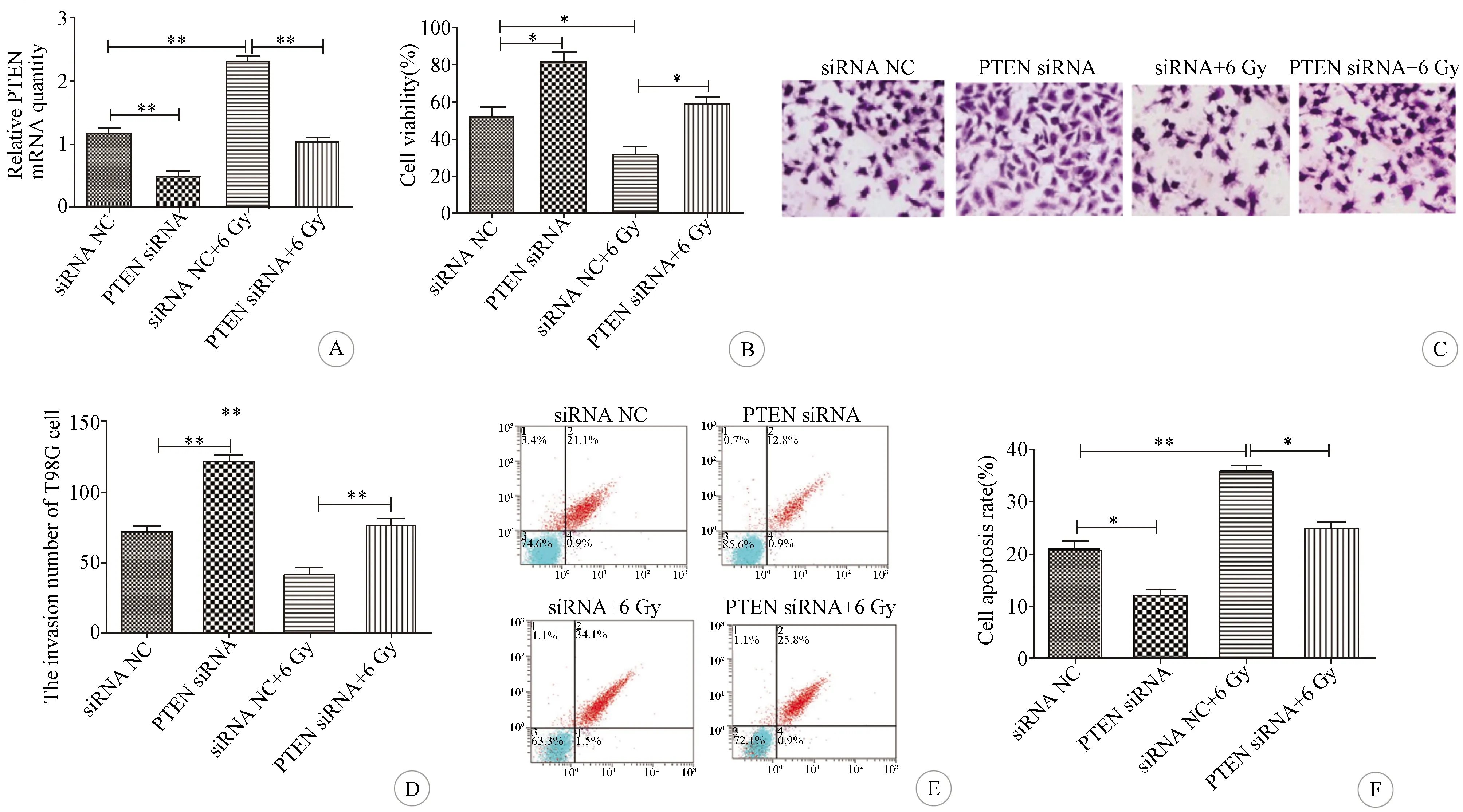
A:各组细胞的PTEN mRNA表达量比较;B:各组细胞的生长活性比较;C:各组细胞侵袭实验结果(结晶紫染色,×200);D:各组细胞的侵袭数比较;E:流式细胞仪检测各组细胞凋亡数;F:各组细胞的凋亡率比较(*P<0.05,**P<0.01,***P<0.001,n=3)
2.5 敲低PTEN对T98G细胞PI3K-AKT-GSK3β信号通路的影响 PTEN siRNA组细胞的PTEN mRNA表达量明显低于siRNA NC组(P<0.01)(图5A)。与siRNA NC组相比,PTEN siRNA组细胞PI3K、AKT和GSK3β蛋白的磷酸化水平以及p-AKT/AKT、p-PI3K/PI3K、p-GSK3β/GSK3β比值均显著升高(P<0.05~0.01)(图5B-C)。用PI3K抑制剂LY294002预处理细胞后,阻断了敲低PTEN诱导的AKT磷酸化;用AKT抑制剂CCT128930预处理细胞后,阻断了敲低PTEN诱导的GSK3β磷酸化(图5D-G);表明AKT作用于PI3K的下游,而GSK3β作用于AKT的下游。

A:PTEN siRNA组与siRNA NC组细胞PTEN mRNA表达量比较;B:两组细胞的PI3K、p-PI3K、AKT、p-AKT、GSK3β、p-GSK3β蛋白表达量;C:两组细胞的p-PI3K/PI3K、p-AKT/AKT、p-GSK3β/GSK3β表达水平比较;D:LY294002处理组及PTEN siRNA组、siRNA NC组细胞的AKT、p-AKT蛋白表达量;E:3组细胞的p-AKT/AKT表达水平比较;F:CCT128930处理组及PTEN siRNA组、siRNA NC组细胞的GSK3β、p-GSK3β蛋白表达量;G:3组细胞的p-GSK3β/GSK3β表达水平比较(*P<0.05,**P<0.01,***P<0.001,n=3)
2.6 敲低PTEN激活PI3K-AKT-GSK3β信号通路对T98G细胞放射敏感性的影响 与siRNA NC组相比,PTEN siRNA组细胞的PTEN mRNA表达量明显下降,siRNA NC+6 Gy组细胞的PTEN mRNA表达量明显升高(均P<0.01);与siRNA NC+6 Gy组相比,PTEN siRNA+6 Gy组细胞的PTEN mRNA表达量明显下降(P<0.01)(图6A)。与siRNA NC组相比,PTEN siRNA组细胞活力明显上升、细胞侵袭数明显增多、细胞凋亡率降低(P<0.05~0.01),siRNA NC+6 Gy组细胞活力下降、细胞侵袭数减少、细胞凋亡率增高(P<0.05~0.01);与siRNA NC+6 Gy组相比,PTEN siRNA+6 Gy组细胞活力上升、细胞侵袭数增多、细胞凋亡率降低(P<0.05~0.01);与PTEN siRNA+6 Gy组相比,PTEN siRNA+6 Gy+LY294002组细胞活力降低、细胞侵袭数减少、细胞凋亡率增高(均P<0.05)(图6B-F)。结果表明敲低PTEN激活PI3K-AKT-GSK3β信号通路影响T98G细胞的放射敏感性。

A:各组细胞PTEN mRNA表达量比较;B:各组细胞的生长活性比较;C:各组细胞侵袭实验结果(结晶紫染色,×200);D:各组细胞侵袭数比较;E:流式细胞仪检测各组细胞的凋亡数;F:各组细胞的凋亡率比较(*P<0.05,**P<0.01,***P<0.001,n=3)
3 讨 论
近年来恶性脑胶质瘤的发病率不断上升,患者的预后不良,严重影响着生命健康。因此深入探讨恶性脑胶质瘤的致病机制具有重要意义。PTEN是具有蛋白磷酸酶活性和脂质磷酸酶活性的肿瘤抑制基因,并通过其双特异性磷酸酶活性调控多种信号途径,进而调控各种细胞的生命进程。研究发现,PTEN在肿瘤的形成中起重要作用,在多种肿瘤组织中表达异常,另外在肿瘤组织中常出现缺失或突变。如有研究显示,在食管癌患者中PTEN表达下调[8],在原位癌和外阴鳞状细胞癌中PTEN发生了突变[9],在肾癌、乳腺癌、脑癌和胰腺导管腺癌等癌症中出现缺失或突变[10-12]。本研究分析了恶性脑胶质瘤的PTEN mRNA和蛋白表达水平,实验结果显示,恶性脑胶质瘤组织和T98G细胞的PTEN mRNA和蛋白表达显著下调,表明PTEN的异常表达与恶性脑胶质瘤的发生具有相关性。
由于晚期恶性脑胶质瘤患者对放射治疗不敏感,对患者预后产生严重影响;因此,提高恶性脑胶质瘤对放射治疗的敏感性至关重要。研究表明,细胞内基因调控的DNA损伤修复、细胞凋亡和细胞增殖等过程与放射敏感性密切相关;基因多态性及基因变异等都与放射敏感性相关[13-14]。PTEN负调控细胞周期和多种信号途径,能够抑制细胞的迁移、分化、衰老及凋亡等多种生理活动。研究发现,抑癌基因PTEN诱导膀胱癌细胞的凋亡与其脂质磷酸酶抑制AKT的磷酸化有关[15];在结直肠癌中,TRIM14通过抑制PTEN促进细胞增殖及抑制细胞凋亡[16]。最近研究发现,敲除PTEN在乳腺、皮肤及前列腺等多组织器官中的表达会引起肿瘤形成[17]。此外,miR-548-3p通过核因子活化B细胞的Κ轻链增强子(nuclear factor-Κ-gene binding,NF-kB)靶向PTEN增加非小细胞肺癌的侵袭性[18]。本研究结果显示,恶性脑胶质瘤细胞经X线照射后,PTEN mRNA和蛋白表达量显著升高,呈现出照射剂量依赖性。因PTEN是肿瘤抑制基因,在癌细胞内的表达量较低;而恶性脑胶质瘤细胞经X线照射后细胞活力明显降低,肿瘤细胞受到刺激后可能促使PTEN表达量明显升高,进一步发挥肿瘤抑制作用。过表达PTEN的T98G细胞经X线照射后,其活力明显下降、细胞侵袭数减少及细胞凋亡率增高;而用siRNA技术下调PTEN表达的T98G细胞行X线照射后,细胞活力明显上升、细胞侵袭数增多及细胞凋亡率减低。结果表明,过表达PTEN能够增强T98G细胞的放射敏感性,而下调PTEN能够降低细胞的放射敏感性。
Alzahrani研究证实,PTEN失活能够激活PI3K-AKT信号通路;而活化的PI3K-AKT信号通路参与了细胞增殖、细胞凋亡、调控内皮生长和血管生成等生物学进程[19]。如Yoon等研究发现,红皮莲干果中的甲基lucidone通过抑制PI3K/AKT通路,引起卵巢癌细胞G2/M期阻滞和凋亡[20]。还有研究报道,非瑟酮通过调控PI3K/AKT/mTOR通路发挥对乳腺癌细胞的抗癌作用[21]。本研究显示,敲低恶性脑胶质瘤细胞的PTEN表达并行X线照射后,激活了细胞的PI3K-AKT-GSK3β信号通路,而且该信号通路介导了敲低PTEN对恶性脑胶质瘤放射敏感性的影响。结果表明,沉默PTEN能够通过激活PI3K-AKT-GSK3β信号通路影响恶性脑胶质瘤细胞的放射敏感性。有研究报道,肿瘤组织和细胞内含有高水平的活性氧(reactive oxygen species,ROS),有利于维持肿瘤细胞的恶性表型;而敲低PTEN表达后,降低了ROS对AKT通路的阻断,而使PKB/AKT通路保持一个高活化状态,抵抗ROS诱导的细胞凋亡,进一步使肿瘤细胞的放射敏感性降低[22]。本研究的结果与其一致,表明在恶性脑胶质瘤细胞中,PTEN也是通过PI3K-AKT-GSK3β通路影响肿瘤细胞的放射敏感性;推测其作用机制也可能与细胞的ROS水平有关,但具体机制还需要进一步深入研究。
综上所述,PTEN在恶性脑胶质瘤中起抑癌作用,沉默PTEN能够通过激活PI3K-AKT-GSK3β信号通路影响恶性脑胶质瘤细胞的放射敏感性。本研究结果表明,PTEN/PI3K-AKT-GSK3β轴可能成为增强恶性脑胶质瘤患者放射敏感性的重要靶点。
