鞣花酸分子印迹聚合物的合成及其性能研究
2021-07-14邹佳美平欲晖吴丽芳双若男毛娟玲谢一辉
邹佳美, 平欲晖, 吴丽芳, 双若男, 毛娟玲, 谢一辉
(江西中医药大学药学院,江西南昌 330004)
多酚类物质是一类具有多酚结构并具有抗氧化[1]、抑菌[2]、抑制酶活性[3]、抗癌[4]、抗病毒[5]和降血脂[6]等功效的化合物。鞣花酸(Ellagic Acid,EA)是一种天然多酚组分,是没食子酸的二聚体形式,是一种多酚二内酯,存在于许多软性水果、坚果和其他植物组织中,如石榴[7,8]、草莓[9,10]、核桃[11,12]。EA具有抗氧化、抗凝血、抗菌抗病毒、抑制致癌剂的代谢活性[13 - 15],主要应用于药品、化妆品以及保健品的添加剂[14]。传统的从植物粗提物中纯化EA的方法有重结晶法和液-液萃取法,这些方法虽然低成本、易操作,但繁琐、低效,并伴随着大量有机溶剂的消耗,难以得到技术上的推广。
分子印迹技术(Molecularly Imprinting Technology,MIT)是以特定的目标化合物为模板分子,制备对该目标化合物及其结构类似物具有选择性识别能力的聚合物技术。它具有分离效率高、化学物理性质稳定、制备简单等优点。目前,分子印迹技术广泛应用于环境中微量物质的分析[15]、药物分析[16]等的研究中,在离子液体[17]、荧光探针技术[18]、电化学传感[19]也有应用。另外,分子印迹技术目前在天然产物的提取分离研究中也有一定的应用。目前,以EA为模板分子的印迹聚合物(MIPs)用于多酚类成分的富集研究尚未见报道。本文采用沉淀聚合法合成EA-MIPS,并对其结构和性能进行表征,有望为天然药物化学成分多酚的高选择性分离、富集、纯化提供一种新的途径。
1 实验部分
1.1 仪器与试剂
UV-2550紫外-可见分光光度计,日本Shimadzu公司;5700型红外光谱仪,美国Nicolet公司;TriStar3000全自动比表面积及孔隙度测定仪,美国麦克公司;Quanta 250型扫描电子显微镜,美国FEI公司;CHY-2型恒温振荡器,江苏金坛富华仪器有限公司;SK-500B型超声波清洗器,昆山市超声仪器有限公司;HH-HS型恒温水浴锅,上海南阳仪器公司;GT10-1型高速台式离心机,北京时代北利离心机有限公司。
鞣花酸(EA)(批号:BCTG -0302,纯度98%)、槲皮素(QUE)(批号:BCTG-0238,纯度98%)、没食子酸(GA)(批号:BCTG-0177,纯度98%),均购自江西本草天工科技有限责任公司;丙烯酰胺(AM),上海山浦化工有限公司;4-乙烯基吡啶(4-VP)、乙二醇二甲基丙烯酸酯(EDMA)、偶氮二异丁腈(AIBN)、甲醇、二甲基亚砜、乙酸,西陇科学股份有限公司。
1.2 实验步骤
1.2.1 鞣花酸分子印迹微聚合物的制备采用沉淀聚合法制备MIPs。将模板分子(EA)和功能单体(AM、4-VP)溶解在装有致孔剂的圆底烧瓶中,密封,常温振荡1 h预聚合。再加入交联剂(EDMA)及0.03 g引发剂(AIBN),通氮气后密封,放置于水浴锅中聚合24 h,得到聚合物。待反应完成后,加入甲醇-乙酸溶液(8∶2,V/V)超声30 min,然后在离心机中5 000 r/min离心,反复几次,直到上清液中紫外检测不出模板分子。然后用甲醇洗至中性,得到MIPS,最后于60 ℃烘干。非分子印迹聚合物(Nonimprinted Polymers,NIPS)除不加入模板分子外,其余步骤同上。
1.2.2 印迹聚合物制备条件的选择MIPs制备以功能单体的用量(A)、交联剂用量(B)、溶剂用量(C)和温度(D)4个因素进行正交试验,各因素分别取3个水平,以静态吸附容量(Q)作为考察指标,研究上述因素对MIPs的性能影响,其因素水平见表1。

表1 因素水平表
1.2.3 静态吸附实验称取一系列质量为25 mg的MIPs和NIPS,置于10 mL的离心管中,分别加入浓度为10、20、40、60、80、100 μg/mL的EA标准溶液5 mL,恒温吸附至饱和,离心,取上清溶液适当稀释后,用紫外分光光度计测定吸光度,计算聚合物对底物的吸附容量(Q)。再根据Q值与初始浓度c0绘制等温吸附曲线。Q=(c0-cs)·V/m,式中Q为静态平衡吸附容量(μmol/g),c0为模板分子始浓度(μmol/L),cs为吸附平衡时浓度(μmol/L),V为底物溶液的体积(mL),m为聚合物的使用量(mg)[1]。
1.2.4 动态吸附实验准确称取MIPS和NIPS各6份,每份25 mg,置于10 mL的离心管中,然后再加入5 mL 60 μg/mL的EA标准溶液并混合均匀,室温下分别振荡1 h、2 h、4 h、6 h、8 h后,离心,取上清液适当稀释后,用紫外分光光度计分别测定每组样品的吸光度。根据上述方法计算出聚合物对底物的Q值,绘制吸附动力学曲线,确定吸附饱和时间。
1.2.5 选择性能评价实验准确称取MIPS25 mg,分别加入20 μg/mL的EA、GA、QUE标准溶液各5 mL,于室温下振荡6 h。按照上述方法计算MIPs对底物的结合量,分别求出聚合物静态分配系数(K)和分离因子(α)[20],研究MIPs对不同底物的特异吸附能力。其中,K=ca/cs,α=Ki/Kj,式中ca为结合底物的浓度,cs为吸附平衡时底物在溶液中的浓度,i为模板分子,j为底物分子;规定若j=i,α=1;若α<1,表明MIPS对其模板分子没有选择性;若α>1,则表明MIPS对模板分子具有一定的选择性。
2 结果与讨论
2.1 功能单体的选择
通常,酸性的模板分子适合碱性的功能单体,碱性的模板分子则适合酸性的功能单体。由于EA是多酚类化合物,具有一定的酸性,从理论而言碱性的功能单体有利于功能单体形成稳定的主客复合物。本实验取4-VP和AM两种功能单体,分别合成得到EA-MIPs,通过对EA不同质量浓度(20、40、60 μg/mL)溶液的静态吸附试验,计算吸附EA的浓度。得到功能单体对EA-MIPs性能的影响,如图1所示。由图可知,以4-VP为功能单体形成的MIPs的吸附容量显著高于AM,故选择4-VP作为功能单体。
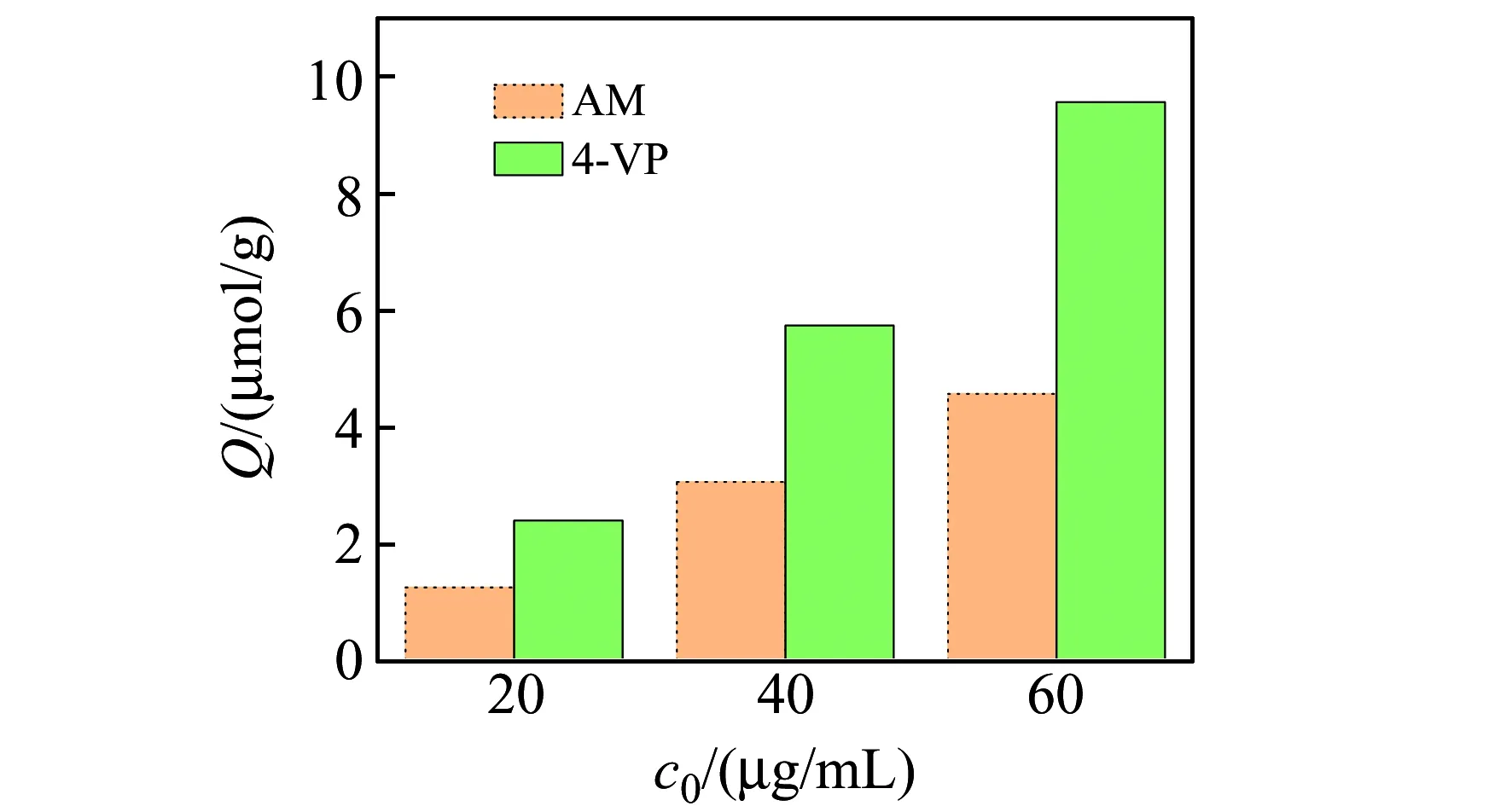
图1 功能单体对印迹聚合物的影响Fig.1 Effect of functional monomers on imprinted polymers
2.2 正交试验结果
为了得到吸附效果较好的EA-MIPs,经单因素优化和相关参考文献,确定模板分子和功能单体的摩尔比为1∶2~1∶6,模板分子与交联剂的摩尔比为1∶10~1∶30,反应溶剂的用量为50~60 mL(1 mmol EA),温度为60~70 ℃,AIBN为30 mg。并进行4因素3水平的正交试验,以静态吸附容量作为考察指标,优化聚合物的合成条件。正交试验结果见表2。由表可知,聚合反应的最佳条件是A3B1C3D2,即n(EA∶4-VP∶EDMA)=1∶6∶10,溶剂用量为70 mL,聚合温度为65 ℃。由R值可知A的影响最大,其次是B、D、C。
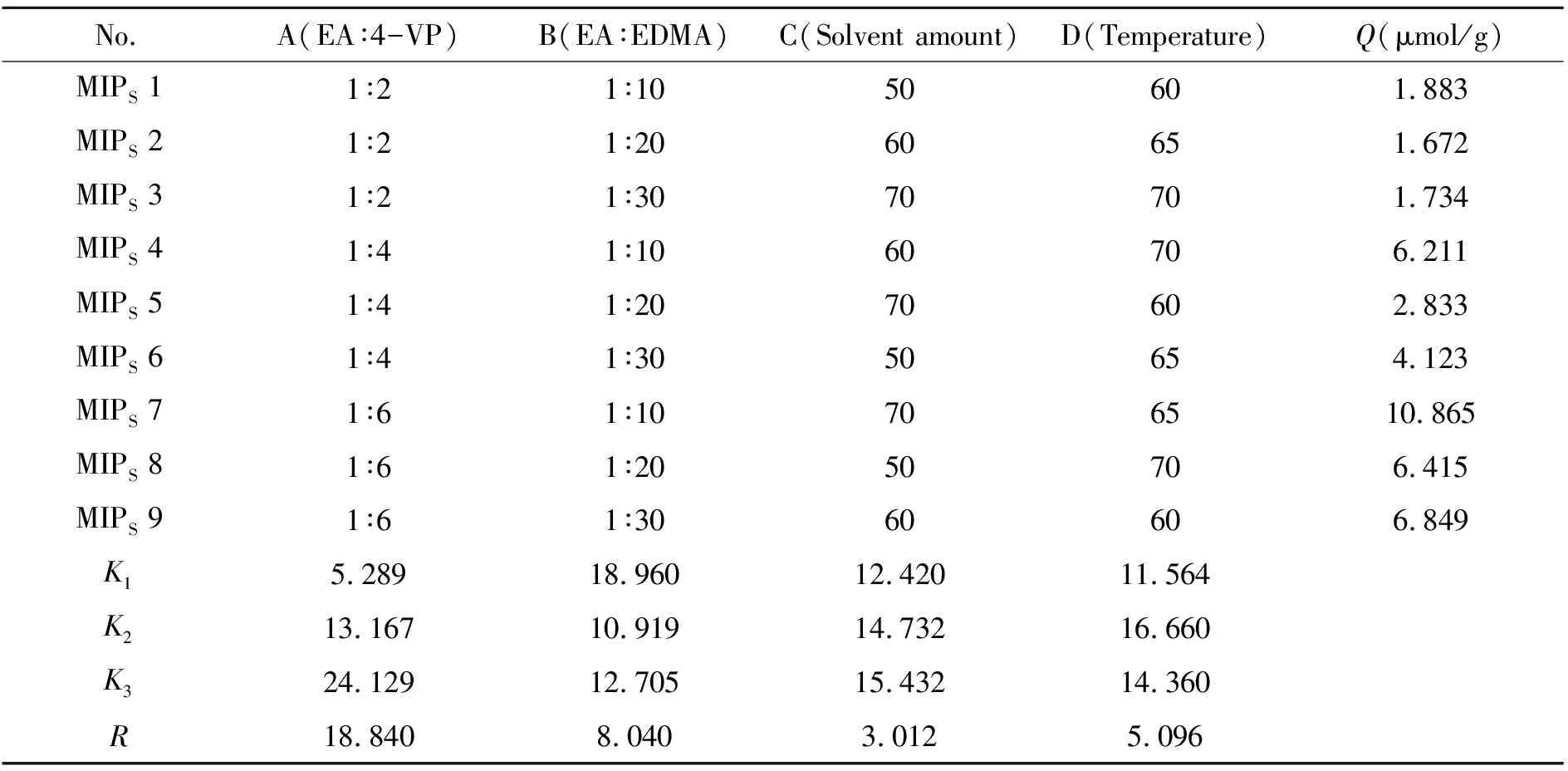
表2 正交试验结果
2.3 比表面积测定和扫描电镜结果分析
根据不同的扫描电镜图谱(图2)和比表面积测试结果(表3)可知,MIPS1、MIPS9的粘连很严重,而且粒径较大,比表面积较小;MIPS2、MIPS3、MIPS4的大小很不均一;MIPS5粘连严重,球形不规则,比表面积小;MIPS6发生团聚,分散性较差;总体来说,MIPS7、MIPS8微球光滑均匀,球形度较好,且比表面积大,吸附能力强。

表3 比表面积测试结果

图2 不同MIPS的扫描电镜图Fig.2 Scan electron microscopic images of different MIPS
2.4 鞣花酸印迹聚合物的表征
将真空干燥后聚合物用扫描电镜和傅里叶红外(IR)光谱表征。由扫描电镜结果可知,MIPS7微球形态最好,故对模板分子、MIPS7进行红外光谱分析,见图3。由于EDMA具有α,β不饱和酯结构,其C=O的伸缩振动峰应该在1 715~1 730 cm-1,从红外光谱图可以看出,MIPS的IR图中吸收峰为1 735 cm-1,为饱和酯的C=O的伸缩振动峰,表明聚合成功。MIPS的IR图与EA的IR图比较,前者少了EA中的3组特征峰,芳环内酯C=O特征双峰1 735 cm-1、1 700 cm-1,共轭苯环特征峰1 600 cm-1、1 580 cm-1、1 500 cm-1及指纹区的C-H的面外弯曲振动峰750 cm-1,说明模板分子已洗脱。
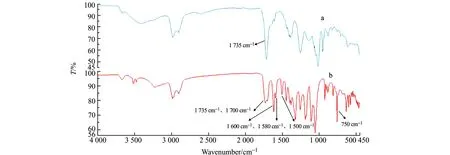
图3 MIPS(a)和EA(b)的红外光谱图Fig.3 Infrared spectrograms of MIPS(a) and EA(b)
2.5 静态试验吸附结果和Scatchard分析
由正交试验结果可知MIPS7有较好的吸附性能,故用MIPS7来进行等温吸附实验。从图4可知聚合物对底物的Q随EA浓度的增大而增大,且在高浓度范围内,吸附达到饱和状态。同时,不同浓度条件下MIPS的Q均大于对应的NIPS。这是因模板分子经过洗脱后在聚合物的空间和结构上留下“印迹空穴”,当与模板分子相似的结构进入“空穴”后会产生特异性结合。而空白印迹聚合物为不含有与模板分子结构相似的“空穴”。为了更直观准确地评价MIPS的吸附性能,对EA与目标分子的结合采用Scatchard方程[21]来反映,Scatchard方程为:Q/cEA=(Qmax-Q)/Kd,Q为吸附容量,μmol/g;Kd是结合位点平衡离解常数;Qmax是结合位点最大吸附容量,μmol/g;cEA是底物在上清液中的平衡质量浓度,μmol/L;所得方程分别为:y1=0.01072x+0.1192,聚合物结合位点的平衡常数Kd=93.26 μmol/mL,最大表观结合量Qmax=11.11 μmol/g;y2=-0.4713x+5.2802,聚合物结合位点的平衡常数Kd=2.12 μmol/mL,最大表观结合量Qmax=11.19 μmol/g。由图5可知有两条较好的线性关系的直线,可能是由于EA和目标分子之间以不同的配比进行组合,形成了两种性质不同的空穴。
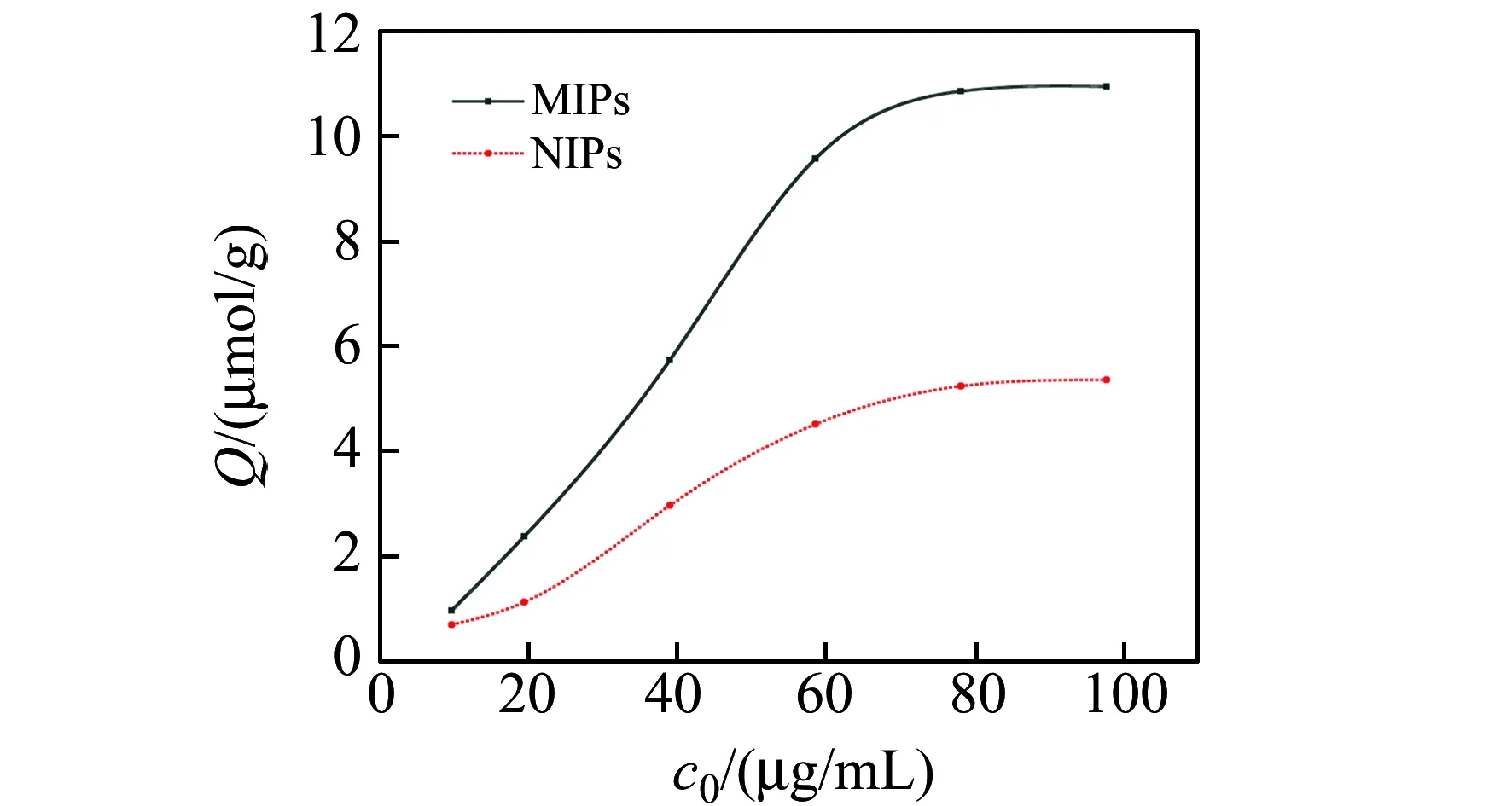
图4 MIPS和NIPS等温吸附曲线Fig.4 Isothermals adsorption curve of MIPS and NIPS
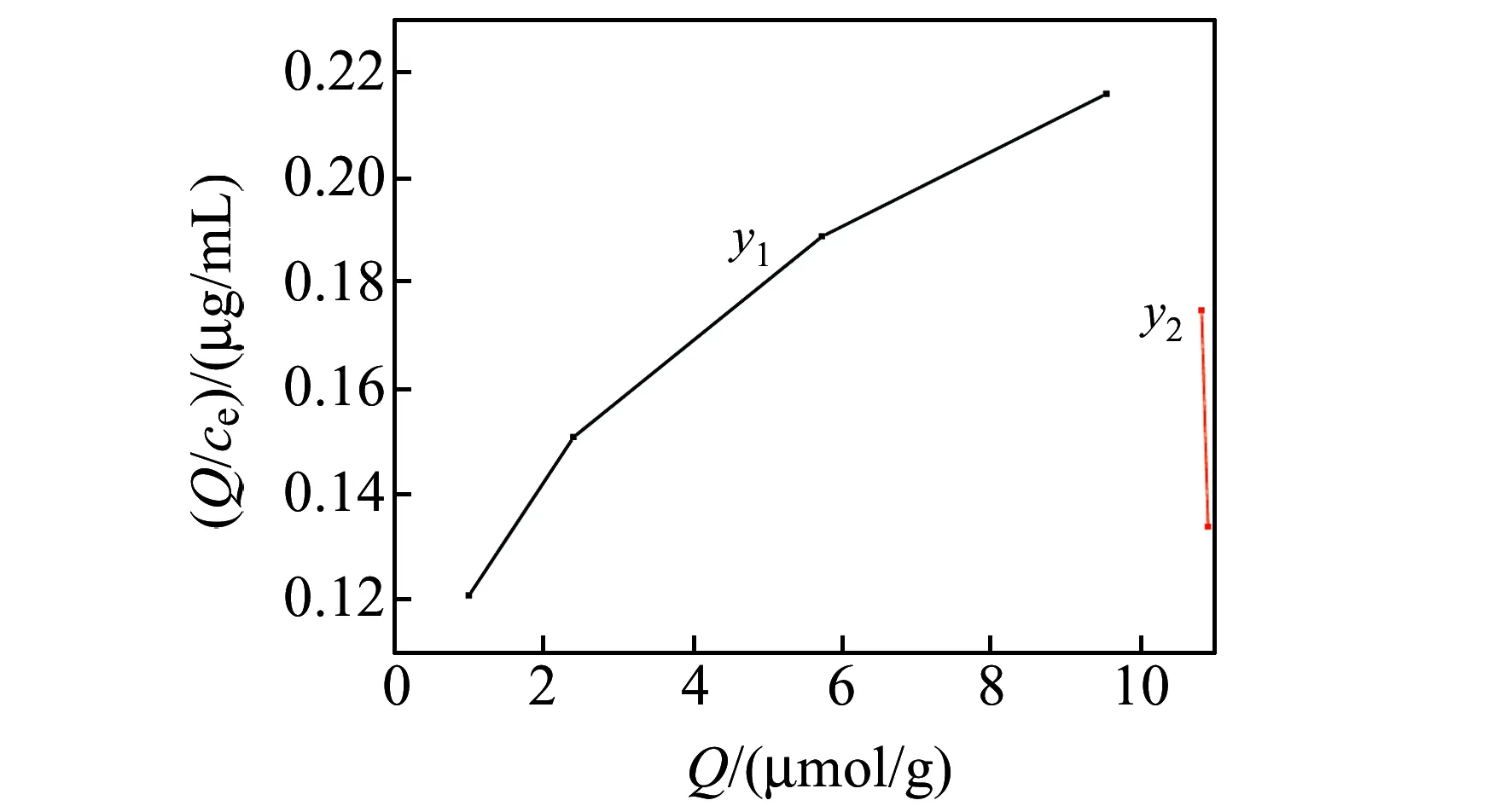
图5 MIPS的Scatchard方程Fig.5 Scatchard equation for MIPS
2.6 动态吸附性能研究
EA动态吸附结果如图6,MIPS7和NIPS7前6 h内,随着时间的延长,Q都逐渐增大且MIPS7的Q要高于NIPS7。当振摇6 h后,随着时间的增加,Q变化不大,故在6 h时EA MIPS达到吸附饱和。

图6 MIPs和NIPS的动力吸附曲线Fig.6 Kinetic adsorption curves of MIPs and NIPS
2.7 选择性识别性能
为考察EA-MIPS的选择性识别能力,选择没食子酸、槲皮素作为干扰物进行选择性吸附试验。MIPS7具有较好的吸附性能,因此本实验考察MIPS7对各底物分子的选择性。结果如表4所示,MIPS7对EA的分配系数明显高于GA和QUE,且分离因子α>1,表明MIPS对EA的吸附具有选择性。
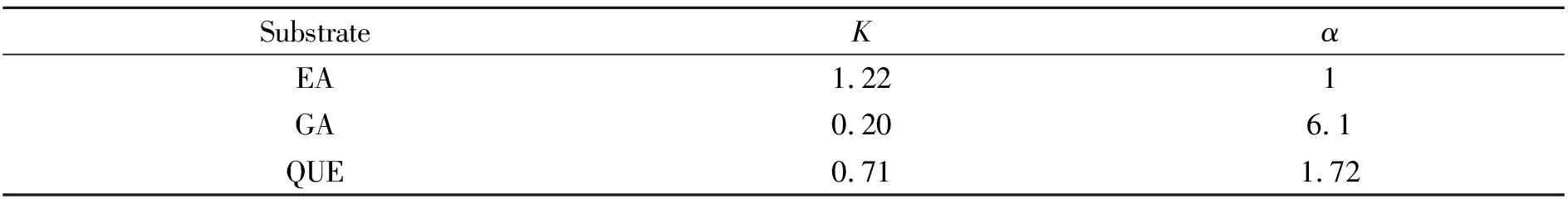
表4 MIPS对各底物的识别性能
3 结论
采用沉淀聚合法确定鞣花酸(EA)分子印迹聚合物制备适宜条件如下:70 mL二甲基亚砜溶液(1 mmol EA)为致孔剂,4-VP为功能单体,65 ℃恒温水浴法搅拌。在n(EA∶4-VP∶EDMA)=1∶6∶10时,合成的聚合物在6 h时达到最大吸附容量,为10.865 μmol/g,分离因子α均超过1,表明MIPS对鞣花酸的吸附有特异性。方法可选择性识别EA,为EA及酚酸类成分分离富集提供参考。
