碳点联合适配体构建荧光“关-开”癌胚抗原探针
2021-07-14张益霞
张益霞, 樊 璐, 赵 鑫, 董 川
(1.太原理工大学生物医学工程学院,山西太原 030024;2.山西大学环境科学研究所,山西太原 030006)
癌症是仅次于心血管疾病的第二大致死疾病[1,2]。前5位癌症发病率中肺癌的发病率和死亡率都位于首位,临床确诊肺癌主要手段是胸部CT和组织病理,但由于检测设备分辨率和技术所限,较难观察到位置隐蔽的深部癌变组织,且活检取样点随机,易造成肿瘤漏诊。因此,急需开发一种无创、快速、灵敏且能够在早期预警和诊断肺癌的方法。癌胚抗原(Carcinoembryonic Antigen,CEA)是一类广谱性癌症标志物,属于细胞表面糖蛋白家族,分子量为180~200 kDa,于1965年首次在人结肠癌组织中发现[3,4]。在健康成人体内CEA水平通常为0~5 ng/mL左右,当人体组织出现癌变后,血液中CEA含量开始升高,一般高于20 ng/mL。研究表明不同类型癌症患者,血液CEA检测阳性率均达到了显著水平[5,6]。同时,CEA还可与其他肿瘤标志物联合检测,作为癌症诊断依据,提高对肿瘤的确诊正确率[7]。除此之外,血清CEA水平对肿瘤复发的敏感性达80%以上,早于临床和病理检查[8]。因此,血清CEA水平被临床用于癌症患者术后疗效的追踪。可见,血液中的CEA水平可以用于癌症的预警、诊断以及疗效监测。
目前,CEA的检测方法主要包括酶联免疫分析和电化学方法,灵敏度高,准确性好。然而免疫方法成本高,抗体合成易受环境因素影响。电化学传感器方法存在电极修饰程序复杂,易受假阳性影响等不足。基于荧光碳点(CDs)的荧光“开-关”效应,构建CEA检测方法简便,成本低,无需大型检测设备,在荧光探针的构建方面表现出巨大潜力。荧光CDs是一种至少在一维空间内,尺寸小于10 nm,能稳定发光的纳米碳点,是目前最热门的碳纳米材料之一[9]。与传统的有机荧光染料相比,CDs具有优异的生物相容性,化学及光稳定性且绿色环保性等诸多优点[10,11]。本文采用水热法,制备单分散荧光CDs。利用紫外-可见光谱、荧光光谱、纳米粒径分析和红外光谱,对所制备的CDs结构形貌、表面电荷、水化半径、荧光特性、表面基团等特性进行了分析。CDs表面存在π电子云,与适配体(Aptamers,Apts)之间由于π→π* 堆积作用相互吸附,从而猝灭CDs的荧光。当体系中出现CEA时,将适配体竞争性从CDs表面解脱附,体系的荧光得到恢复。本文基于此原理,构建一种荧光“关-开”探针体系,用于CEA快速分析。
1 实验部分
1.1 仪器及试剂
UV-4802紫外-可见分光光度计(上海龙尼柯仪器有限公司);Nicolet iS5傅立叶变换红外光谱仪(美国,赛默飞科技有限公司);FLS 980-STM稳态/瞬态荧光光谱仪(爱丁堡仪器有限公司);NICOMP 380系列纳米粒径与电位分析仪(上海奥法美嘉生物科技有限公司)。
柠檬酸,癌胚抗原(CEA),聚乙烯亚胺(Polyethyleneimine,PEI),5-ATACCAGCTTATTCAATT-3癌胚抗原适配体(CEA-Apts),均购于上海生工生物工程公司。实验用水为超纯水。
1.2 实验方法
1.2.1 CDs制备与表征依据文献方法[12],以柠檬酸和聚乙烯亚胺为前驱体,高温热解法制备CDs。称取0.2 g柠檬酸和0.36 g PEI于洁净的烧杯中,加入15 mL超纯水,超声分散30 min。将溶液转移至反应釜中,置于马弗炉中200 ℃反应5 h。取出,室温下自然冷却,得到CDs初始溶液,接着将该溶液在10 000 r/min转速下,离心30 min,收集上清液,过夜透析处理,得到提纯后的CDs溶液,4 ℃ 保存,备用。对纯化后CDs原溶液进行梯度稀释,采用紫外-可见分光光度计和荧光光谱仪,在200~800 nm波长范围内,对CDs溶液紫外和荧光特性进行分析。通过检测荧光强度,获得最佳CDs浓度。Zeta电位分析仪对CDs的水化粒径和表面电位进行表征。红外光谱对CDs表面基团进行分析,扫描波长范围为400~4 000 cm-1。
1.2.2 构建CDs-Apts荧光“关-开”探针体系适配体为一条含有18个碱基的DNA单链,由于链内碱基随机配对,适配体在溶液中出现局部茎环结构,不利于其与CDs结合,进而影响探针体系的检测灵敏度。实验将适配体溶液加热至100 ℃维持10 s,以打开链内配对碱基,同时添加适量TCIP,阻止链内S-S的形成,保持适配体的单链性。不同浓度适配体与10 μg/mL CDs溶液充分混匀,孵育30 min。对体系的荧光强度进行分析,选择最佳适配体浓度。在此基础上,选取3个不同浓度的CDs溶液。将50 μmol/L的适配体分别加入不同浓度的CDs溶液中,充分混匀,得到CDs-Apts溶液,进行紫外-可见和荧光特性分析,选取最佳配比CDs-Apts溶液体系。
2 结果与讨论
2.1 CDs和Apts构建荧光“关-开”探针的机理
CDs的荧光性能稳定,其表面具备高密度π电子云,能够吸收激发光能量,进而产生电子跃迁,发射较强荧光,被广泛用于生物分子的定量检测[13,14]。适配体加入CDs溶液时,由于π-π堆积作用,适配体被吸附在CDs的表面,从而猝灭了CDs的荧光[15,16]。当待检测目标CEA加入体系中,由于CEA和适配体之间天然的生物高特异性识别和亲和力,这种作用远大于π-π堆积作用,从而将适配体从CDs表面竞争性解吸附,进而CDs荧光得到恢复。本文基于荧光“关-开”效应,构建CEA探针体系,其原理如图1所示。

图1 CDs-Apts“关-开”体系检测CEA的原理图Fig.1 Schematic diagram of CDs-Apts "off-on" system for detecting CEA
2.2 CDs荧光和紫外-可见光谱特性
从图2(a)可见,CDs荧光光谱为双峰形式,不随激发波长变化而移动的为荧光峰,随激发波长变化发生移动的为倍频峰,倍频峰发射波长是激发波长的二倍,是由光的散射造成的。本文基于CDs荧光峰(410~485 nm)进行CEA检测探针体系构建。荧光光谱测试结果显示随着激发波长从200 nm增加到300 nm,CDs荧光先增强后减弱,当激发光波长为245 nm时,CDs溶液在445 nm处出现最强荧光发射峰。紫外-可见光谱分析结果见图2(b),CDs溶液在200~230 nm处存在吸收带,是由于C=C共轭体系的π→π* 跃迁所产生[17],350 nm处的吸收峰是由于羧基等不饱和体系的n→π*跃迁所产生[18]。同时,图2(b)内插图显示CDs溶液在可见光下呈亮黄色,而在紫外光照射下为明亮的蓝光,这与445 nm处发射光谱相一致。

图2 (a)200~300 nm激发下CDs溶液荧光光谱:(b)CDs溶液紫外-可见光谱(插图为可见光和紫外光下CDs溶液照片)Fig.2 (a) Fluorescence spectrum of CDs solution excited by 200-300 nm;(b) UV-Vis spectrum of CDs(The insets shows the pictures of CDs solution under visible and UV light)
2.3 CDs的Zeta电位和FTIR分析
对CDs溶液进行Zeta电位测试和FTIR光谱分析,结果如图3所示。Zeta电位分析结果见图3(a),表面电位为-9.96 mV,较窄单峰峰形且呈现正态分布,表明CDs在溶液中分散性良好。红外光谱分析结果如图3(b)所示。位于1 370~1 460 cm-1的吸收峰是-COO-的特征峰[19],在1 564 cm-1和1 120 cm-1处的尖峰是由于-NH的弯曲振动和C-NH-C的不对称伸缩振动[20],2 810~2 940 cm-1范围出现的弱吸收峰是由于C-H的伸缩振动,3 274 cm-1是O-H伸缩振动吸收峰[21]。以上结果表明所制备的CDs表面有-COO-、-NH2、-OH等亲水性基团,在溶液中有良好的分散性。
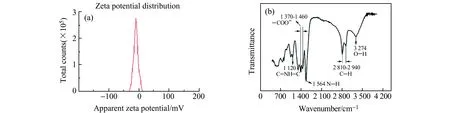
图3 (a)CDs的Zeta电位;(b)CDs的红外(IR)光谱Fig.3 (a) Zeta potential;(b) IR spectrum of CDs
2.4 CDs浓度优化
为了获得CDs溶液最佳浓度,实验通过三个不同浓度CDs溶液(1、5、10 μg/mL)与50 μmol/L适配体共孵育,依据孵育前后溶液荧光猝灭与恢复程度作为判断标准,确立最佳CDs用量。图4(a)显示,当CDs浓度为1 μg/mL时,结合适配体前后CDs溶液在紫外灯照射下,裸眼几乎辨别不到溶液荧光强度变化。当CDs浓度依次增加到5 μg/mL、10 μg/mL时,观察到CDs溶液的荧光发生了明显猝灭。同时,10 μg/mL CDs溶液与适配体结合前后,体系的荧光猝灭程度最明显。进一步利用荧光光谱,分析结合适配体前后的CDs荧光强度的改变量(图4(b)),可见当CDs浓度为10 μg/mL时,适配体结合前后体系荧光强度改变幅度最大,分别是1 μg/mL、5 μg/mL CDs荧光强度变化量的7倍和3倍。因此,本文选取10 μg/mL CDs溶液,用于构建CEA荧光“关-开”探针体系。
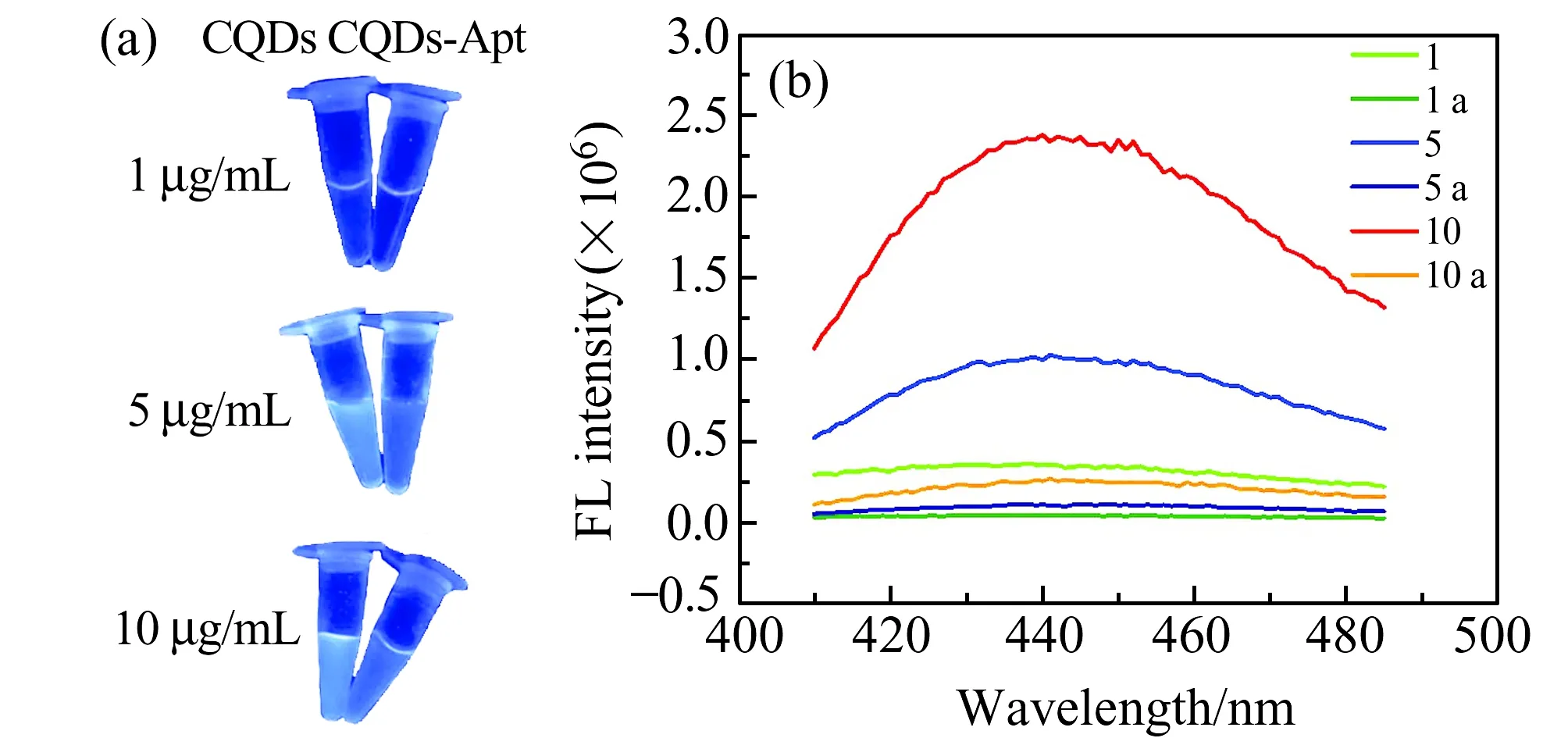
图4 不同浓度CDs(1、5、10 μg/mL)结合Apts前后:(a)紫外光照射下溶液照片;(b)溶液荧光光谱Fig.4 Different solutions of CDs and CDs-Apts:(a) Pictures of UV irradiation;(b) Fluorescence spectrum
2.5 适配体浓度的优化
适配体通过π-π堆积作用与CDs相互结合,形成CDs-适配体复合物,导致CDs溶液的荧光被猝灭。当体系中适配体与CDs达到最佳结合比时,溶液的荧光强度猝灭程度达到最大,有助于提高检测体系的灵敏度和线性范围。为了确定体系中CDs与适配体之间最佳比,不同浓度适配体(0~50μmol/L)加入到10 μg/mL 的CDs溶液中,共孵育,如图5所示。不同比例CDs-适配体混合溶液,在紫外灯照射下随着适配体浓度增加,可见CDs-适配体溶液荧光强度逐渐减弱,当适配体浓度达到50 μmol/L时,CDs-适配体体系的荧光强度被大幅度猝灭。同时,采用稳态/瞬态荧光光谱仪,对CDs-适配体体系的荧光强度变化进行定量分析(图5)。分析结果证明当适配体浓度为10 μmol/L时,CDs-适配体溶液体系的荧光猝灭程度为25%,而当适配体浓度为50 μmol/L时,CDs-适配体溶液体系的荧光猝灭程度高达90%左右,是10 μmol/L CDs-适配体体系的4~10倍。因此,本实验选取50 μmol/L的适配体,用于荧光“开-关”探针体系的构建。
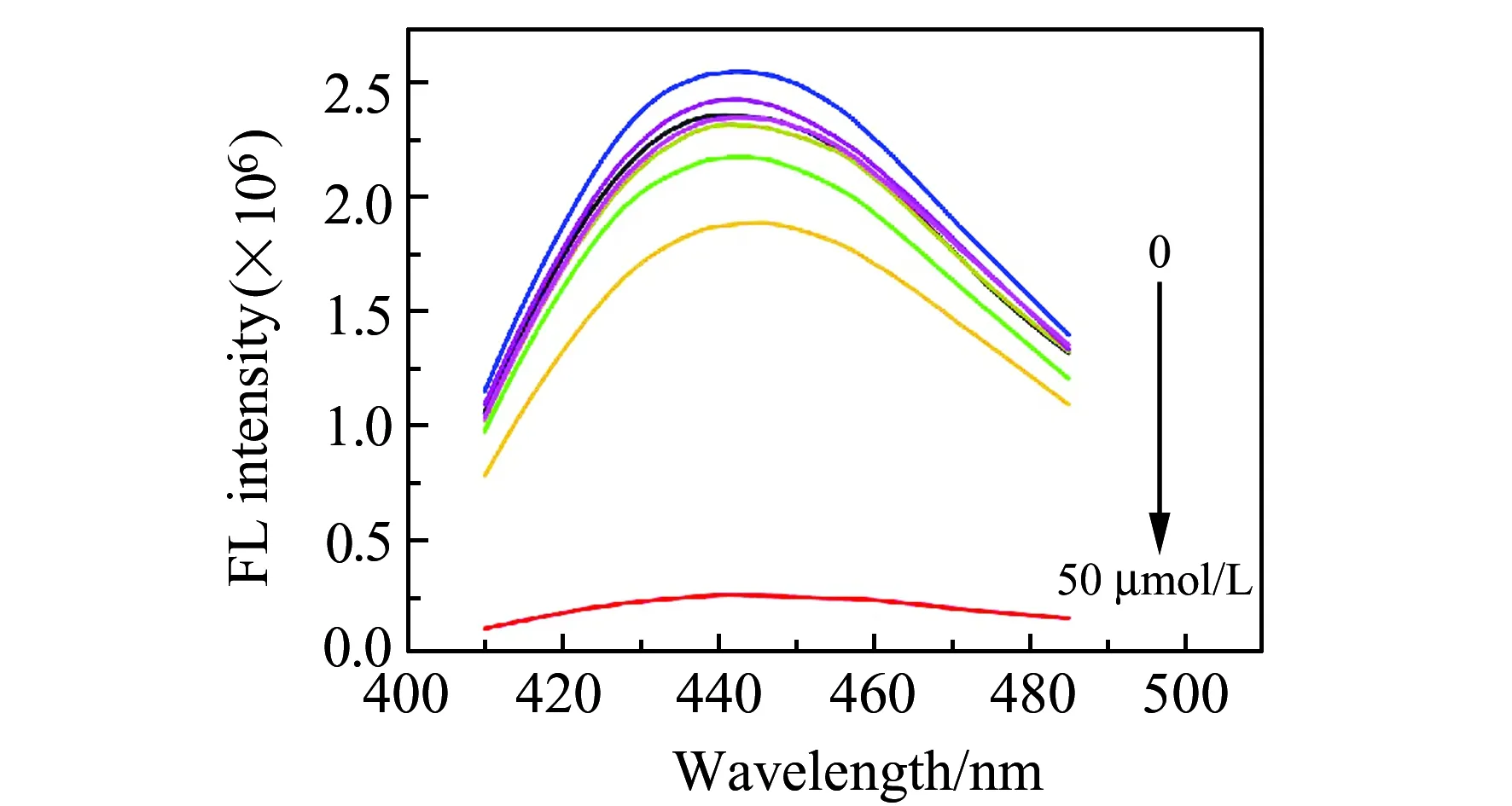
图5 不同浓度适配体的CDs-Apts体系荧光光谱Fig.5 Fluorescence spectra of different concentrations of CDs-Apts system
2.6 检测CEA
将CEA加入到检测体系中,由于适配体与CEA之间高亲和力和特异性结合,将适配体从CDs表面解离,使得溶液荧光得到恢复。在最优实验条件下,探针体系对1 ng/mL、10 ng/mL、100 ng/mL、500 ng/mL、1 μg/mL、100 μg/mL、500 μg/mL CEA的响应,如图6所示。随着CEA浓度的增加,CDs-适配体体系的荧光逐渐恢复(图6)。445 nm处的荧光强度与CEA浓度的对数呈现线性相关性,线性响应范围为1 ng/mL~500 μg/mL。线性方程:F/F0=0.05823×logcCEA+1.25,相关系数R2=0.9260,表明线性度良好。本文所构建的荧光“关-开”探针体系,响应速度低于25 min。与文献报道[21 - 23]的其他方法相比,本文构建的检测方法简便,成本低,耗时短,线性响应范围宽。
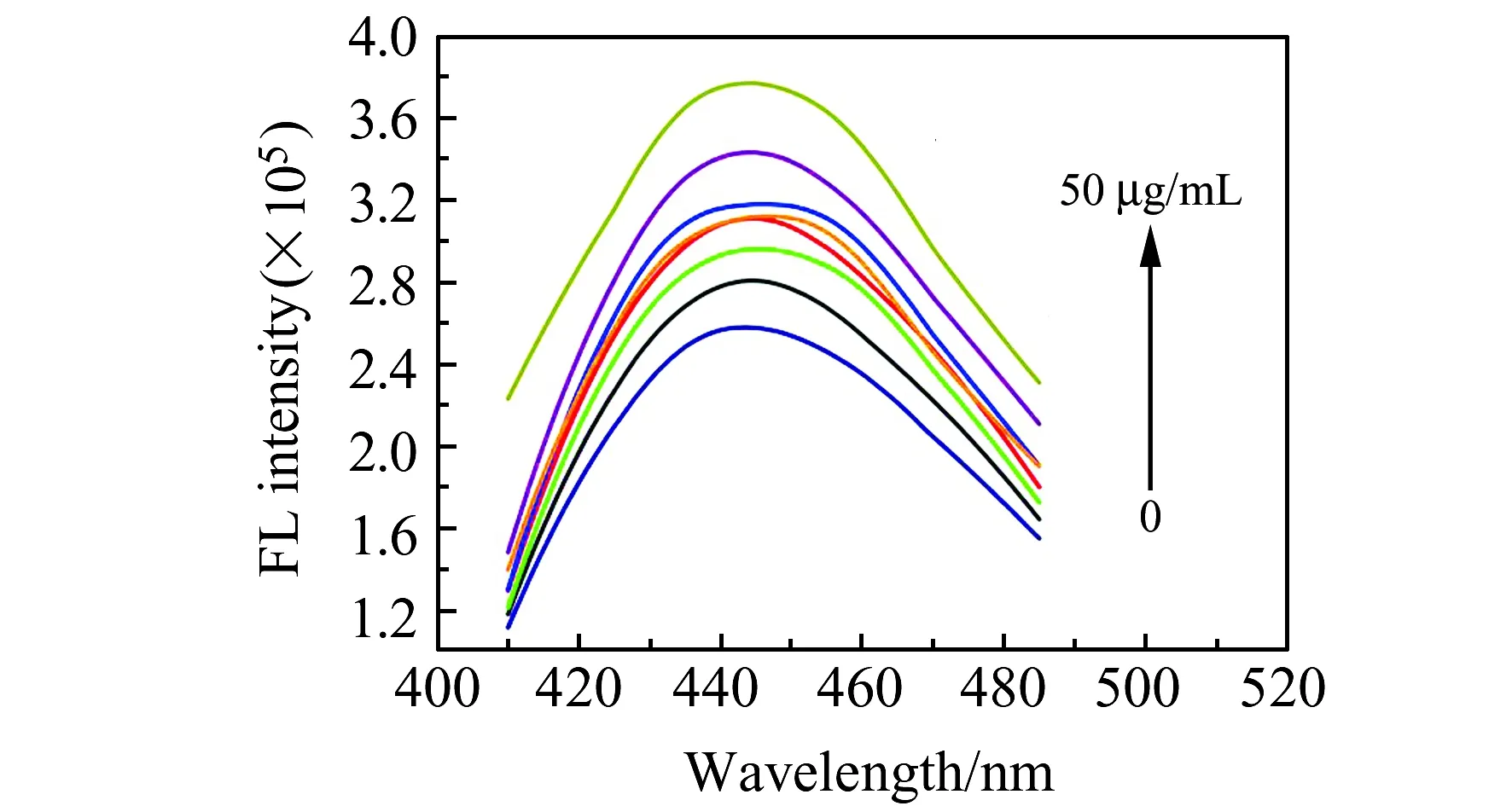
图6 不同浓度CEA条件下CDs探针体系的荧光光谱Fig.6 Fluorescence spectra of CDs probe system with different concentrations of CEA
2.7 探针体系的特异性和稳定性
实验采用BSA、HAS、AFP作为干扰物质,评价探针体系的特异性。结果表明上述干扰物质浓度为10倍CEA浓度时,对CDs-适配体荧光探针体系的荧光强度几乎没有影响。而当CEA加入时,体系的荧光强度恢复到初始值90%以上,证明该体系对CEA具有良好选择性和抗干扰性,同时说明适配体与CEA之间高特异性和亲和力。对同一浓度CEA连续测量了8次,考察探针体系对CEA检测的稳定性。8次连续测量的荧光强度回复程度基本相等,相对标准偏差(RSD)为5.39%,表明CDs-适配体荧光探针体系有较好的稳定性。
3 结论
基于适配体可有效猝灭CDs溶液的荧光,据此构建高灵敏度荧光“关-开”探针体系,当体系中添加CEA后,CDs的荧光得到恢复,用于CEA快速检测,检测时间小于25 min。该方法具有良好的线性范围和低的检测限,对CEA响应快,特异性好,且检测过程简单易行,成本低,有望用于不同来源样本中CEA水平监测和分析。
