高稳定性荧光纳米SiO2的合成及其在磷脂巨型囊泡成像中的应用
2021-07-14张卫红魏露露刘菲菲李甜甜
张卫红*, 魏露露, 刘菲菲, 李甜甜
(咸阳师范学院化学与化工学院,陕西咸阳 712000)
荧光纳米颗粒在生物标记、细胞成像、免疫分析等领域里有着广泛的应用前景[1 - 3]。目前常用的荧光纳米颗粒有各种量子点[4 - 7]、纳米Ag2S[8]、纳米SiO2[9 - 11]、镧系金属[12]和荧光碳点[13]等。其中,荧光纳米SiO2由于性质稳定、无细胞毒性而受到广泛关注。荧光纳米SiO2制备可用反相微乳液法[14,15],但微乳液制备难度较大,后处理步骤也比较繁琐。而制备纳米SiO2最常用的Stöber法合成过程较为简单,如能对合成过程进行合理设计,亦可制备出粒径均匀的荧光纳米SiO2颗粒[16],该方法有望在荧光纳米SiO2的合成及应用领域发挥更大的作用。
磷脂巨型囊泡是尺寸在几微米至上百微米的一类具有封闭薄球壳结构、内包微水相的分子有序组合体[17],其壳层组成、结构及尺寸均类似于生物体中的细胞,是一种模拟细胞简单而理想的模型[18]。磷脂巨型囊泡与纳米颗粒的相互作用研究可以揭示生物矿化等生命现象,但两者尺寸相差巨大,而且磷脂巨型囊泡仅可在内外渗透压均衡的水溶液中稳定存在,用扫描电镜等传统检测手段很难观测到两者的相互作用过程。基于此,将具有荧光性能的纳米颗粒与磷脂巨型囊泡接触,并借助荧光显微镜观测两者的相互作用过程就显得尤为必要。本研究在Stöber法的基础上,通过接枝异硫氰酸荧光素(FITC)并改变反应溶剂种类的方式,合成了三种不同粒径的荧光纳米SiO2颗粒,对比分析了粒径大小对荧光强度以及抗光漂白能力的影响。在此基础上,通过简单混合的方法将荧光纳米颗粒与磷脂巨型囊泡相接触,通过荧光显微镜观察分析荧光纳米颗粒与磷脂巨型囊泡相对位置的变化,推测出两者的相互作用机理模型。
1 实验部分
1.1 仪器及试剂
激光粒度仪(Zetasizer Nano ZS3600,Malvern,英国);透射电镜(H-7650,Hitachi,日本);激光共聚焦显微镜(FV1200,Olympus,日本);荧光光谱仪(RF5301,Shimadzu,日本);倒置荧光显微镜(TE2000,Nikon,日本)。
异硫氰酸荧光素(FITC),90%,麦克林试剂有限公司;氨丙基三乙氧基硅烷(APTES)、无水乙醇、甲醇、异丙醇和三氯甲烷,均为分析纯,国药集团化学试剂有限公司;正硅酸乙酯(TEOS)和氨水(25%~28%),均为分析纯,天津科密欧化学试剂有限公司;L-α磷脂酰胆碱,99%,Sigma公司。
1.2 实验方法
1.2.1 FITC-APTES制备2 mg的FITC溶于2 mL无水乙醇中,再加入40 μL的APTES,室温下避光搅拌反应24 h,即得荧光前驱体FITC-APTES。
1.2.2 不同粒径荧光纳米SiO2合成在磁力搅拌下,向100 mL圆底烧瓶中依次加入甲醇30 mL、氨水2.0 mL和TEOS 1.0 mL,室温搅拌5 min后,向其中加入200 μL的FITC-APTES,遮光搅拌12 h;为有效保护荧光物质,得到纯净的SiO2表面,再向其中加入200 μL的TEOS,继续搅拌反应12 h;反应结束后,向溶液中加入50 mL纯水,用旋转蒸发仪除去氨及甲醇,实现溶液置换,然后在纯水中避光透析5 d除去游离的FITC分子,用纯水稀释至纳米颗粒浓度为2 mg/mL,备用。
在配方相同的情况下将溶剂由甲醇改为乙醇和异丙醇即可得到粒径依次增大的荧光纳米SiO2。
1.2.3 荧光纳米SiO2用于磷脂巨型囊泡成像磷脂巨型囊泡采用电形成法[19]制备,具体操作如下:取两块尺寸为6 cm×4 cm且表面镀有氧化铟锡(ITO)的玻板,各吸取2 mg/mL的L-α磷脂酰胆碱的三氯甲烷溶液25 μL滴于两块ITO玻板上,刮涂均匀,将其置于真空烘箱中室温抽真空2 h除去溶剂,取出后向涂有磷脂膜的一面左上角粘上一片2 cm长的导电铜胶带,再取外框尺寸为5 cm×3 cm、内框尺寸为4 cm×2 cm、厚度为2 mm的且对角边各有一个直径为1 mm微孔的聚四氟乙烯模板框,将其两面均涂上硅脂并置于两片ITO玻板之间压实,便组成了以ITO玻板为平行电极、以模板框所围体积(约2 mL)的磷脂囊泡电形成腔,通过模板框的微孔向系统中间注入水性溶液,并通过波函数发生器向平行电极施加一定的弱交变电场,培育一段时间即可得到尺寸在微米级的磷脂巨型囊泡群。
向磷脂囊泡溶液中加入定量的荧光纳米颗粒水溶液,室温培育一段时间后在荧光显微镜下观察两者的相互作用过程,判断荧光纳米颗粒的成像效果。
2 结果与讨论
2.1 荧光纳米颗粒合成机理及基本性能
改进Stöber法制备荧光SiO2的原理如图1所示。首先根据FITC分子上的异硫氰基可以和硅烷偶联剂APTES上的氨基进行反应的特点,将其共价偶联于硅烷分子上,得到FITC-APTES荧光前驱体;而后该前驱体通过与TEOS共水解从而将荧光基团接枝于纳米SiO2胶体网络中;最后通过再加入一部分TEOS进行水解,将含有FITC分子的纳米颗粒表面包裹起来,如此可以有效防止荧光泄漏和光漂白现象,延长荧光纳米颗粒的使用时间。

图1 FITC-APTES及荧光纳米SiO2合成示意图Fig.1 Schematic representation of the synthesis of FITC-APTES and fluorescent nano-SiO2
在其它参数不变情况下,可改变醇溶剂的种类来调控纳米SiO2的粒径,甲醇是介电常数最大的且粘度最小的低链醇[20],相同原料配比下以其为溶剂采用Stöber法合成的纳米SiO2表面Zeta电位较高,颗粒间静电排斥力大、势垒较高,可以有效减少颗粒间的碰撞和相互聚集,进而得到粒径较小的纳米颗粒;乙醇和异丙醇因介电常数依次降低以及粘度逐渐升高,以其为溶剂所合成的纳米颗粒表面电位和势垒相对较低,只有形成粒径较大的颗粒才能保证其在溶液中稳定存在。如图2所示,采用三种醇为溶剂所得的荧光纳米SiO2粒径依次为30、150和260 nm左右,其动态光散射检测结果均表现出很好的粒径单分散性,但在透射电镜表征时,由于甲醇为溶剂所得的纳米颗粒粒径较小,表面能较大,因而在干态下呈现出一定程度的团聚,而乙醇和异丙醇为溶剂所制得的荧光纳米SiO2则表现出很好的球形度和尺寸均匀性。

图2 不同醇为溶剂下合成的荧光纳米SiO2透射电镜(TEM)图及动态光散射图Fig.2 TEM images and dynamic light scattering diagrams of fluorescent nano-SiO2 synthesized in different alcohol solvents(a) methanol;(b) ethanol;(c) isopropyl alcohol.
在进行透射电镜测试的同时,也采用激光共聚焦显微镜对荧光纳米颗粒的荧光性能进行测试。由于甲醇为溶剂所合成的荧光纳米SiO2粒径太小,已经超出了激光共聚焦显微镜的分辨率下限(约150 nm),未能得到清晰有效的影像;而用乙醇和异丙醇为溶剂的荧光纳米SiO2则在490 nm波长激发下发射出了清晰饱满的绿色荧光(图3)。荧光纳米颗粒分散性较佳,且粒径与透射电镜测试值基本吻合,表明采用改进Stöber法合成荧光纳米颗粒较为成功。

图3 乙醇(a)和异丙醇(b)为溶剂合成的荧光纳米SiO2激光共聚焦显微镜测试图Fig.3 Laser confocal microscopy images of fluorescent nano-SiO2 synthesized in ethanol(a) and isopropyl alcohol(b)
为判断FITC分子的荧光性能是否会因为包覆于SiO2胶体网络中而发生改变,又采用荧光光谱仪对比分析了前驱体FITC-APTES与三种荧光纳米颗粒的激发和发射光谱(图4)。由图可见,纳米颗粒中荧光染料的激发光谱与发射光谱与游离态FITC-APTES相比仅出现了微小的移动,应该是SiO2胶体网络与包覆于其中的FITC分子的相互作用而致,相较来说FITC整体的荧光特性基本保持完整。除此之外,还可以明显发现对于相同质量浓度的荧光纳米颗粒,其在荧光激发光谱和发射光谱的强度上均表现出了明显的粒径相关性,即甲醇为溶剂合成的最小粒径的荧光纳米颗粒荧光性最强,随着粒径逐渐增大,荧光纳米颗粒的荧光性依次减弱,出现该现象的原因应该在于相同质量浓度下,纳米颗粒粒径越小,单位体积溶液中荧光纳米颗粒的个数就越多,比表面积也越大,包覆于荧光纳米颗粒中的FITC分子的荧光性能表现的也就越充分;随着纳米颗粒粒径增大,单位液体体积内纳米颗粒个数减少,纳米颗粒的表面效应会相应减弱,从而导致荧光性能出现了一定程度的下降。

图4 FITC-APTES及三种荧光纳米SiO2的激发和发射光谱Fig.4 Excitation and emission spectra of FITC-APTES and three fluorescent nano -SiO2
2.2 荧光纳米颗粒的光稳定性
为验证荧光纳米颗粒在水溶液中的光稳定性,对FITC-APTES和三种荧光纳米颗粒样品的水溶液用荧光光谱仪400 W氙灯照射90 min,每10 min测量一次荧光强度,以四种荧光样品各自起始的荧光强度作为基准,对比各样品荧光强度随照射时间的变化率,结果见图5。由图5可见,在强光照射一段时间后,几种荧光样品均表现出了一定程度的荧光衰减,不同的是处于游离态的FITC-APTES荧光衰减很快,在90 min照射后荧光强度就下降了53.96%,而其它三种荧光纳米颗粒光强的下降则小的多,甲醇为溶剂合成的粒径较小的荧光纳米颗粒光强下降了18.51%,乙醇及异丙醇为溶剂合成的样品荧光强度分别下降了12.61%和9.92%。粒径越大的样品荧光强度保护的越好,应该是粒径越大,包埋在SiO2胶体网络中的荧光分子比例越高,壳层的存在不仅可以有效防止溶解在水中的少量氧进入微球内部而造成光氧化,也可以对外界的强光进行一定程度的遮蔽。需要指出的是,虽然粒径较小的甲醇样品在强光照射下荧光损失较其它两种纳米颗粒的荧光损失稍高,但其本身的荧光强度依然高于其它两种样品,而且由于粒径较小,其存储稳定性更是优异,该样品在室温静置状态下存放6个月依然清澈透明,未出现沉降现象,而另外两个样品存放两周后就出现了不同程度的沉降。鉴于甲醇为溶剂所制备的荧光纳米SiO2优异的荧光强度保持能力以及储存稳定性,后续实验选用该样品进行磷脂巨型囊泡的成像研究。
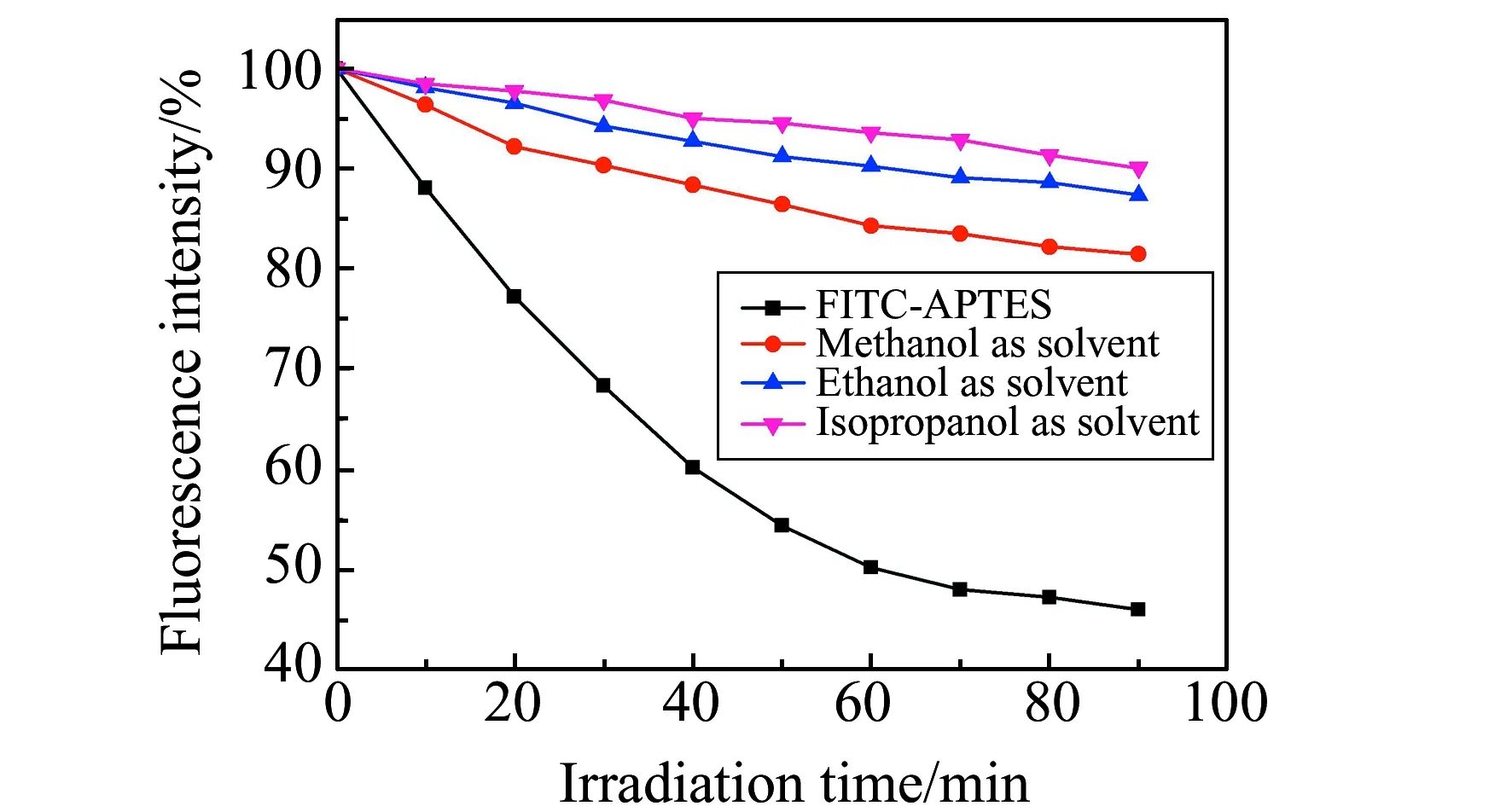
图5 FITC-APTES及三种荧光纳米SiO2的光稳定性实验结果Fig.5 Photostability experiment results of FITC-APTES and three fluorescent nano -SiO2
2.3 荧光纳米颗粒用于磷脂巨型囊泡成像
按照电形成工艺制备出磷脂巨型囊泡群后,将荧光纳米颗粒水溶液加入囊泡溶液中,荧光纳米颗粒浓度控制在0.5 mg/mL,利用荧光显微镜进行观察,分析荧光纳米颗粒与磷脂囊泡的相互作用。图6呈现了两者初始接触、培育10 h和培育24 h的荧光显微镜测试图,以及对应的微分干涉相衬(Differential Interference Contrast,DIC)图片。由图6(a)可见,当荧光纳米颗粒与巨型囊泡初始接触时,囊泡在荧光显微镜下呈现出较清晰的黑色影像,原因应该是荧光纳米颗粒加入时囊泡的封闭结构已经形成,荧光纳米颗粒初始时几乎全部处于囊泡外,囊泡内部没有荧光纳米颗粒,因而仅呈现出黑色轮廓;随着接触时间延长,出现了囊泡黑色影像逐渐减弱的现象。当两者接触10 h后(图6(b)),在荧光显微镜下几乎看不到囊泡的轮廓了,应该是在两者接触过程中,磷脂囊泡逐渐将一部分荧光纳米颗粒包覆于其内腔中,囊泡内部荧光纳米颗粒的浓度与外界游离的荧光纳米颗粒的浓度基本相同时,内外的荧光强度基本相当,囊泡无法有效成像;随着培育时间延长,荧光纳米颗粒在囊泡中不断进入和积累,内部的荧光强度明显高于外部。接触24 h后(图6(c)),已经可以观察到明亮清晰的囊泡影像。可见借助荧光纳米颗粒不仅可以实现磷脂巨型囊泡成像,还可以间接揭示两者的相互作用过程。
根据荧光显微镜的观察结果,初步推断荧光纳米颗粒与磷脂巨型囊泡的相互作用过程如图7所示。磷脂囊泡的双分子层会因其外表面的荧光纳米颗粒的吸附而发生变形,进而逐渐将纳米颗粒吸收于其内腔中,过程类似于活细胞的“内吞”过程[21]。

图7 磷脂巨型囊泡与荧光纳米SiO2相互作用示意图Fig.7 Schematic diagram of the interaction between phospholipid giant vesicles and fluorescent nano-SiO2
为了验证所作出的荧光纳米颗粒与磷脂巨型囊泡的相互作用机理推测,通过透射电镜在低加速电压(75 kV)下对体系进行观察,虽然大量的囊泡在电镜测试环境下已经破裂或融合,但仍然观察到了囊泡内包荧光纳米颗粒的过程(图8),(a)图显示出一个亚微米级别囊泡表面变形及荧光纳米颗粒进入囊泡内腔的现象,(b)图则表现出一个微米级巨型囊泡内部已经有了一定比例的荧光纳米颗粒,该检测结果间接证明了磷脂巨型囊泡这种类细胞对吸附于其表面的纳米颗粒具有一定的吸收和包载能力。

图8 荧光纳米颗粒进入磷脂巨型囊泡内腔透射电镜(TEM)图Fig.8 TEM images of fluorescent nanoparticles entering the cavity of phospholipid giant vesicle
3 结论
采用简单的改进Stöber法,制备出了不同粒径的荧光纳米SiO2颗粒,发现粒径对纳米颗粒的荧光强度和光稳定性均具有明显的影响。粒径越小纳米颗粒荧光强度越强,但粒径较大的纳米颗粒则因为可以对包载于其内部的荧光分子有较好的遮蔽效果而表现出较好的抗光漂白能力。该类荧光纳米SiO2颗粒由于具有较好的生物相容性,可以用于类细胞磷脂巨型囊泡成像,成像过程即是荧光纳米颗粒在囊泡内部的逐步聚集过程,当磷脂囊泡将荧光纳米颗粒吸收入其内部并使内部空间的荧光纳米颗粒密度高于囊泡外游离的荧光纳米颗粒密度时,即可获得较好的成像效果。
