microRNA-1290通过 NDRG1/NF-κB/IL-6信号通路促进结肠癌细胞迁移和侵袭
2021-07-14莫辉徐岷
莫辉, 徐岷
(江苏大学附属医院消化科, 江苏 镇江 212001)
结肠癌是全球最常见恶性消化道癌症类型之一,我国每年有近19.1万人死于结肠癌并呈逐年上升趋势[1]。由于早期症状易被忽视,缺乏特异性诊断标志等因素,造成多数结肠癌患者在初次就诊时即为中晚期,此时予综合治疗后预后普遍较差[2]。研究显示,结肠癌细胞中持续活化的核因子κB蛋白(nuclear factor kappa-B kinase, NF-κB) 信号可通过产生大量IL-6促进其上皮-间充质转化(epithelial-mesenchymal transition,EMT)、浸润、侵袭以及转移发生[3]。目前调控结肠癌细胞中NF-κB/IL-6信号活化的分子机制尚不明确。研究发现,众多微小RNA (microRNA,miRNA)参与结肠癌的恶性进展,其中miR-1290可能影响结肠癌不良预后[4]。然而,miR-1290是否参与结肠癌迁移和侵袭发生尚不清楚,因此本研究将围绕miR-1290与IL-6在结肠癌细胞EMT、迁移及侵袭进程中相关作用,探讨miR-1290调控NF-κB/IL-6信号通路活化的具体分子机制。
1 材料和方法
1.1 材料
1.1.1 组织标本、细胞株 选取2017年4月至2019年6月在江苏大学附属医院胃肠外科住院的48例结肠癌患者(均经江苏大学附属医院病理科确诊),术前未经任何治疗并保留完整的临床资料,于根治性切除手术中收集结肠癌瘤体及癌旁组织(距肿瘤瘤体边缘1~2 cm)标本。患者临床资料(病理类型、性别、年龄、分化程度、TNM分期、有无淋巴结转移等)从病历记录中获取,均为腺癌;男24例,女24例;年龄48~85岁,中位年龄64岁,其中<64岁24例;低分化6例,中分化37例,高分化5例;Ⅰ期7例,Ⅱ期23例,Ⅲ期15例,Ⅳ期3例;有淋巴结转移17例,无淋巴结转移31例。以上研究均得到江苏大学附属医院伦理委员会批准并取得患者知情同意。
人结肠癌SW480,SW620和HT29细胞系购自上海吉凯基因技术公司;人正常结肠上皮HCoEpiC细胞购自北京北纳创联生物技术研究院。
1.1.2 主要试剂 兔抗人NF-κB蛋白抗体、兔抗人磷酸化的NF-κB(p-NF-κB)抗体、兔抗人N-myc下游调节基因1(N-Myc downstream-regulated gene 1,NDRG1)抗体、兔抗人E-钙黏素抗体、兔抗人波形蛋白抗体以及小鼠抗人β-肌动蛋白单克隆抗体均为美国Cell Signaling Technology公司产品;兔抗人IL-6抗体及兔抗人同型对照IgG(美国Abcam公司);Trizol及LipofectamineTM2000转染试剂(美国Invitrogen公司); miR-1290类似物(上调miR-1290表达),miR-1290抑制剂(抑制miR-1290表达),相应阴性对照(不靶向任何已知的人、小鼠和大鼠基因),IL-6小干扰RNA(siRNA-IL-6,si-IL-6)和siRNA阴性对照均购自上海吉玛生物技术有限公司;HRP标记的山羊抗小鼠IgG、HRP标记的山羊抗兔IgG、DAB及牛血清白蛋白购自北京索莱宝科技有限公司;L-15、DMEM、EMEM和McCoy′s 5A培养基均为苏州Thermo Fisher公司产品;胎牛血清(以色列Biological Industries公司);逆转录试剂盒(包括miRNA一步法标准cDNA合成试剂盒)、荧光定量PCR试剂盒及BCA法蛋白质定量试剂购自南京诺唯赞生物科技有限公司。
1.2 方法
1.2.1 细胞培养和转染处理 SW480、SW620及HT-29细胞培养于含10% 胎牛血清的L-15、DMEM和McCoy′s 5A培养基中;HCoEpiC细胞培养于含10%胎牛血清的EMEM中,在37 ℃、5% CO2的培养箱中进行传代。将生长状态良好的SW620、HT-29细胞常规消化,用无双抗的完全培养基制成单细胞悬液,计数并调整浓度至1×105/孔;分别接种于6孔板;次日达60%~70%融合度时进行转染。
配制转染试剂/转染物混合物:分别取各组转染物,miR-1290类似物,miRNA-1290抑制剂和阴性对照以及转染试剂2 μL,稀释于250 μL无血清培养基中,轻吹混匀、室温孵育5 min;将上述转染物与转染试剂稀释液混合,室温孵育20 min;加入至已经接种细胞的6孔板内,补充每孔无血清培养基至2 mL,孵育6 h;弃转染混合物,更换为含10%胎牛血清的完全培养基继续培养或进行后续实验。
1.2.2 免疫组织化学染色法检测结肠癌组织中IL-6表达 48例结肠癌组织及癌旁组织样本经4%多聚甲醛固定过夜,石蜡包埋,连续切片,脱蜡处理,过氧化氢封闭内源性过氧化物酶,PBS浸洗3次,于0.01 mol/L枸橼酸钠缓冲液中95 ℃抗原修复15 min;加入兔抗人IL-6抗体(1 ∶400)于4 ℃孵育过夜;PBS冲洗3次,加入HRP标记的山羊抗兔IgG(1 ∶5 000),37 ℃孵育60 min;PBS清洗3次,DAB显色并封片,显微镜下观察。用PBS代替一抗作为阴性对照,已知阳性染色结肠癌切片做阳性对照。以200倍镜下随机选取5个视野(避开组织切片边缘)进行评分。
IL-6表达评分标准参考文献[5]:无着色记为0分,淡黄色为1分,棕黄色为2分,棕褐色计为3分;阳性表达区域评分:<25%为0分,25%≤1分<50%,50%≤2分<75%,≥75%为3分;将二者相乘取均分(总分≥5分为强阳性表达)。
1.2.3 qRT-PCR法检测相关mRNA表达
1.2.3.1 癌组织中miR-1290、IL-6 mRNA检测 从48例肿瘤组织中随机选取20例,按Trizol说明书要求提取RNA。所用引物均由上海生工生物工程技术服务有限公司设计并合成,具体序列如下,IL-6:上游5′-AGTCCTGATCCAGTTCCTGC-3′;下游5′-CTACATTTGCCGAAGAGCCC-3′;β-肌动蛋白:上游5′-GCTACGAGCTGCCTGACGG-3′;下游5′-TGTTGGCGTACAGGTCTTTGC-3′;miR-1290:5′-UGGAUU-UUUGGAUCAGGGA-3′;U6:5′-CTCGCTTCGGCAGC-ACA-3′。 qRT-PCR反应条件:95 ℃预变性2 min;95 ℃变性15 s;60 ℃退火30 s,延伸,共40个循环。通过公式2-ΔΔCt计算目的基因相对表达量。实验重复3次。
1.2.3.2 结肠癌细胞和HCoEpiC细胞中miR-1290及IL-6 mRNA、NDRG1 mRNA检测 取对数生长期SW480、SW620、HT-29以及HCoEpiC细胞,分别接种于6孔板(1×105细胞/孔),培养24 h;提取RNA,检测miR-1290表达,方法同“1.2.3.1”。
将SW620细胞分为对照组(仅作换液处理),阴性对照组(阴性对照RNA),miR-1290类似物处理组(miR-1290类似物);将HT-29细胞分为对照组,阴性对照组,miR-1290抑制剂组(miR-1290抑制剂);相应转染处理后按Trizol说明书要求提取RNA,进一步逆转录成cDNA进行检测。引物序列如下,NDRG1:上游5′-TGGACCCAACAAAGACCACT-3′;下游 5′-CCATCCAGAGAAGTGACGCT-3′;以β-肌动蛋白为内参计算NDRG1、IL-6 mRNA相对表达量。IL-6、β-肌动蛋白引物序列及检测方法同“1.2.3.1”。
1.2.4 蛋白质印迹法检测结肠癌细胞中NDRG1、EMT及NF-κB信号通路相关蛋白 取对数生长期SW620及HT-29细胞,同“1.2.3.2”分组处理,转染处理72 h;PBS洗3次,于冰上加入100 μL RIPA裂解液刮拭;收集细胞裂解液,4 ℃,12 000×g离心10 min;取上清液;BCA法测定蛋白含量;根据浓度加入不等上样缓冲液,100 ℃热变性10 min,于-80 ℃保存。取50 μg蛋白上样,先60 V将蛋白压至积层胶,再调100 V待蛋白跑至胶底部;300 mA 恒流转PVDF膜60~120 min;用含5%牛血清白蛋白的 TBST室温孵育60 min;加入1 ∶1 000稀释的兔抗NDRG1抗体、兔抗NF-κB抗体、兔抗p-NF-κB抗体、小鼠抗β-肌动蛋白单克隆抗体、兔抗E-钙黏素抗体、兔抗波形蛋白抗体,4 ℃孵育过夜;次日用TBST 洗3次,每次10 min;置于HRP标记的山羊抗小鼠IgG或抗兔IgG(1 ∶5 000)二抗室温继续孵育60 min;TBST洗膜3次,每次10 min;加入曝光液显影、拍摄并计算光密度值。
1.2.5 ELISA试验检测IL-6外泌表达量 SW620及HT-29细胞转染分组同“1.2.3.2”,处理48 h(统一细胞量待检测时为1×106/孔);收集细胞上清液,300×g离心10 min;收集上清液于-80 ℃保存,待ELISA检测前1 h取样品于4 ℃解冻。将所有ELISA试剂放于室温下平衡,按照试剂盒说明书说明,稀释标准品以及对待检测的上清样品进行预处理;计算总样本数(包括标准品孔,空白孔,样品孔并设复孔),浸泡包被96孔板,加入各样本后再加入稀释好的一抗,室温振荡孵育1.5 h;清洗3次;每孔分别加入稀释的HRP标记的链霉亲和素,室温孵育30 min;洗涤3次;加入底物TMB显色20 min;每孔加入终止液,用酶标仪检测450 nm处光密度。
1.2.6 划痕实验检测结肠癌细胞迁移能力 取对数生长期SW620细胞(1×105细胞/孔),接种于6孔板,分为对照组、阴性对照组、miR-1290类似物处理组、siRNA阴性对照组和siRNA-IL-6组;其中,选取转染miR-1290 类似物SW620细胞,继续用siRNA-IL-6转染后换液培养24 h作为miR-1290 类似物+siRNA-IL-6处理组;待细胞融合达95%左右时,用200 μL枪头按直线进行纵向划痕;PBS清洗,加入无血清培养基继续培养;随机选择5个视野分别于0 h和24 h测量细胞愈合率,细胞愈合率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。实验重复3次,每次设3个平行复孔。
1.2.7 Matrigel侵袭小室实验检测结肠癌细胞侵袭能力 将SW620细胞培养处理24 h;消化,将5×104个细胞重悬于200 μL无血清培养基中种于上室,下室加入600 μL含10%胎牛血清的完全培养基;随机选取小室分为对照组、阴性对照组、miR-1290类似物组、同型对照抗体组(抗体稀释比为1 ∶400)、特异性抗体中和外泌IL-6(抗IL-6)组以及miR-1290类似物+抗IL-6组;继续培养48 h;用棉签去除未侵袭细胞;100%甲醇固定15 min;0.1% 结晶紫溶液室温染色5 min,于显微镜下200倍观察,每组计数5个视野;实验重复3次,取平均值。
1.3 统计学分析
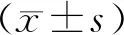
2 结果
2.1 IL-6、miR-1290在结肠癌组织及细胞中均呈高表达
免疫组织化学染色结果显示,结肠癌组织中伴随着肿瘤细胞分布可见大量的IL-6阳性、强阳性的表达区域,而癌旁组织中有零星IL-6弱阳性区域,呈现无规律散布,整体表达强度偏低。免疫组化评分结果显示IL-6在结肠癌中评分明显高于对应的癌旁组织(Z=7.713,P<0.01)。见图1。qRT-PCR结果证实,结肠癌瘤体内miR-1290与IL-6 mRNA表达呈明显正相关(r=0.845 4,P<0.01,图2)。细胞实验结果表明,结肠癌SW480、SW620及HT-29细胞中miR-1290表达明显高于HCoEpiC结肠上皮细胞(P均<0.01)。见图3。

图1 结肠癌组织和癌旁组织中IL-6表达(×100)
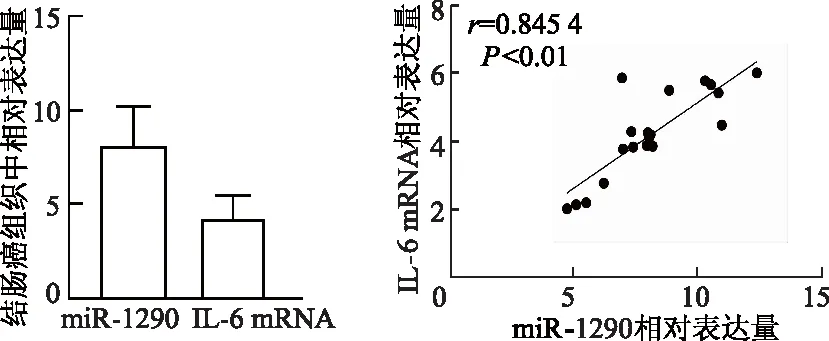
图2 qRT-PCR检测结肠癌组织中miR-1290与IL-6 mRNA表达及二者之间相关性

图3 结肠癌SW480、SW620、HT-29细胞及正常结肠上皮HCoEpiC细胞中miR-1290表达
2.2 miR-1290促进NF-κB信号通路活化及EMT发生
miR-1290类似物和抑制剂可以有效促进miR-1290显著上调(t=24.33,P<0.01)或抑制其表达(t=87.88,P<0.01)。见图4。蛋白质印迹结果显示,与对照组及阴性对照组相比, miR-1290类似物组NDRG1、E-钙黏素表达显著抑制,而p-NF-κB和波形蛋白表达增强;与对照组及阴性对照组相比,miR-1290抑制剂组中NDRG1和E-钙黏素表达升高,p-NF-κB、波形蛋白表达降低(P均<0.01);miR-1290 类似物组(t=0.38,P=0.71)、miR-1290抑制剂组(t=0.14,P=0.90)与各自对照组细胞相比,NF-κB表达量均无显著改变。见图5。

a:P<0.01,与对照组比较;b:P<0.01,与阴性对照组比较
2.3 miR-1290调控NDRG1表达及IL-6表达、分泌
qRT-PCR结果显示,与对照组及阴性对照组比较, miR-1290类似物组NDRG1 mRNA表达显著降低(t=18.48,P<0.01),IL-6 mRNA表达明显增加(t=37.71,P<0.01);与对照组及阴性对照组相比,miR-1290抑制剂组NDRG1 mRNA表达明显增加(t=56.92,P<0.01),IL-6 mRNA表达显著降低(t=62.81,P<0.01)。见图6。
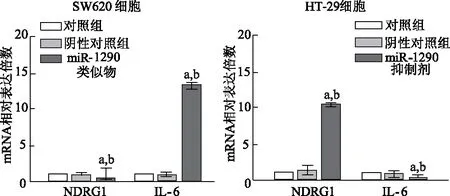
a:P<0.01,与对照组比较;b:P<0.01,与阴性对照组比较
ELISA结果显示,与各自对照组相比,miR-1290 类似物组IL-6外泌量明显增加(t=28.36,P<0.01),miR-1290抑制剂组IL-6外泌量明显降低(t=32.32,P<0.01)。见图7。
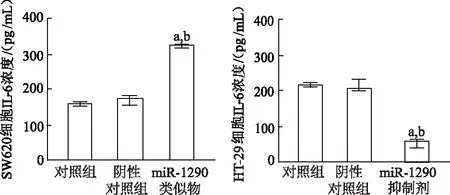
a:P<0.01,与对照组比较;b:P<0.01,与阴性对照组比较
2.4 miR-1290通过IL-6参与结肠癌细胞迁移及侵袭进程
划痕实验结果显示,与对照组相比,si-IL-6组细胞愈合率明显降低(t=21.51,P<0.01);而miR-1290类似物组愈合率明显上调(t=17.10,P<0.01);miR-1290类似物+si-IL-6组愈合率较miR-1290类似物组显著降低(t=36.16,P<0.01)。见图8。侵袭小室实验进一步证实,抗IL-6组结肠癌细胞侵袭数显著下降(t=45.52,P<0.01);miR-1290类似物组细胞侵袭数较对照组显著增加(t=20.01,P<0.01);miR-1290类似物+抗IL-6组细胞侵袭数较miR-1290类似物组明显降低(t=22.64,P<0.01)。见图9。

a:P<0.01,与对照组比较;b:P<0.01,与miR-1290类似物组比较

a:P<0.01,与对照组比较;b:P<0.01,与miR-1290类似物组比较
3 讨论
近年来大量研究显示,广泛分布在细胞内、血液以及分泌物中的miRNA因其茎环结构和较小体积不易被RNA酶降解等特点,可作为临床检测指标[6]。已有研究发现,miR-1290表达上调往往预示着卵巢癌[7]、胰腺癌[8]、食管鳞癌[9]等恶性肿瘤患者的不良预后;胃癌细胞来源中miR-1290可促进肿瘤恶性增殖和侵袭发生[10]。本研究证实,相较于癌旁组织,结肠癌组织中miR-1290表达明显增高;与之相一致的是,不同结肠癌细胞株中miR-1290表达量也均明显高于正常结肠上皮细胞,提示miR-1290异常高表达可能与结肠癌恶性生物学行为有关。目前普遍认为,IL-6参与包括结肠癌在内的多种肿瘤EMT发生、侵袭、转移等进程[3]。本研究免疫组化结果显示,结肠癌中IL-6表达强度明显高于癌旁组织;同时,IL-6 mRNA与miR-1290表达量呈正相关,表明结肠癌中miR-1290可能与IL-6表达存在密切联系。后续结合miR-1290类似物、抑制剂后发现,上调或抑制miR-1290可以显著增强或降低IL-6的转录和外泌水平,但是miR-1290调控IL-6表达的相关机制以及是否参与结肠癌EMT发生、迁移、侵袭等还需进一步研究。
异常表达的miRNA可通过调节多种关键信号通路活化,各种抑癌或者癌基因表达等作用于肿瘤的发生、发展[6]。研究表明,过度激活或者受控的NF-κB信号可通过磷酸化IκB并使其泛素化降解,进而促其下游靶基因IL-6表达并参与结肠癌细胞EMT、侵袭、转移等发生[4]。本研究蛋白质印迹结果显示,靶向上调或下调miR-1290会引起NF-κB信号通路的持续激活或者明显抑制。有结肠癌相关研究表明,作为NF-κB信号通路活化的负性调控蛋白,NDRG1可以阻断IκBα磷酸化以及介导NF-κB抑制物激酶α/β的降解抑制EMT发生[11]。本研究证实,结肠癌细胞中miR-1290表达上调可有效抑制NDRG1表达并促进EMT发生,而下调miR-1290可以迅速恢复NDRG1、E-钙黏素表达以及抑制波形蛋白形成,上述结果与已有非小细胞肺癌的研究相同[12],即miR-1290可能通过抑制NDRG1表达来维持肿瘤细胞中NF-κB信号通路的持续活化。为进一步验证miR-1290/NDRG1/NF-κB信号调控是通过IL-6参与结肠癌迁移、侵袭进程,结合siRNA靶向抑制或者抗体中和通过划痕实验和Matrigel侵袭小室实验证实,miR-1290促进结肠癌细胞迁移、侵袭形成,该进程依赖于IL-6的表达和分泌。然而,基于组织样本特别是血液标本探究miR-1290是否伴随结肠癌发展出现相应改变,以及动物模型的建立等还有待进一步验证。
综上所述,本研究发现miR-1290通过抑制NDRG1蛋白来促进结肠癌细胞中NF-κB信号通路活化,并通过其下游靶蛋白IL-6参与结肠癌细胞EMT发生、迁移以及侵袭能力增强,提示miR-1290可能作为一种促癌因子参与结肠癌不良预后的形成,因而检测miR-1290有助于评估结肠癌患者预后,在动态监控病情发展中也具有一定临床价值。
