低氧对胰腺癌PANC-1细胞株中TWIST表达的影响
2021-07-14毛正发罗钧艺李熙马小艳
毛正发,罗钧艺,李熙,马小艳
(1. 江苏大学附属医院普外科,江苏 镇江212001; 2. 江苏大学医学院,江苏 镇江212013; 3. 江苏大学附属医院妇产科,江苏 镇江212001)
胰腺癌是预后极差的消化道恶性肿瘤之一[1-2]。微环境低氧在胰腺癌发生发展中起着重要的作用[3]。低氧可诱导胰腺癌细胞上皮间充质转化(epitheliale-mesenchymal transition,EMT),从而增强迁移和侵袭[4]。不同部位消化道肿瘤,组织微环境低氧程度不同。胰腺癌组织的病理特征表现为高度成纤维细胞纤维化反应,组织缺乏血供,严重低氧的微环境。与预后较好的胃肠道肿瘤相比,胰腺癌更易发生复发和转移,这提示胰腺癌高度侵袭性生物学行为可能与肿瘤微环境的极度低氧具有紧密的相关性。但是低氧如何促进胰腺癌的恶性生物学行为,其机制仍未完全清楚。
TWIST是一种高度保守的碱性螺旋-环-螺旋转录因子,对于脊椎动物的正常发育至关重要。已有研究表明,TWIST是一种促癌基因,在乳腺癌、胃癌、前列腺癌、黑色素瘤、胶质瘤、骨肉瘤等多种恶性肿瘤中均高表达[5-8]。胰腺癌中TWIST作为一种促癌基因,在组织中高表达且促进胰腺癌的进展[9]。低氧环境可以显著诱导TWIST蛋白高表达,促进胰腺癌血管生成、EMT、转移以及顺铂耐药[10]。但是低氧环境诱导TWIST表达升高的具体机制尚未完全明确。
N6-甲基腺嘌呤(N6-methyladenosine,m6A)修饰是高等真核生物中含量最丰富的转录后修饰,是一种动态可逆的RNA修饰方式,主要由RNA甲基转移酶、RNA去甲基化转移酶和RNA甲基化修饰结合蛋白协同调控[11-12]。 m6A动态修饰在维持生理平衡中起着关键作用,异常的m6A修饰可能是肿瘤发生的重要诱因[13]。甲基转移酶样分子3(METTL3)是经典的m6A RNA甲基转移酶,可以对mRNA进行m6A修饰。m6A修饰被不同的RNA甲基化修饰结合蛋白识别可引起不同类型的RNA代谢效应,包括mRNA的稳定性、pre-mRNA的加工剪接[14]、翻译、出核[15]等。本研究探讨了低氧环境对TWIST表达的影响及其可能的机制。
1 材料和方法
1.1 材料
人单克隆抗体TWIST、α-平滑肌肌动蛋白(α-SMA)、波形蛋白、E-钙黏蛋白、METTL3(美国Abcam公司)。其他化学品均为美国Sigma 公司或Fisher Scientific 公司产品。
1.2 细胞培养
人胰腺癌PANC-1细胞株购自美国ATCC, 置于RPMI-1640培养基中,于5%CO2空气浓度,37 ℃条件下培养箱中培养。培养基补充有10%胎牛血清,2 mmol/mL谷氨酰胺,100 U/mL青霉素和100 U/mL链霉素;低氧培养持续通入94% N2∶5% CO2∶1% O2的混合气体。
1.3 蛋白质印迹检测低氧下PANC-1细胞TWIST蛋白的表达
将PANC-1细胞种于培养皿低氧培养0、12、24、48 h后收集细胞,使用RIPA缓冲液裂解并进行蛋白定量,根据检测蛋白质分子质量的大小配置相应浓度的分离胶及浓缩胶。蛋白质变性后行SDS-PAGE,70 V 2 h;350 mA转膜2 h,将凝胶分离的蛋白质转移到PVDF膜上。PVDF膜洗涤后5% BSA封闭1h;TWIST一抗1 ∶1 000稀释,4 ℃孵育过夜。TBST洗膜3次,每次10 min,加HRP偶联的二抗(1 ∶2 000),室温孵育1 h,TBST洗膜3次,每次10 min,然后用ECL试剂盒曝光检测蛋白的表达。
1.4 免疫荧光检测EMT相关蛋白的表达
将PANC-1细胞铺板于盖玻片上低氧培养48 h后,在室温下用PBS洗涤细胞3次,并在冰上用4%多聚甲醛固定30 min。用含有5%山羊血清、2%驴血清、2% BSA、0.1%Tween-20和0.3%Triton X-100的PBS在室温下封闭细胞1 h。PBS洗涤细胞3次,每次5 min,TWIST(1 ∶300)、α-SMA(1 ∶300)、波形蛋白(1 ∶200)、 E-钙黏蛋白(1 ∶100)抗体稀释后,4 ℃下孵育过夜。PBS洗涤细胞3次,每次5 min,二抗(Alex Fluro 594-标记的山羊抗小鼠IgG)以1 ∶4 000稀释度常温下孵育2 h。PBS清洗细胞3次,每次10 min。用PBS稀释的DAPI染液(1 ∶3 000),室温避光孵育细胞15 min。孵育结束后用PBS清洗细胞5次,每次5 min。使用倒置共聚焦激光显微镜拍照。
1.5 蛋白质印迹检测低氧条件下敲低TWIST后PANC-1细胞EMT相关蛋白的表达
1.5.1 质粒构建 针对TWIST的小干扰RNA(siRNA)由吉玛公司设计和合成,TWIST序列如下:正向引物5′-GGACAAGCUGAGCAAGAUUCA-3′,反向引物5′-UGAAUCUUGCUCAGCUUGUCC-3′。TWISTScramble-序列:正向引物 5′-UUCUCCGAACGUGUCACGU-3′,反向引物 5′-ACGUGACACGUUCGGAGAA-3′。
1.5.2 病毒包装 使用293T细胞在10 cm培养皿中培养至80%~90%融合时,接种于15 cm培养皿。倾去培养液,用1 mL D-Hank′s液洗涤细胞2次。加入1 mL胰蛋白酶-EDTA液, 混匀后,37 ℃放置2~3 min。小心吸去胰酶溶液,加入2 mL含10% 胎牛血清的DMEM,吹打使细胞形成单细胞悬液。将细胞悬液接种15 cm培养皿,加入18 mL含10% 胎牛血清的DMEM,混匀后37 ℃ 5% CO2培养过夜。在一支无菌的5 mL离心管中加入1.5 mL无血清DMEM,按比例加入穿梭质粒和包装质粒(pGag/Pol、pRev、pVSV-G),混匀,取另一支无菌的5 mL离心管,加入1.5 mL无血清DMEM,再加入300 μL RNAi-Mate,混匀,室温放置5 min后将两管混合,室温放置20~25 min。除去15 cm培养皿中的培养液,加入8 mL无血清的DMEM。将转染混合物逐滴加入15 cm培养皿中,轻轻地前后摇晃培养皿以混匀复合物,在37 ℃、5% CO2培养箱中温育4~6 h。吸弃转染液,加入18 mL含10%胎牛血清的DMEM,37 ℃、5% CO2继续培养72 h。
1.5.3 蛋白质印迹 将病毒转染PANC-1细胞,在24孔板内加入8 μg/mL凝聚胺,37 ℃、5%CO2培养箱孵育0.5 h后,再选择2孔分别加入对照病毒和目的病毒。继续培养24 h后,用新鲜培养基替换含有病毒的培养基。对照组细胞转染TWIST-siRNA 随机序列,处理组细胞转染TWIST-siRNA。低氧及常氧条件下培养,检测TWIST敲低后EMT相关蛋白的表达,抗体按如下浓度稀释:α-SMA(1 ∶1 000)、波形蛋白(1 ∶1 000)、 E-钙黏蛋白(1 ∶500),方法同步骤“1.3”。
1.6 检测低氧条件下METTL3的表达
1.6.1 qRT-PCR检测PANC-1细胞株中METTL3的表达 PANC-1细胞缺氧培养12、24、48 h后,收集细胞。使用Lighter Cycle-DNA Master SYBR Green Ⅰmixture (瑞士 Roche Applied Science公司)进行扩增反应。反应条件设置如下:95 ℃ 3 min,40个循环(95 ℃ 15 s,56 ℃ 20 s,72 ℃ 30 s)。为确保扩增的特异性,每对引物的扩增产物都进行熔解曲线和电泳分析。METTL3引物序列:正向引物5′-GTCCATCTGTCTTGCCATCTC-3′,反向引物5′-GAGACCTCGCTTTACCTCAATC-3′。
1.6.2 蛋白质印迹检测METTL3的表达 METTL3抗体1 ∶1 000稀释,检测方法同步骤“1.3”。
1.7 检测低氧条件下PANC-1细胞总m6A水平
1.7.1 比色法检测PANC-1细胞总m6A水平 按试剂盒说明配置系列标准样品并制作浓度曲线。PANC-1细胞缺氧培养12、24、48 h后,收集细胞。按试剂盒说明配制待测样品(与标准样品等体积),与标准曲线对比,计算出待测样品m6A水平。
1.7.2 比色法检测METTL3敲减后PANC-1细胞总m6A水平 针对METTL3的小干扰RNA(siRNA)由吉玛公司设计和合成,METTL3序列如下:正向引物 5′-GCACUUGGAUCUUCGGAAUTT-3′,反向引物 5′-AUUCCGAAGAUCCAAGUGCTT-3′。METTL3Scramble-序列:正向引物 5′-UUCUCCGAACGUGUCACGUTT-3′,反向引物 5′-ACGUGACACGUUCGGAGAATT-3′。病毒包装及转染同步骤“1.5.2”。对照组细胞转染METTL3-siRNA 随机序列,处理组细胞转染METTL3-siRNA。蛋白质印迹检测敲低效率。低氧及常氧条件下培养转染后细胞48 h,比色法检测敲低METTL3后细胞总m6A水平的影响,方法同步骤“1.7.1”。
1.8 检测METTL3敲减后PANC-1细胞中TWIST的表达
1.8.1 qRT-PCR检测METTL3敲减后TWISTmRNA的表达 PANC-1细胞转染后缺氧培养48 h,收集细胞。使用Lighter Cycle-DNA Master SYBR Green Ⅰmixture(瑞士 Roche Applied Science公司)进行扩增反应。反应条件设置如下:95 ℃ 3 min,40个循环(95 ℃ 15 s,56 ℃ 20 s,72 ℃ 30 s)。为确保扩增的特异性,每对引物的扩增产物都进行熔解曲线和电泳分析。TWIST引物序列:正向引物 5′-GTCCGCAGTCTTACGAGGAG-3′,反向引物 5′-GCTTGAGGGTCTGAATCTTGCT-3′。
1.8.2 蛋白质印迹检测METTL3敲减后TWIST的表达 对照组细胞转染METTL3-siRNA 随机序列,处理组细胞转染METTL3-siRNA。低氧条件下培养,蛋白质印迹检测METTL3敲减后TWIST蛋白表达,方法同步骤”1.3”。
1.8.3 MeRIP-qPCR检测METTL3敲减后TWISTm6A的表达 每组取30 μL Protein A/G PIUS-Agarose与适量的抗体混匀,于4℃旋转混匀6 h左右;每组准备2皿细胞,弃去培养基,紫外线照射固定细胞;使用预先冰浴冷却的PBS洗细胞2次,收集细胞沉淀;将裂解液加入细胞沉淀中,充分裂解。加入裂解液后在4 ℃下12 000 r/min离心10 min,取上清液,加入准备好的琼脂糖珠-抗体混合液中,于4 ℃旋转混匀过夜。将混匀液于4 ℃,1 000 r/min离心2 min,弃上清液;用冰浴冷却的低盐漂洗液洗琼脂糖珠2次,每次5 min,冰上或4 ℃进行,1 000 r/min离心2 min,弃上清液。随后再用高盐漂洗液(300 mmol/L的NaCl)洗琼脂糖珠2次,每次5 min,冰上或4 ℃进行,1 000 r/min离心2 min,弃上清液。qRT-PCR检测步骤:用蛋白酶K溶液重悬琼脂糖珠,55 ℃消化10 min,再用常规的Trizol法抽提RNA,用乙醇沉淀。 使用Lighter Cycle-DNA Master SYBR Green Ⅰmixture(瑞士Roche Applied Science公司)进行扩增反应。方法同步骤“1.8.1”。
1.8.4 蛋白质印迹检测METTL3过表达后TWIST的表达METTL3-WT引物序列:正向引物 5′-CGGAATTCGCCACGAGACTGAAATGT-3′,反向引物 5′-GCGTCGACATAGATTCTTAGGTTTAGAGATGAT-3′,组装至pcDNA3.1载体。METTL3-MUT sgRNA序列:正向引物 5′-GAAATTAATACGACTCACTATAggagcgcaccatcttcttcaGTTTTAGAGCTAGAAATAGCAAG TTAAAATAAGGCTAGTCCG-3′, 反向引物5′-GAA ATTAATACGACTCACTATAGggtggtgcagatgaacttcaGTT TTAGAGCTAGAAATAGCAAGTTAAAATAAGGCTAG TCCG-3′,插入至pst1374-nirs-flag-cas9载体。转染细胞后蛋白质印迹检测TWIST的表达,方法同步骤“1.3”。
1.9 统计学分析

2 结果
2.1 低氧诱导TWIST高表达,促进胰腺癌细胞EMT
胰腺癌PANC-1细胞低氧培养后,随着缺氧时间的增加,蛋白质印迹显示TWIST蛋白的表达水平逐渐增加(图1)。低氧培养48 h后,免疫荧光显示PANC-1细胞中TWIST蛋白,间充质标志物α-SMA、波形蛋白的表达显著升高,同时上皮标志物E-钙黏蛋白表达下降(图2),表明低氧诱发胰腺癌细胞EMT。
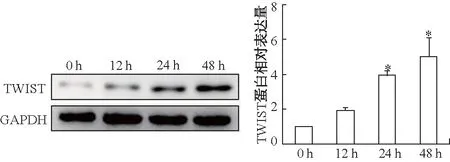
*:P<0.01,与0 h比较
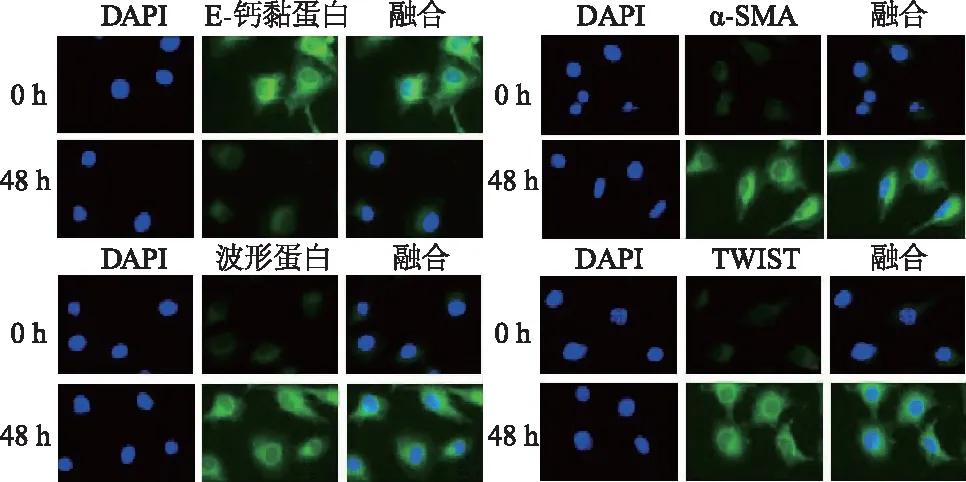
图2 免疫荧光检测低氧下PANC-1细胞EMT相关指标和TWIST表达(×100倍)
蛋白质印迹显示,在常氧下转染TWISTsiRNA后,PANC-1细胞中TWIST蛋白表达下降了60%,低氧浓度下表达下降了80%。在常氧浓度下,敲低TWIST表达后E-钙黏蛋白的表达水平上升约2倍,α-SMA表达下降50%,波形蛋白表达下降约70%;在低氧浓度下,敲低TWIST表达恢复了E-钙黏蛋白的表达增加了2倍,而α-SMA及波形蛋白的表达部分受到抑制,分别下降50%和75%,提示下调TWIST可以削弱低氧引起的EMT(图3)。以上结果表明,低氧可以通过诱导TWIST高表达,促进胰腺癌细胞EMT。
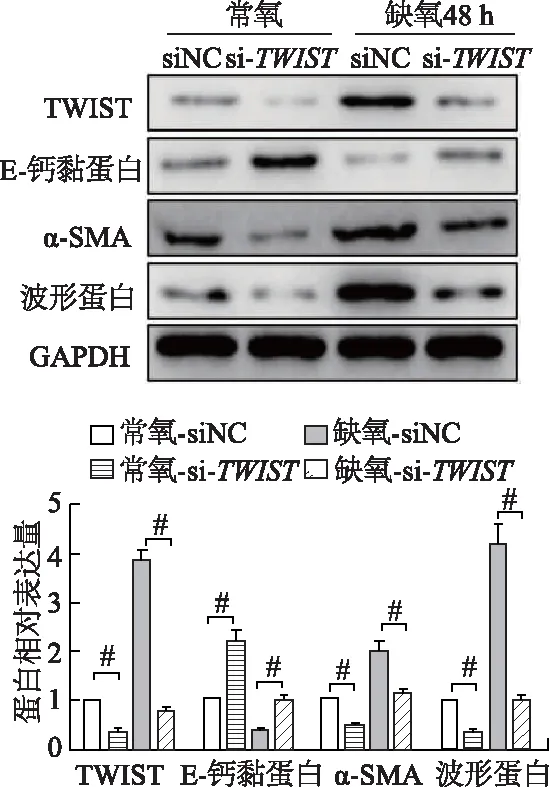
#:P<0.01
2.2 低氧诱导METTL3表达,促进胰腺癌细胞的m6A水平升高
qRT-PCR及蛋白质印迹结果显示,低氧处理的PANC-1细胞中,随着时间的延长RNA甲基转移酶METTL3的mRNA(P<0.01)和蛋白(P<0.01)表达逐渐增加,48 h后增加约4倍(图4A、B);比色法检测细胞总m6A水平,结果显示随着低氧处理时间延长,细胞中总m6A水平升高(P<0.01),48 h后增加80%(图4C)。
蛋白质印迹显示,转染METTL3siRNA后,PANC-1细胞中METTL3蛋白表达下降40%(图4D)。在常氧浓度下,敲低METTL3后,细胞中总的m6A相对表达水平轻度下降;在低氧浓度下,敲低METTL3后可显著抑制低氧诱导的m6A水平升高,下降了45%(图4E)。以上结果表明,低氧诱导METTL3表达,促进胰腺癌细胞的总m6A水平升高。

A、B: qRT-PCR 和蛋白质印迹检测低氧条件下METTL3表达;C:低氧下细胞总m6A水平检测;D、E: 构建METTL3稳定敲低的PANC-1细胞及其对照,常氧和低氧条件下检测METTL3敲低效率和细胞总m6A水平。*:P<0.05,#:P<0.01
2.3 METTL3依赖于m6A修饰调控TWIST蛋白表达
qRT-PCR显示,低氧条件下,稳定敲低METTL3后,PANC-1细胞中TWISTmRNA的表达未见明显改变(图5A);但蛋白质印迹显示,低氧条件下敲低METTL3后TWIST蛋白表达下降了60%(图5B)。MeRIP-qPCR检测结果显示,低氧条件下敲低METTL3后, PANC-1细胞中TWISTmRNA m6A水平降低了20%(图5C)。蛋白质印迹显示,在PANC-1细胞中瞬时转染METTL3-WT或METTL3-MUT后,METTL3-WT组TWIST蛋白表达较对照组升高2.2倍,而METTL3-MUT组无显著变化(图5D)。以上结果提示:METTL3依赖于m6A修饰调控TWIST蛋白表达。

A、B: METTL3稳定敲低的PANC-1细胞低氧处理48 h后,TWIST mRNA和蛋白表达;C: MeRIP-qPCR检测TWIST RNA m6A水平;D:在PANC-1细胞中瞬时转染METTL3-WT或METTL3-MUT质粒,蛋白质印迹检测TWIST表达。*:P<0.05,#:P<0.01
3 讨论
EMT指上皮到间质细胞的转化,它赋予细胞转移和入侵的能力,不仅在发育过程中起着关键的作用,而且还参与各种病理及生理过程[4]。E-钙黏蛋白表达的缺失被认为是EMT的关键步骤。EMT诱导基因可以分为两组,Snail家庭转录因子1、E盒结合锌指蛋白1(ZEB1)、核转录因子E47和Krüppel样转录因子8(KLF8)可以与E-钙黏蛋白的启动子结合并抑制其表达,TWIST等则间接抑制E-钙黏蛋白的活性。EMT关键的步骤是上皮细胞到间充质细胞的转化同时伴有极性的丧失,α-SMA和波形蛋白是经典的间充质标志物。本研究中免疫荧光及蛋白质印迹结果显示,低氧处理胰腺癌细胞,TWIST蛋白表达随着时间延长逐渐增加,上皮标志物E-钙黏蛋白表达下降而α-SMA和波形蛋白明显增加。而同等低氧条件下敲低TWIST表达后,E-钙黏蛋白表达部分恢复而α-SMA和波形蛋白表达部分得到抑制,说明低氧可能通过调节TWIST的表达促进胰腺癌EMT。结果提示TWIST在胰腺恶性肿瘤适应低氧环境,促进肿瘤发生发展中起一定的作用。
微环境低氧是肿瘤的基本特征,在多种类型恶性肿瘤的发生发展中起着至关重要的作用,且与其他类型实体瘤相比,胰腺癌组织含氧量最低[3]。我们进一步观察胰腺癌细胞中低氧条件是否影响METTL3表达及细胞总 m6A水平,结果显示低氧处理后,RNA甲基转移酶METTL3的mRNA和蛋白表达均显著升高;同时胰腺癌细胞总m6A水平显著升高,常氧条件下敲低METTL3表达后胰腺癌细胞m6A水平轻度下降,而低氧条件下敲低METTL3则显著抑制m6A水平升高。这提示低氧可以通过诱导METTL3表达,显著升高胰腺癌细胞的m6A水平。
为了研究胰腺癌细胞在低氧条件下,METTL3 m6A修饰功能与TWIST蛋白表达之间是否存在关系,我们构建了METTL3敲低PANC-1细胞系,结果显示低氧条件下敲低胰腺癌细胞METTL3表达显著降低TWISTmRNA的m6A水平,抑制TWIST蛋白表达,但对TWISTmRNA表达水平无显著影响;过表达METTL3显著上调TWIST蛋白的表达,而转入METTL3突变质粒未见相关改变。结果提示METTL3依赖m6A修饰调控TWIST蛋白表达。
综上所述,本研究结果提示,低氧通过诱导METTL3表达,以m6A依赖的方式调控TWIST蛋白表达。然而METTL3调节TWIST蛋白的具体机制有待进一步研究。
