重楼皂苷A直接靶向活化AMPK诱导结直肠癌细胞自噬
2021-07-14彭鹏杨书胜向雨晨文君司渊刘莹
彭鹏,杨书胜,向雨晨,文君,司渊 ,刘莹,3
(湖北医药学院 1. 基础医学院; 2. 武当特色中药研究湖北省重点实验室;3. 胚胎干细胞湖北省重点实验室,湖北 十堰 442000)
结直肠癌是全球范围内的常见恶性肿瘤之一[1]。虽然手术切除、放疗、化疗一定程度可提高患者总生存率,但晚期结直肠癌患者5年生存率仅14%[2]。
自噬是真核生物体内维持细胞稳态的一种关键的降解途径[3]。自噬在肿瘤的发生发展中发挥着“双刃剑”的作用。一方面肿瘤细胞可以通过保护性自噬来应对环境或治疗所诱导的应激状态,为自身提供能量“渡过难关”[4]。另一方面,当细胞过度自噬时,会导致细胞的病理变化并引起非保护性自噬/自噬性死亡,起到抑制肿瘤的作用[5]。据报道,一些批准的和/或实验性药物在不同类型的肿瘤细胞中诱导非保护性自噬而抗肿瘤[6]。腺苷酸活化蛋白激酶(AMP-activated kinase, AMPK)在维持真核细胞能量稳态中起重要作用[7],其通过Thr-172磷酸化而发生活化[8]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路是AMPK下游调控自噬的关键通路。AMPK能够通过直接磷酸化而负调控mTOR活性,从而激活自噬发生[9]。研究发现,AMPK可以作为一种肿瘤抑制因子参与多种类型的肿瘤自噬调控[10]。
重楼是一种传统的中药材,是百合科植物重楼的干燥根茎[11]。它具有抗真菌、抗炎、抗氧化和抗肿瘤等多种治疗用途[12]。重楼皂苷A (Polyphyllin A, PPA, 图1)是从重楼中提取的一种天然皂苷类成分。研究表明,PPA能够在肺癌[13]、前列腺癌[14]、胶质瘤[15]等多种肿瘤中诱导自噬进而发挥抗肿瘤作用。但是它在结直肠癌中的作用尚不完全清楚,本研究旨在探讨PPA对结直肠癌的抗肿瘤作用及其作用机制。
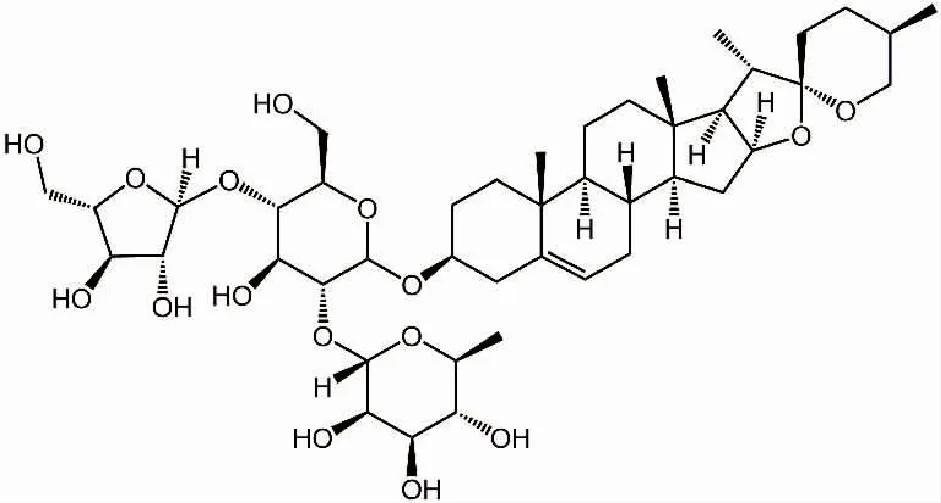
图1 重楼皂苷A的化学结构
1 材料和方法
1.1 试剂
RKO和HRT18结直肠癌细胞系购自美国模式培养物集存库。PPA(纯度为98%)购自上海源叶生物科技有限公司。将PPA溶解于二甲基亚砜中并于-20 ℃储存。二甲基亚砜、MTT(美国Sigma公司);DMEM高糖培养基(美国HyClone公司);胎牛血清(美国Gibco公司);兔抗人LC3单克隆抗体、兔抗人AMPK、p-AMPK (Thr-172)、兔抗人p-mTOR(Ser-2448)、mTOR均为美国CST公司产品;羊抗兔二抗、羊抗鼠二抗、GAPDH 均为美国Santa Cruz公司产品;一抗稀释液(日本东洋纺公司);显影胶片(日本柯达公司);pQCXIP-GFP-LC3质粒(美国Addgene公司);DAPI、Triton X-100、4%多聚甲醛、ECL显色液均为上海碧云天试剂公司产品;Lipofectamine®3000 (美国Thermo Fisher公司)。
1.2 细胞培养
RKO细胞和HRT18细胞于-80 ℃保存;实验时,取出细胞,置于37 ℃水浴锅中快速摇动复苏;完全融化后转移至含有10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的DMEM,并置于37 ℃,含5% CO2培养箱中培养。细胞贴壁达80%时,用含EDTA的胰酶消化传代并继续培养。
1.3 MTT实验检测细胞活力
取“1.2”中处于对数生长期的RKO和HRT18细胞,PBS洗涤,换新鲜DMEM调整细胞密度至6.7×104个/mL,接种于96孔板,每孔加入90 μL细胞悬液,于37 ℃,5% CO2培养箱中培养24 h。用培养基将PPA稀释为0、4、8、12、16、20、24 μmol/L,分别取10 μL加入RKO细胞中,每种浓度设4个复孔;另用培养基将PPA稀释为0、10、20、30、40、50、60 μmol/L,分别取10 μL加入HRT18细胞中,每种浓度设4个复孔;孵育20 h;分别加入10 μL MTT (5 mg/mL),继续培养4 h;弃培养基,每孔加入150 μL二甲基亚砜,避光孵育并充分振荡均匀;全自动酶标仪检测490 nm波长处光密度(D)值,并计算细胞活力。细胞活力(%)=(实验组D值-空白组D值)/(对照孔D值-空白组D值)×100%。筛选合适浓度进行后续实验。
1.4 细胞分组及处理
取“1.2”中处于对数生长期的RKO细胞和HRT18细胞,以3×105个/孔接种于6孔板,DMEM中培养24 h。根据“1.3”中细胞活力检测结果,RKO细胞用含不同浓度PPA (0、0.6、0.7、0.8 μmol/L)的DMEM处理24 h,HRT18细胞用含不同浓度PPA (0、1.4、1.6、1.8 μmol/L)的DMEM处理24 h;用于后续蛋白印迹法检测相关蛋白表达。
1.5 集落形成实验检测结肠癌细胞克隆形成能力
取“1.2”中处于对数生长期的RKO和HRT18细胞,以1×103个/孔接种于6孔板中。常规培养2周后,弃培养基,4%甲醛固定10 min,弃除固定液,每孔加入1 mL 0.2%结晶紫染色10 min,洗涤后光镜下计集落个数。
1.6 免疫印迹法检测结直肠癌细胞中相关蛋白的表达
收集“1.4”细胞,用含1%PMSF的RIPA裂解液冰浴裂解20 min;12 000 r/min,4 ℃离心10 min;取上清液,BCA法测定蛋白浓度;加入等体积SDS振荡均匀,99 ℃裂解5 min;80 V经SDS-PAGE分离蛋白;300 mA恒流转膜2 h,使蛋白转移至PVDF膜;5%脱脂牛奶封闭1 h;TBST洗膜3次;加入对应的一抗稀释液(LC3-Ⅱ、AMPK、p-AMPK、mTOR、p-mTOR为1 ∶1 000,GAPDH为1 ∶2 000),4 ℃孵育过夜;TBST缓冲液洗膜5次;加入HRP标记的羊抗兔或羊抗鼠二抗(2.5%脱脂奶粉稀释,稀释比为1 ∶5 000),室温孵育2 h;TBST洗膜5次;通过ECL显色液压片显影,得到的图片用电脑扫描,并用Image J软件进行灰度分析。
1.7 免疫荧光实验检测自噬体形成
取“1.2”中处于对数生长期的RKO和HRT18细胞,以2×105个/孔接种至预铺载玻片的12孔板,DMEM中培养24 h。按照Lipofectamine®3000操作说明,每孔加500 ng pQCXIP-GFP-LC3质粒,转染细胞6 h;加入PPA处理RKO细胞(0、0.6、0.7、0.8 μmol/L)和HRT18细胞(0、1.4、1.6、1.8 μmol/L),孵育24 h;4%多聚甲醛室温固定20 min;用含0.3% Triton X-100的PBS室温通透15 min;DAPI染色10 min;通过荧光显微镜检测GFP-LC3自噬体。
1.8 分子对接检测PPA与AMPK的结合能力
AMPK的三维结构在蛋白质数据库(Protein Data Bank)中编号为4CFF。α亚基为绿色,β亚基为蓝色,γ亚基为洋红色,配体PPA为红色。PPA的化学结构如图1所示。所有的对接实验运用AutoDock 4.2程序。在AutoDock 4.2计算程序中,采用0.375间隔的70×70×70点阵模块。使用Lamarckian遗传算法进行对接计算,算法如下:150的群体,最大值2 500万次能源评估,最高次数2 000,交叉率0.8,突变率0.02,独立对接运行50次。使用公差为2的均方根偏差将对接构象聚类,并根据结合自由能评估最终对接结构。
1.9 统计分析
2 结果
2.1 PPA显著抑制结直肠癌细胞活力
MTT检测结果显示,在RKO细胞和HRT18细胞中,与0 μmol/L组相比,PPA各浓度组细胞活力均显著降低(P均<0.05);由此说明,PPA抑制细胞活力。PPA在RKO细胞中处理24 h的IC50约为1.38 μmol/L,在HRT18细胞中约为2.89 μmol/L,据此筛选出0.6、0.7、0.8 μmol/L PPA用于RKO细胞后续实验,筛选出1.4、1.6、1.8 μmol/L PPA用于HRT18细胞后续实验。见图2。

a: P<0.05;b: P<0.01,与0 μmol/L PPA组比较
2.2 PPA对结直肠癌细胞克隆形成能力的影响
结果显示,与0 μmol/L组相比,RKO细胞中0.7、0.8 μmol/L PPA组细胞克隆数明显减少(t=5.677、10.035,P均<0.05);与0 μmol/L PPA组相比,HRT18细胞中1.6、1.8 μmol/L PPA 组细胞克隆数明显减少(t=14.362、17.443,P均<0.01)。由此可见,PPA在一定浓度范围内能够显著抑制RKO和HRT18细胞的克隆形成能力。见图3。

a:P<0.05;b: P<0.01,与0 μmol/L PPA组比较
2.3 PPA诱导结直肠癌细胞自噬
通过检测自噬标记物LC3脂化形式(LC3-Ⅱ)的表达变化可以初步确定细胞自噬[16]。免疫印迹结果显示,与0 μmol/L PPA相比,RKO细胞中0.6、0.7、0.8 μmol/L PPA组中LC3-Ⅱ蛋白表达水平明显增加(P<0.05或P<0.01),HRT18细胞中1.4、1.6、1.8 μmol/L PPA组中LC3-Ⅱ蛋白表达明显增加(P均<0.01)。由此可见,PPA能够诱导RKO和HRT18细胞中LC3-Ⅱ表达增加(图4),表明PPA促进自噬发生。为进一步证明PPA促进结肠癌细胞自噬,将pQCXIP-GFP-LC3质粒瞬时转染到RKO细胞和HRT18细胞中,结果显示,与对照组相比,PPA组细胞显示出绿色荧光斑点化聚集,表明LC3在结肠癌细胞中发生重新分布(图5)。由此表明,PPA诱导结直肠癌细胞发生自噬。

a:P<0.05;b: P<0.01,与0 μmol/L PPA组比较
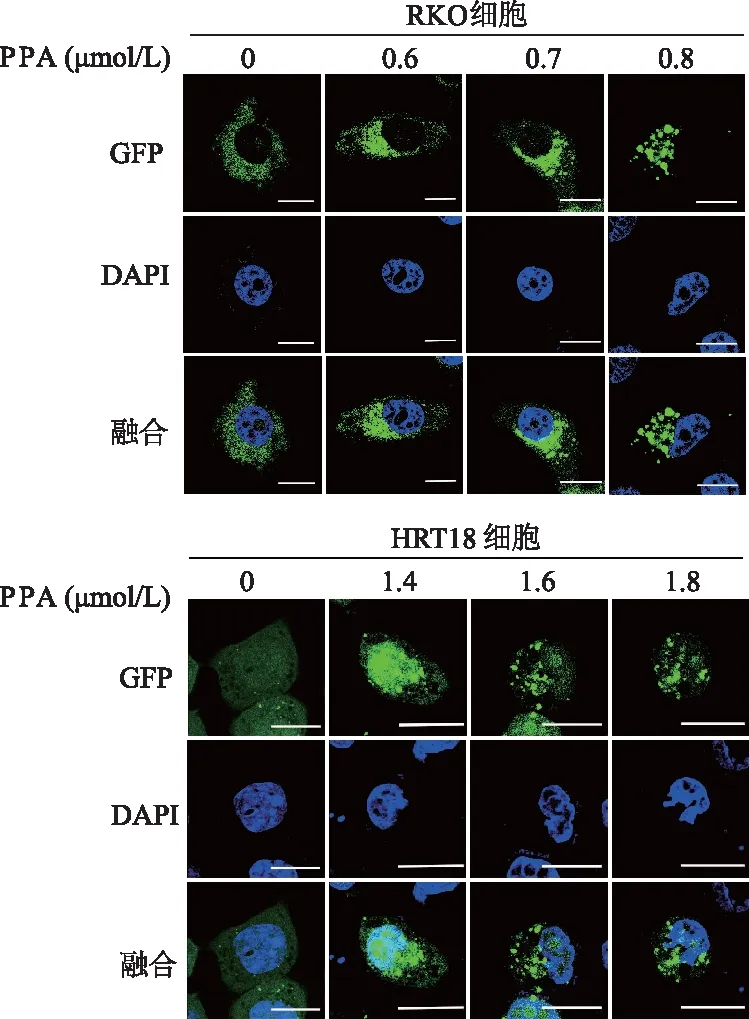
图5 免疫荧光检测自噬体分布状态(标尺=15 μm)
2.4 PPA激活结直肠癌细胞中自噬上游AMPK通路
免疫印迹结果显示,与0 μmol/L PPA相比,RKO细胞中0.6、0.7、0.8 μmol/L PPA组中p-AMPK表达水平显著升高(P<0.05或P<0.01),在0.7、0.8 μmol/L PPA组中,p-mTOR表达水平显著降低(P均<0.05);与0 μmol/L PPA组相比,HRT18细胞中1.4、1.6、1.8 μmol/L PPA 组中p-AMPK表达水平显著升高(P<0.05或P<0.01),在1.6、1.8 μmol/L PPA组中p-mTOR表达水平显著降低(P均<0.05)。由此可见,在一定浓度范围内,PPA可能通过促进结直肠癌细胞中AMPK活化,进而抑制其下游的重要信号分子mTOR活化。见图6。
2.5 PPA与AMPK具有结合作用
为进一步明确PPA对AMPK的激活作用,利用AutoDock 4将PPA与AMPK的三维结构进行分子对接。AMPK的α,β亚基中含有变构药物和代谢物结合位点,此位点主要由α亚基的催化激酶结构域和β亚基的碳水化合物结合调节模块构成[17]。PPA能够以-5.65 kcal/mol的键能与变构药物和代谢物结合位点结合(图7A)并且与结构域的多个氨基酸残基相互作用,包括:Val-24,Lys-29,Asn- 48,Gln-50,Lys-51,Arg-83,Ser-108,His-109,Asn-111和Ser-138(图7B)。值得注意的是,PPA上的羟基与Lys-29、Ser-108和Asn-111形成稳定结合的氢键,键长分别为2.7 Å、2.1 Å、3.0 Å。由此表明,PPA可以直接与AMPK结合。
3 讨论
研究发现,多种天然药物如紫草素[18]、苦参碱[19]等可通过激活自噬而抑制多种肿瘤生长。本研究通过MTT实验、克隆形成实验初步证明PPA能够抑制结直肠癌细胞增殖。LC3-Ⅱ是自噬体形成的关键组分[16]。本研究发现,不同浓度PPA均能够诱导结直肠癌细胞中LC3-Ⅱ蛋白表达增加;且GFP-LC3自噬体绿色荧光随PPA浓度增加,由弥散状态向斑点化聚集,由此表明PPA能够促进结直肠癌细胞自噬。而PPA对结直肠癌的抑制作用是完全还是部分通过诱导自噬途径完成,尚待进一步探讨。
能量代谢的关键调节分子AMPK亦是自噬调控的关键激活因子[20]。AMPK可通过直接激活ULK促进自噬活化,亦可通过抑制mTORC1通路而激活自噬[21]。研究发现,临床常用药物二甲双胍[22]、小檗碱[23]等可通过活化AMPK而诱导多种肿瘤细胞自噬性死亡。本研究选用不同浓度PPA处理结直肠癌RKO和HRT18细胞株,除0.6 μmol/L PPA处理的RKO细胞与1.4 μmol/L PPA处理的HRT18细胞中p-mTOR蛋白表达水平较对照组降低无统计学意义外,其他浓度PPA可显著上调中p-AMPK水平,并抑制mTOR活性,且呈现一定的浓度依赖性。由此推测,PPA可能通过AMPK/mTOR信号而诱导结直肠癌细胞发生自噬。进一步在分子对接模型中发现,AMPK的变构药物与代谢物的结合位点是PPA的首选结合位点。以往研究表明,几种AMPK激活剂,如A-769662[24]、水杨酸盐[25]和Compound-991[26]等可以直接与变构药物和代谢物的结合位点结合,并在肿瘤治疗中表现出较好的效果;它们可通过抑制Thr-172去磷酸化来直接活化AMPKα,也可以通过维持β亚基的构象来间接激活AMPKα。本研究发现,PPA与变构药物和代谢物的结合位点的多个氨基酸残基发生相互作用,包括:Val-24,Lys-29,Asn- 48,Gln-50,Lys-51,Arg-83,Ser-108,His-109,Asn-111和Ser-138。最重要的是,PPA上的羟基与Lys-29、Ser-108和Asn-111形成3个键长分别为2.7 Å、2.1Å、3.0 Å的稳定结合的氢键。Ser-108是β亚基自身磷酸化的位点,该位点的磷酸化有利于维持变构药物和代谢物的结合位点的稳定性和配体结合亲和力,从而维持AMPK α亚基Thr-172磷酸化,持续激活AMPK。总之,PPA与变构药物和代谢物的结合位点可以形成相对稳定的结合关系而直接激活AMPK。
综上所述,本研究发现天然化合物PPA能够直接与AMPK的变构药物和代谢物的结合位点结合而激活AMPK,从而诱导结直肠癌细胞自噬。
