中药济生散对肺癌细胞增殖、周期和凋亡作用的研究*
2021-07-14杨晓慧顾小侠
景 瑾,杨晓慧,刘 春*,顾小侠***
(1 南通大学杏林学院,南通 226200;2 南通大学实验动物中心;3 江苏省南通市中医院肿瘤科)
肺癌是世界范围内常见的恶性肿瘤之一[1]。抗癌药物在肺癌中的治疗必不可少,传统抗癌药物虽然应用广泛,但毒副作用、治疗效果等问题仍然存在,因此研发新型抗肺癌药物意义重大。在癌症治疗中,中医中药具有保护脏器、调节免疫功能、抑瘤抗癌、改善症状等作用[2]。济生散是南通市中医院肿瘤科经过二十多年临床研究,自创用于肺癌治疗的药方,临床疗效良好[3]。济生散中的主要中药成分有黄芪、沙参、太子参、蛇舌草、仙鹤草、莪术等。方中黄芪、沙参、太子参益气养阴;仙鹤草补虚扶正治本;蛇舌草清热解毒散瘤;莪术化淤治标。其作用机制有必要深入研究。
本研究通过济生散浓度梯度、时间梯度分别作用于人正常肺上皮细胞(BEAS-2B)、人肺腺癌细胞(A549、H1975),观察细胞形态变化,检测细胞增殖、周期和凋亡水平的变化,以期揭示中药济生散的抗癌作用机制,为济生散的临床应用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 BEAS-2B、A549、H1975 细胞购自中国科学院上海生科院细胞资源中心。
1.1.2 中药济生散 济生散方由南通市中医院中药房提供,主要成分:黄芪30 g、沙参15 g、太子参15 g、蛇舌草30 g、仙鹤草30 g、莪术10 g,常规煎煮成含生药2 g·mL-1,0.22 μm 滤膜过滤除菌,4 ℃保存备用,1 个月内用完。
1.1.3 主要仪器及试剂 CO2细胞培养箱购自Thermo 公司;倒置相差显微镜、光学显微镜购自Leica 公司;抗生素、0.25%胰蛋白酶-乙二胺四乙酸、0.25%胰蛋白酶购自Gibco 公司;胎牛血清、DMEM 基础培养基购自Hyclone 公司;培养瓶购自Corning 公司;细胞计数试剂盒8(cell counting kit 8,CCK-8)试剂盒、细胞周期与细胞凋亡检测试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒购自碧云天生物技术公司。
1.2 方法
1.2.1 细胞培养、传代和冻存 BEAS-2B、A549、H1975 细胞于37 ℃,5%CO2培养箱中常规培养;待细胞密度长至80%~90%后,细胞1∶3 传代或冻存。
1.2.2 济生散浓度梯度刺激BEAS-2B、A549、H1975细胞 待BEAS-2B、A549、H1975 细胞长至80%时,胰酶消化,离心去上清,细胞计数,以每孔5 000 个细胞100 μL 接种于96 孔板。细胞培养过夜,以磷酸缓冲盐溶液(phosphate buffered saline,PBS)为对照,以1、2、4、6、8、10、15、20 μL 济生散分别刺激细胞24 h,空白对照组只加入培养基不加细胞,药物对照组加培养基和10 μL 济生散不加细胞,每组设6个复孔取均值,实验重复3 次。在济生散刺激0、24、48、72 h 后,每孔加入10 μL CCK-8 溶液,继续培养4 h 后,在酶标仪A 450 nm 处测量各孔的吸光度值。
1.2.3 济生散时间梯度刺激BEAS-2B、A549、H1975细胞 每孔5 000 个细胞100 μL 接种于96 孔板。细胞培养过夜,以PBS 为对照,2 μL 济生散分别刺激细胞2、4、6、8、10、12、24 h 和不换液持续刺激。空白对照组只加入培养基不加细胞,药物对照组加培养基和2 μL 济生散不加细胞,每组设6 个复孔取均值,实验重复3 次。在济生散刺激0、24、48、72 h后CCK-8 法测细胞活力。
1.2.4 A549、H1975 细胞形态观察 取对数生长期细胞,胰酶消化,离心去上清,接种于6 孔板,细胞培养过夜,根据96 孔板和6 孔板的底面积以及培养基量换算选择32 μL 济生散浓度刺激A549、H1975 细胞8 h,以PBS 刺激为对照。培养24 h 细胞长至60%~70%时,弃完培,PBS 洗涤细胞2 次,倒置相差显微镜下观察拍照。
1.2.5 BEAS-2B、A549、H1975 细胞活力检测 每孔5 000 个细胞100 μL 接种于96 孔板。细胞培养过夜,以PBS 为对照,2 μL 济生散刺激细胞8 h,在济生散刺激0、24、48、72 h 后CCK-8 法测BEAS-2B、A549、H1975 细胞活力。
1.2.6 BEAS-2B、A549、H1975 细胞周期检测 取对数生长期细胞传代,贴壁,32 μL 济生散刺激8 h后,继续培养至对照组长至80%左右,胰酶消化,收集细胞。70%乙醇4 ℃固定2 h,离心,PBS 洗细胞1次。每管细胞样品中加入0.5 mL 碘化丙啶(propidium iodide,PI)染色液,37 ℃避光温浴30 min。流式细胞仪检测,每组细胞3 个复孔,重复3 次。
1.2.7 BEAS-2B、A549、H1975 细胞凋亡检测 取对数生长期细胞传代,贴壁,32 μL 济生散刺激8 h后,继续培养至对照组长至80%左右,胰酶消化,收集细胞。用凋亡试剂盒中的缓冲液重悬细胞,然后依次加入两种染液AV 和PI 各5 μL,并设3 个对照组,分别为空白单染PI、空白单染AV 及全空白组,室温下避光反应20 min,流式细胞仪检测。右上象限为晚期凋亡细胞和右下象限为早期凋亡细胞,每组细胞3 个复孔,重复3 次。
1.2.8 统计学方法 所有实验计量数据均采用STATA 16.0 统计学软件进行处理,应用GraphPad Prism 5 统计分析软件作图。数据结果以表示,采用配对t 检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 济生散浓度梯度对BEAS-2B、A549、H1975 细胞的影响 在BEAS-2B 细胞中(图1A),济生散刺激24 h 后,1、2 μL 组细胞活力较PBS 组显著上升(P<0.05),4、6、8、10 μL 组与PBS 组比较差异无统计学意义(P>0.05),15、20 μL 组较PBS 组显著下降(P<0.05)。济生散刺激48 h 后,2 μL 组细胞活力较PBS 组显著上升(P<0.05),1、4、6、8 μL 组与PBS 组比较差异无统计学意义(P>0.05),10、15、20 μL 组较PBS 组显著下降(P<0.05)。济生散刺激72 h 后,1 μL 组细胞活力较PBS 组显著上升(P<0.05),2、4、6、8、10 μL 组与PBS 组比较差异无统计学意义(P>0.05),15、20 μL 组较PBS 组显著下降(P<0.05)。
在A549 细胞中(图1B),济生散刺激24 h 后,济生散所有组细胞活力均较PBS 组显著下降(P<0.05)。济生散刺激48 h 后,1 μL 组细胞活力较PBS 组有所下降,但差异无统计学意义(P>0.05),其他组均显著降低(P<0.05)。济生散刺激72 h 后,济生散所有组细胞活力均较PBS 组显著下降(P<0.05)。
在H1975 细胞中(图1C),济生散刺激24、48、72 h 后,济生散所有组细胞活力均较PBS 组明显下降(P<0.05)。
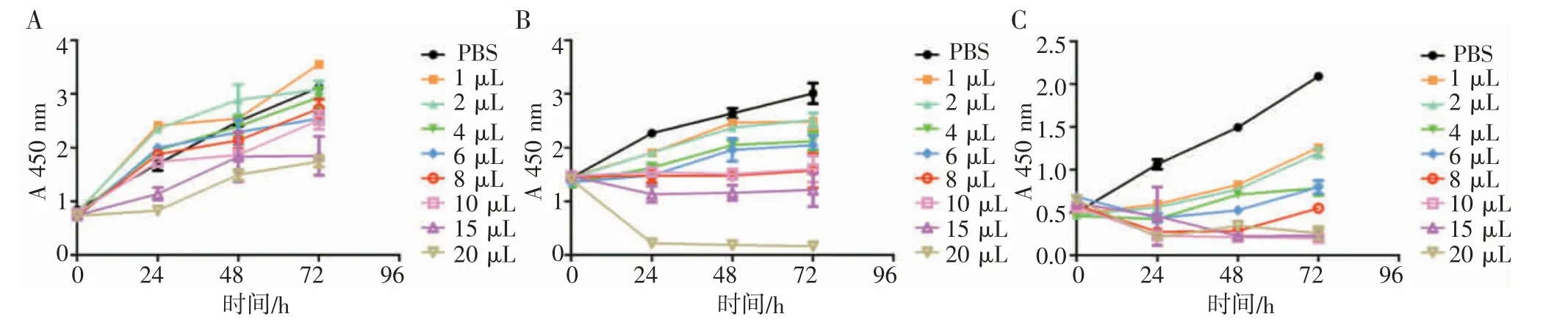
图1 济生散浓度梯度对BEAS-2B、A549、H1975 细胞活力的影响
2.2 济生散时间梯度对BEAS-2B、A549、H1975 细胞的影响 在BEAS-2B 细胞中(图2A),济生散2 μL刺激2、4、6、8 h 后,细胞活力有所上升(P<0.05);刺激10、12、24 h 后,细胞活力差异无统计学意义(P>0.05);若持续刺激至48、72 h 时,活力显著下降(P<0.05)。在A549 细胞中(图2B),济生散2 μL 刺激2 h 后,细胞活力差异无统计学意义(P>0.05);济生散2 μL 刺激4 h 后,细胞活力在48 h 和72 h 时显著降低(P<0.05);济生散2 μL 刺激6 h 及更长时间后,细胞活力显著下降(P<0.05)。在H1975 细胞中(图2C),济生散2 μL 刺激2 h 及更长时间后,细胞活力均显著下降(P<0.05)。

图2 济生散时间梯度对BEAS-2B、A549、H1975 细胞的影响
2.3 A549、H1975 细胞形态观察 中药济生散浓度煎至2 g·mL-1,32 μL 刺激A549、H1975 细胞8 h,以PBS 刺激为对照。培养24 h 后倒置相差显微镜下观察细胞形态,A549 细胞呈上皮样、多角形贴壁生长,H1975 细胞呈上皮样、长梭形贴壁生长,A549(图3)、H1975(图4)济生散组细胞数量显著减少,80%以上皱缩变圆,折光率发生变化,且贴壁不牢。

图3 相差显微镜下A549 细胞形态观察
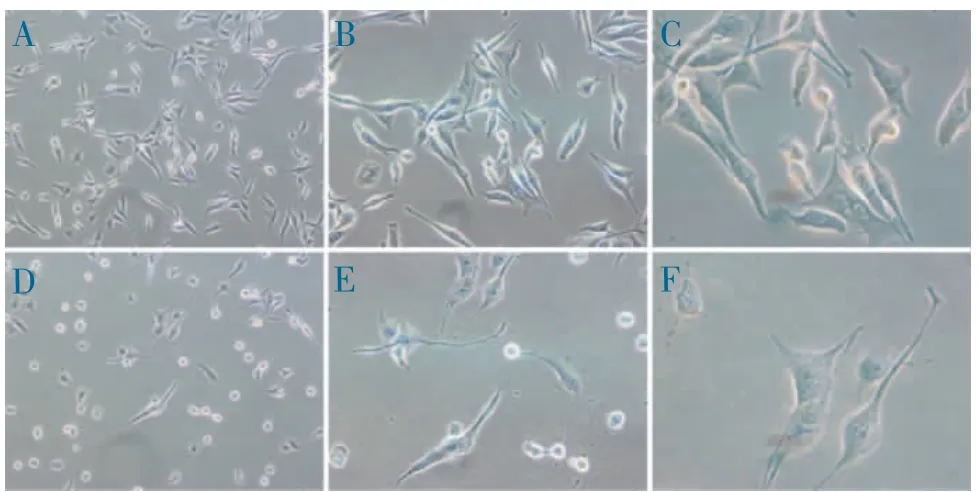
图4 相差显微镜下H1975 细胞形态观察
2.4 济生散对BEAS-2B、A549、H1975 细胞活力的影响 中药济生散浓度煎至2 g·mL-1,2 μL 刺激BEAS-2B、A549、H1975 细胞8 h,以PBS 刺激为对照,CCK8 法检测细胞增殖水平(图5)。结果显示:济生散处理后,BEAS-2B 细胞活力无影响,A549 和H1975 增殖水平均显著下降(P<0.05)。

图5 济生散对BEAS-2B、A549、H1975 细胞增殖的影响
2.5 济生散对A549、H1975 细胞周期的影响 PI单染流式细胞术分析济生散处理后BEAS-2B、A549和H1975 细胞周期中各时期的细胞百分数,BEAS-2B 细胞在济生散处理后无明显变化(图6A);A549细胞在济生散处理后(图6B),G1期细胞比例显著下降(P<0.05);S 期细胞比例显著上升(P<0.01);G2期细胞比例差异无统计学意义(P>0.05)。H1975 细胞在济生散处理后(图6C),G1期细胞比例显著下降(P<0.01);G2期、S 期细胞比例显著上升(P<0.01)。说明济生散可显著影响A549 和H1975 细胞的细胞周期分布,并使细胞周期阻滞于S 期。
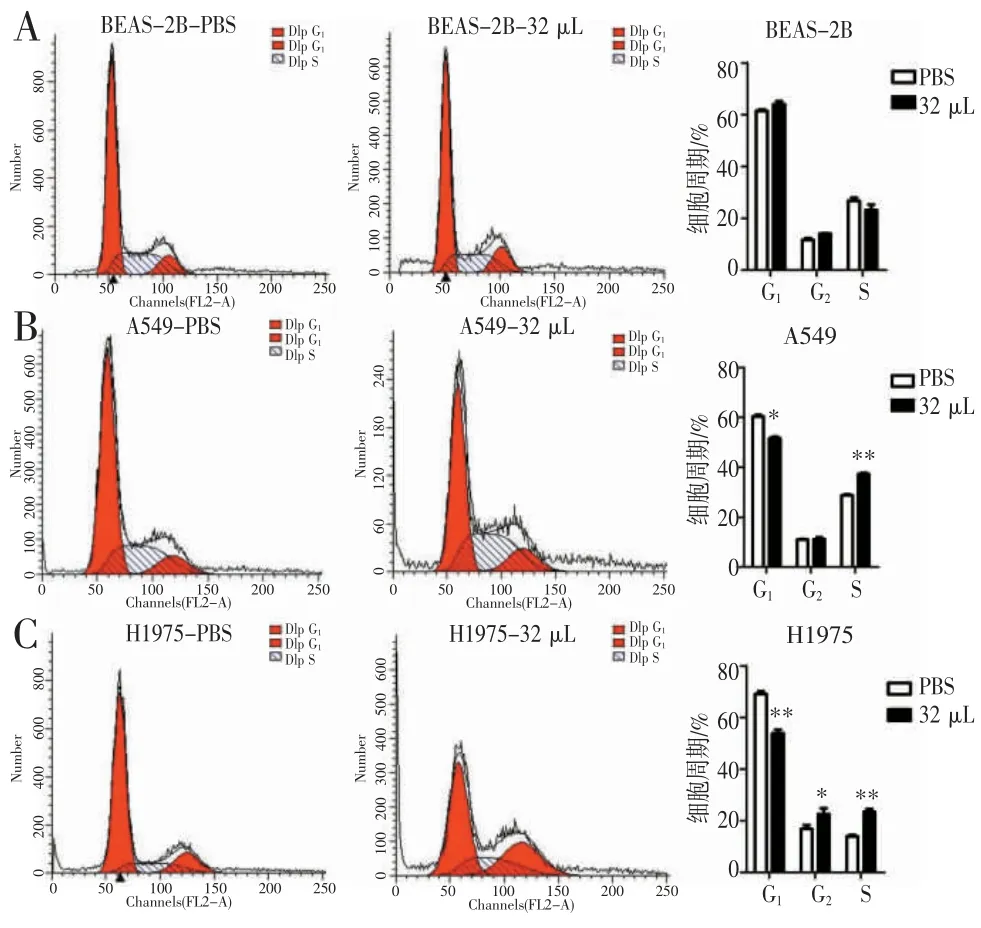
图6 济生散对BEAS-2B、A549、H1975 细胞周期的影响
2.6 济生散对BEAS-2B、A549、H1975 细胞凋亡的影响 通过流式分析检测发现,与PBS 组相比,济生散处理后,BEAS-2B 细胞无明显变化(图7A);A549细胞早期凋亡比例极显著上升(P<0.01)(图7B);H1975细胞的凋亡比例无论是早期凋亡还是晚期凋亡均显著上升(P<0.05)(图7C)。说明济生散可显著促进A549和H1975 细胞的凋亡。
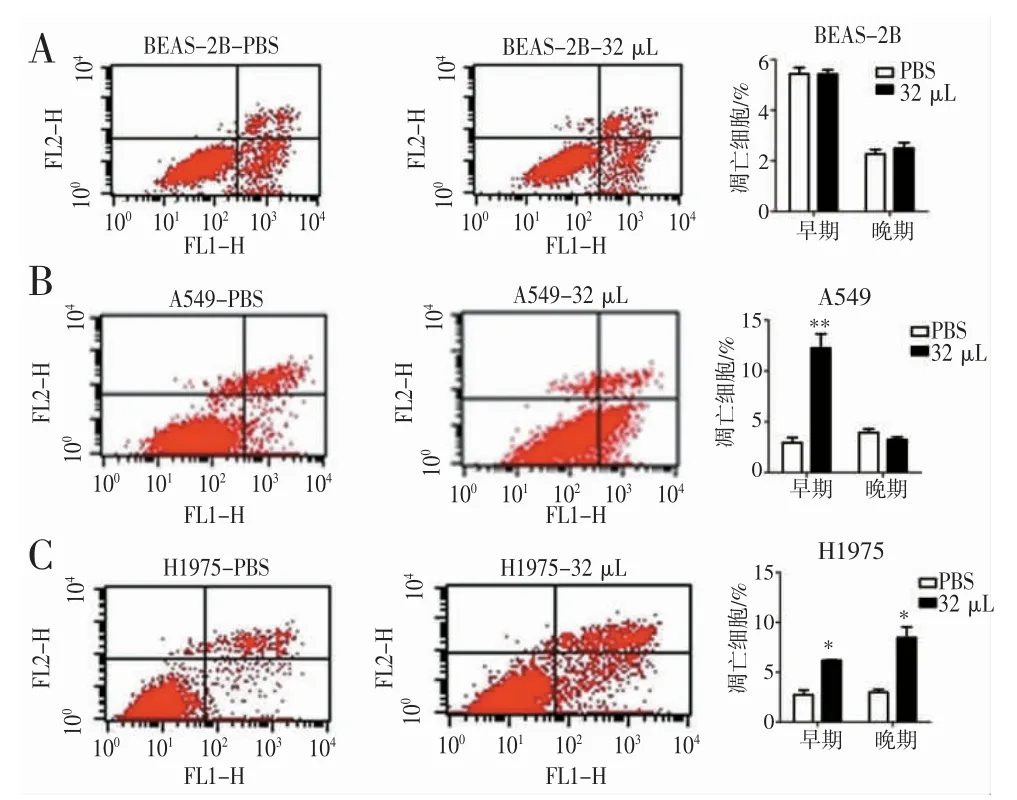
图7 济生散对BEAS-2B、A549、H1975 细胞凋亡的影响
3 讨 论
近年来,世界范围内肺癌死亡率呈增加趋势,且逐步成为死亡率上升最快的癌症[4]。目前,肺癌的主要治疗手段仍然是手术治疗、化疗放疗、靶向治疗、免疫治疗等,但其生存率仍不理想[5]。中医中药在我国已有千年历史,肺癌在中医学中属于“肺积”、“咳嗽”、“息贲”、“咯血”、“胸痛”、“肺岩”等范畴。肺癌患者主要症状有咳嗽、咯痰、疲倦、乏力、气促、口干、胸痛、头痛、头晕、纳呆、眠差等表现。中医在肺癌的治疗方面具有显著优势,就病因病理机制而言,肺癌是因虚得病,正虚不仅是肺癌发生的内因,也是肺癌之疾传变的重要因素。中医认为,肺为娇脏,喜润恶燥,邪毒蕴肺,极易耗伤肺气,灼伤肺阴,同时,肺癌患者常因手术、放疗、化疗及疾病本身的发展和恶化,严重耗竭人体的气血津液,故肺极易出现阴虚因素的证候。气阴亏虚贯穿肺癌发病始终,益气养阴是中医药治疗肺癌之本,也是目前的主要治法。
因此,中药扶正散瘤应贯穿肺癌治疗的始终。扶正以益气养阴为主,兼以补虚;散瘤以清热解毒兼以活血化瘀。南通市中医院肿瘤科自创济生散用于肺癌治疗,临床疗效良好[3],但其作用机制及影响因素有待进一步研究。
本研究以此济生散方煎剂用于细胞学试验观察,发现BEAS-2B 细胞在作用浓度<2 μL,时间<8 h时,细胞活力有所上升,这可能是由于本方所用药物多是天然药物,且有温补功效,促进了细胞的活力;当作用浓度>15 μL,时间延至48 h 时,细胞活力下降,这是因为剂量超过一定的限度,产生了毒副作用,引起细胞死亡。A549 细胞在济生散2 μL 刺激4 h 后,细胞活力会有所下降;H1975 细胞在济生散2 μL 刺激2 h 后,细胞活力下降。两种细胞产生效果的作用浓度和时间略有不同,但均可在低浓度和短时间内产生效果。最终确定选用2 μL 刺激8 h,对BEAS-2B 细胞无影响,但显著影响A549、H1975细胞的活力。细胞形态一定程度上也可反映细胞的状态,A549、H1975 济生散组细胞80%以上皱缩变圆,且贴壁不牢,说明济生散可显著影响A549 和H1975 的活力。
细胞增殖、周期和凋亡是细胞生命活动的基本过程,受到精准而复杂的调控。肿瘤正是由于细胞周期失控所引起的[6],正常细胞只在受到生长刺激信号或促分裂信号时才进行增殖,肿瘤细胞则是周期紊乱导致细胞增殖过多和凋亡过少。细胞增殖是生物体生长、发育、繁殖及遗传的基础。细胞凋亡则是生物体细胞主动消亡的过程,是维持机体平衡的关键。济生散可以帮助机体恢复自我调节能力,调整体内系统平衡。BEAS-2B 细胞在济生散作用后,增殖、周期和凋亡无明显变化,说明济生散在该浓度时间作用下,对正常细胞无显著影响。G1期是为DNA 复制做好物质和能量的准备,S 期是DNA 合成期,G2期合成RNA 和蛋白质。A549、H1975 细胞经济生散处理后,G1期细胞显著下降,物质和能量准备不足;S期、G2期细胞显著上升,阻滞于S、G2期,不能进行下一次的细胞分裂,减少细胞的增殖,导致细胞衰老死亡,从而抑制A549、H1975 细胞的生长。本研究亦发现济生散处理后A549、H1975 细胞活力显著下降,而凋亡水平显著上升,这与周期结果一致。提示济生散对肺癌生长有良好的抑制作用,在临床上具有较好的应用前景。但济生散是如何抑制细胞增殖促进细胞凋亡,能否影响及如何影响A549 和H1975细胞的迁移和侵袭等功能,还有待进一步研究。
