玉米胚芽植物蛋白饮料基料的工艺研究
2021-07-13张明丹彭丹丹刘亚楠黄继红
王 敏,张明丹,彭丹丹,刘亚楠,黄继红,刘 娜
河南工业大学 生物工程学院,河南 郑州 450001
胚芽是玉米生长和发育的开端,质量仅占玉米的11%~14%,约含有20%粗蛋白,必需氨基酸含量高,生物效价达到64%~72%[1-3]。玉米胚芽可作为优质蛋白质资源,在生产加工方面有广泛应用,宋春丽等[4]发现添加玉米胚芽蛋白的香肠出品率、质构、咀嚼度增加,黏着性减小;陆晓滨等[5]将At3942蛋白酶酶解玉米胚蛋白的酶解液添加到酱油中,酱油的色泽、体态、香气、滋味有明显提高;徐玉娟等[6]研发的玉米胚蛋白乳饮料营养丰富,感官评分可达到93.25,稳定性达96.92%。
近几年随着人们对营养需求的不断增加,植物蛋白饮料备受青睐,它们的生产开发是今后饮料工业发展的趋向[7-8]。作者以玉米胚芽粕为原料,生产一款玉米胚芽植物蛋白饮料基料。玉米胚芽粕虽营养丰富,但口感粗糙且柔韧性差,通过酶解可解决这一问题[9]。酶解过程可降低植物蛋白饮料基料的黏度,有效改善口感,同时提高玉米胚芽肽的含量,促进人体对蛋白的吸收[10-11]。玉米胚芽粕是玉米胚芽榨油后的主要副产品,研发玉米胚芽植物蛋白饮料基料,可以促使玉米胚资源全方位利用,并有效提升玉米胚蛋白利用的价值链。
1 材料和方法
1.1 材料与试剂
玉米胚芽:河南飞天农业开发股份有限公司;木瓜蛋白酶(10万U/g)、碱性蛋白酶(20万U/g)、酸性蛋白酶(5万U/g)、中性蛋白酶(5万U/g):河南万邦实业有限公司;三氯乙酸:上海吉至生化科技有限公司;胆汁提取物:润慧生物有限公司;胃蛋白酶、胰蛋白酶、没食子酸、芦丁、α-淀粉酶、DPPH:北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
TGL-16 M型高速离心机:鑫贝西科学仪器有限公司;台式OLB-100C恒温摇床:山东博科科学仪器有限公司;SPARK多功能酶标仪:瑞士TECAN;JY6002型电子天平:上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 样品的准备
玉米胚芽经CO2超临界萃取后,过100目筛(蛋白质含量18.5%),置于密封袋中干燥处储藏备用。
1.3.2 蛋白酶的筛选
在料液比1∶ 12(g/g)的物料中分别添加0.3%的木瓜蛋白酶、碱性蛋白酶、酸性蛋白酶和中性蛋白酶,并在最适温度的条件下水解3 h,以多肽含量、水解度和酶解液颜色为指标,挑选出试验的最适酶。
1.3.3 多肽含量的测定
参考文献[12-13]的方法,略有改动。分别取4 mL样品和4 mL 10%的三氯乙酸混合并静置10 min,离心,取全部上清液于25 mL 容量瓶中,用5%的TCA定容,取3.0 mL样液于10 mL离心管中,并添加双缩脲试剂2.0 mL,混匀静置,离心后于540 nm处测定吸光度。
1.3.4 单因素试验
参考文献[14]的酶解条件,略有改动。探究酶解时间(0、1、2、3、4、5、6 h)、酶的添加量(0、0.3%、0.6%、0.9%、1.2%)、料液比(1∶ 10、1∶ 12、1∶ 14、1∶ 16、1∶ 18、1∶ 20)和酶解温度(40、45、50、55、60 ℃)对酶解液多肽含量的影响,确定玉米胚芽植物蛋白饮料基料工艺的最佳条件。
1.3.5 响应面试验
根据 Box-Behnken 设计原理,在单因素试验的基础上进行响应面试验。
1.3.6 感官评价
对酶解玉米胚芽植物蛋白饮料基料的颜色(颜色深浅度、色泽是否均匀一致)、组织状态(质地是否均匀、是否有沉淀及杂质产生)和口感(是否产生异味、是否有颗粒感)进行评测。
1.3.7 体外模拟消化过程
1.3.7.1 模拟口腔消化
参考文献[15]的方法,略有改动。模拟唾液:准确称取 2.38 g 磷酸氢二钠、0.19 g 磷酸二氢钾、8.00 g 氯化钠和 0.91 g α-淀粉酶溶于1 L纯水,用磷酸盐缓冲溶液调节pH 6.75。
口腔消化过程:取4 mL玉米胚芽饮料基料和16 mL模拟唾液,充分混匀后,放入37 ℃摇床中振荡15 min。灭酶后置于离心机,12 000 r/min离心15 min,取上清液保存备用。
1.3.7.2 模拟胃液消化
参考文献[16-17]的方法,略有改动。模拟胃液:取2.0 g 氯化钠和3.2 g胃蛋白酶溶于950 mL纯水中,使用6 mol/L的HCl调节pH值为1.2后定容为1 L。
胃消化过程:取口腔消化液10 mL,用6 mol/L 盐酸调节pH值为1.2后加入50 mL模拟胃液。充分摇匀后置于37 ℃摇床中消化2 h,每隔30 min取出一定量的悬浊液,水浴灭酶、冷却。离心取上清液保存备用。
1.3.7.3 模拟肠液消化
参考文献[16-17]的方法,略有改动。模拟肠液:准确称取0.143 g胰蛋白酶和0.857 g胆汁提取物溶于100 mL 0.1 mol/L 的碳酸氢钠缓冲溶液中。
肠消化过程:取肠消化液10 mL,用0.1 mol/L碳酸氢钠溶液调节样液的pH值至6.0后,加入60 mL的模拟肠液。再分别加入2.5 mL 1 mol/L的NaCl和2.5 mL 1 mol/L的KCl。置于37 ℃摇床中消化180 min,每隔30 min取出一定量的悬浊液灭酶、冷却。离心取上清液保存备用。
1.3.8 功能活性成分的测定
1.3.8.1 总酚含量的测定
参考文献[18]的方法,略有改动。取0.2 mL消化液与1 mL福林酚试剂混匀,反应5 min 后加3 mL 7.5 % Na2CO3溶液混匀,遮光放置1 h后,于765 nm处测定吸光度,计算多酚含量,进行3次试验取平均值。总多酚含量通过没食子酸标准曲线定量。
1.3.8.2 总黄酮含量的测定
参考文献[18]的方法,略有改动。将1.0 mL消化液、2.5 mL纯水、150 μL 5%NaNO2溶液充分混合。室温下反应5 min后加入300 mL 10%Al(NO3)3,6 min后加入2 mL 4%NaOH溶液充分混匀,静置。在510 nm处测定吸光度。总黄酮含量通过芦丁标准曲线定量。
1.3.9 抗氧化能力的测定
参考文献[19-20]的方法,略有改动。取1 mg DPPH溶于24 mL甲醇溶液中,超声溶解,避光保存。同时将消化液配制成1 mg/mL。取1 mL DPPH溶液与0.5 mL稀释后的消化液混匀,在517 nm处测定吸光度。
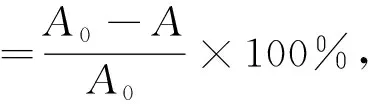
式中:A0为1 mL DPPH+0.5 mL甲醇溶液的吸光度;A为1 mL DPPH+0.5 mL稀释后的样品溶液的吸光度。
1.4 数据处理与分析
每组试验设计3次平行,使用SAS 9.2软件对数据进行分析,Origin 8.5软件绘图。
2 结果与分析
2.1 蛋白酶的筛选
由表1可知,木瓜蛋白酶酶解玉米胚芽,多肽含量相对较高,水解度最高,且对酶解液颜色影响最小,综合考虑选择木瓜蛋白酶为最适酶。

表1 蛋白酶的筛选Table 1 Screening of protease
2.2 单因素试验
多肽含量与酶解时间的关系如图1a所示。在温度50 ℃、初始pH 6、酶添加量0.6%、料液比1∶ 14的条件下,酶解时间为5 h时,多肽含量达到最高59.89 mg/mL,较酶解前(11.52 mg/mL)提高了48.37 mg/mL。当继续延长酶解时间到6 h时,多肽含量显著下降,原因可能是随着酶解时间的延长,底物含量会逐渐减少,酶促反应不会增加;同时活性肽被过度水解为无活性的肽和氨基酸[20]。
多肽含量与料液比的关系如图1b所示。在温度50 ℃、初始pH 6、酶添加量0.6%、酶解时间6 h的条件下,多肽含量随水分的增加而减少。料液比从1∶ 10变为1∶ 12时,多肽含量显著下降,料液比为1∶ 14时,多肽含量变化不显著。因为酶的比例下降,部分蛋白质的酶解反应可能不够彻底。从经济角度和玉米胚芽植物蛋白饮料的浓度考虑,选择料液比为1∶ 14。
多肽含量与酶添加量的关系如图1c所示。在温度50 ℃、初始pH 6、酶解时间6 h、料液比1∶ 14的条件下,随着木瓜蛋白酶添加量的增大,多肽含量也显著增加,当接种量为0.6%时,多肽含量达到最大值55.17 mg/mL,较原液提高了43.65 mg/mL。因为在一定条件内,酶添加量与酶促反应成正比,随着酶添加量的增加,酶解反应增加,且蛋白酶可以将不溶于水的蛋白水解成小分子肽[21]。当酶接种量继续增加时,多肽含量显著下降,原因可能是酶的添加量于底物浓度相对较高时,酶解反应的速度由底物浓度决定,同时酶能将原本具有活性的肽水解成没有活性的肽[22]。说明继续加大酶添加量不能使酶促进程加快,从经济角度衡量,选择酶添加量为0.6%。
多肽含量与酶解温度的关系如图1d所示。在料液比1∶ 14、初始pH 6、酶添加量0.6%、酶解时间6 h的条件下,当酶解温度小于50 ℃时,随着温度的升高,多肽含量显著增加(P<0.05)。表明在一定温度范围内,酶解温度与酶促反应成正比。温度较低时,酶活性较低,抑制了底物与酶的反应[23]。当酶解温度为50 ℃时,多肽含量达到最大值54.11 mg/mL。酶解温度继续升高,多肽含量显著减小,说明温度过高会使酶失活,降低了酶促反应。因此,木瓜蛋白酶酶解的最佳温度为50 ℃。

注:a、b、c、d分别为酶解时间、料液比、酶添加量、酶解温度对多肽含量的影响,不同的小写字母表示差异性显著(P<0.05)。图1 单因素试验结果Fig.1 Single factor test results
2.3 响应面试验
根据单因素试验结果,进行响应面试验设计,结果见表2。

表2 响应面试验设计与结果Table 2 Response surface design results
进行回归分析,获得拟合方程:Y=57.85-0.12X1+0.86X2+0.18X3-0.19X1X2+1.15X1X3+0.72X2X3-7.42X12-5.58X22-5.22X32。
由表3可知,模型的P<0.01,说明模型极显著;且失拟项P>0.05,R2=0.995 0,表明模型拟合效果好,误差小,可用于酶解制备玉米胚芽工艺条件的预测。3个因素中X2对玉米胚多肽含量的影响极显著,X1和X3没有显著性,影响顺序为X2>X3>X1,且X1和X3之间的交互作用极显著。由响应面得出的最优因素组合是酶解时间5.54 h、酶添加量0.62%、温度50.11 ℃。

表3 回归模型方差分析Table 3 Variance analysis of regression model
2.4 验证试验
优化得到的最优因素组合是酶解时间5.54 h,酶添加量0.62%,酶解温度50.11 ℃,此时多肽含量为55.72 mg/mL。综合实际情况,将条件修订为酶解时间5.5 h,酶添加量0.62%,酶解温度50 ℃。为了验证模型的准确性,在此条件下进行3次平行试验,得到多肽含量为57.92 mg/mL,与理论值55.72 mg/mL的相对误差为3.95%(小于5%),所以响应面优化得到的条件参数准确,具有可靠价值。
2.5 感官评价
由表4可知,经酶解的玉米胚芽植物蛋白饮料基料色泽、质地均匀一致,呈乳白色,且酶解后口感细腻,有醇香。

表4 酶解玉米胚芽植物蛋白饮料基料感官评价Table 4 Sensory evaluation of enzymatically hydrolyzed corn germ plant protein beverage base
2.6 功能活性成分

注:不同的大写字母表示未酶解和酶解样品有差异性,不同的小写字母表示同类样品差异性显著(P<0.05);N代表未消化,K代表口腔,W代表胃,C代表肠道,字母后的数字表示消化时间。图3、图4同。图2 体外模拟胃肠消化过程中玉米胚芽饮料基料中总酚含量的动态变化Fig.2 Dynamic change of total polyphenolic content in corn germ beverage base during in vitro simulated gastrointestinal digestion
由图2可知,酶解饮料基料从口腔(155.76 mg/L)经模拟胃液30 min(40.16 mg/L)消化后,酚类物质含量显著下降。原因可能是酶解后的玉米胚芽中的酚类物质主要以游离态存在,在过酸消化环境中由于缺乏固体底物保护,多酚物质更易于分解和转化,部分不稳定的多酚物质被氧化分解[23]。酶解饮料基料在肠道消化阶段(74.43 mg/L)显著高于胃消化阶段(38.84 mg/L)。有研究表明胃消化中的胰蛋白酶能促使羧基断裂从而使多酚失去束缚被释放出来[24]。同时在未消化和经胃肠道消化后,酶解饮料基料的总酚含量均显著高于未酶解饮料基料的总酚含量,分别为3.19倍和1.96倍。这与李兴[25]研究复配饮料体外消化多酚含量变化一致。
由图3可知,酶解饮料基料从口腔(220 mg/L)经模拟胃液30 min(89.44 mg/L)消化后总黄酮含量显著下降。原因可能是在肠道消化中总黄酮含量与肠道中的环境有关,首先,黄酮物质可能与肠道消化道中某些成分(如盐、酶等)结合形成一些不溶性物质。其次,胃肠道中的温度和pH值也会影响黄酮的结构。酶解饮料基料在肠道消化阶段(146 mg/L)显著高于胃消化阶段(87.56 mg/L)。可能是胃消化液中的胰酶能释放黄酮与淀粉、蛋白质等大分子结合形成复合物[24]。同时在未消化和经胃肠道消化后,酶解饮料基料的总黄酮含量均显著高于未酶解饮料基料的总黄酮含量,分别为1.88倍和1.76倍。这与Gawlik-dziki等[26]研究添加荞麦小麦面包和未添加荞麦小麦面包体外消化总黄酮含量变化一致。

图3 体外模拟胃肠道消化过程中玉米胚芽饮料基料中总黄酮含量的动态变化Fig.3 Dynamic change of total flavonoids content in corn germ beverage base during in vitro simulated gastrointestinal digestion
2.7 体外消化抗氧化性
由图4可知,酶解饮料基料从口腔(73.58%)经模拟胃液30 min(37.11%)消化后DPPH自由基清除率显著下降。一方面酶解液中的抗自由基活性物质被氧化和分解,从而失去活性;另一方面胃液环境的变化可能影响抗自由基活性物质的结构、从而影响其与DPPH间的相互作用[23]。酶解饮料基料在肠道消化阶段(56.64%)显著高于胃消化阶段(41.56%)。可能是在肠道消化过程中DPPH自由基与暴露出的疏水性氨基酸侧链结合[27]。同时在未消化和经胃肠道消化后,酶解饮料基料的DPPH自由基清除率均显著高于未酶解饮料基料的DPPH自由基清除率,分别为2.11和2.05倍。这与刘燕[23]研究双菌发酵燕麦和未发酵燕麦DPPH自由基清除率变化一致。
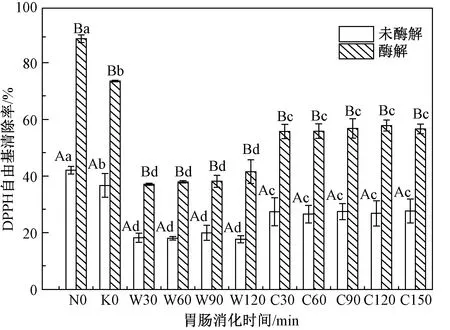
图4 体外模拟胃肠道消化过程中玉米胚芽饮料基料DPPH自由基清除率的动态变化Fig.4 Dynamic change of DPPH radical scavenging rate of corn germ beverage base during in vitro simulated gastrointestinal digestion
3 结论
通过响应面试验优化玉米胚芽植物蛋白饮料基料的工艺条件,得到最佳工艺:料液比1∶ 14、酶解时间5.5 h、酶添加量0.62%、酶解温度50 ℃,此时多肽含量为57.92 mg/mL。经酶解后,玉米胚芽植物蛋白饮料基料口感风味更佳,营养丰富。以玉米胚芽植物蛋白饮料基料为原料,模拟体外消化实验,发现经胃肠消化后总酚、总黄酮含量和DPPH自由基清除率均显著下降,但均显著高于未酶解玉米胚芽植物蛋白饮料基料,分别为1.96、1.76、2.05倍,表明经酶解后抗氧化性增强。通过玉米胚芽植物蛋白饮料基料的研发可以增加玉米的附加值,提高玉米的综合利用率。
