酵母甘露聚糖(20 kDa)的生物安全性及体内分布研究
2021-07-13付乾振王佳奇王子朝张慧茹
付乾振,王佳奇,樊 坤,刘 洁,王子朝,张慧茹
河南工业大学 生物工程学院,河南 郑州 450001
多糖具有抗癌、抗氧化、提高免疫力[1-3]等作用,并且能辅助治疗肾脏、胃肠道、肝脏以及中枢神经系统的疾病。多糖的药理学作用研究起步较晚,主要局限于多糖的生物效应[4-5],对其药物代谢动力学研究较少[6]。多糖是亲水性大分子,其体内分布吸收和作用机制有待完善[7]。此外,已有研究表明,分子量也是影响多糖生物活性的主要因素之一[8-9],大多数用于抗癌药物前体的多糖分子质量为25~50 kDa,与多糖的抗癌活性和药物代谢动力学行为密切相关[10],并且不同分子量的多糖在动物体内表现出不同的组织分布[11]。因此,以分子量为切入点,研究低分子量多糖的体内稳定性和药物吸收代谢分布,有助于了解多糖在机体内的作用机制。
酵母甘露聚糖的主链由甘露糖以α-1,6糖苷键形成的长链组成,是酵母细胞壁外层具有多种生物活性的多糖聚合物,是目前发现的免疫功能最强的细胞壁多糖,能显著增加机体免疫力、刺激肠道益生菌生长、抑制和减少病原菌等[12-13]。因此,以酵母甘露聚糖为实验材料,研究其生物安全性及在小鼠体内的吸收及分布情况,为低分子量酵母甘露聚糖在食品医疗等领域的开发提供基础数据。
1 材料与方法
1.1 材料
酵母甘露聚糖:西安百川生物科技有限公司;磷酸缓冲液、氢氧化钠、浓硫酸、苯酚、二甲基亚砜、葡萄糖:上海麦克林生化科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐:上海阿拉丁生化科技有限公司;抗凝剂、生理盐水:上海恒远生物科技有限公司;胰酶、乙二胺四乙酸、胎牛血清、DMEM培养基、青链霉素混合物:赛默飞世尔科技(中国)有限公司。
1.2 仪器与设备
GA-3血糖仪:上海罗氏制药有限公司;TDL-5-A离心机:上海安亭科学仪器厂;BDF-86V158超低温冰箱:山东博科生物产业有限公司;YS-840-2超净工作台:上海箐海仪器有限公司;BCD-221EMK3A冰箱:河南新飞电器有限公司;Well scan MK Ⅱ酶标仪:美谷分子仪器有限公司;HH-6数显恒温水浴锅:常州亿通分析仪器制造有限公司;XSP-15TZ倒置显微镜:上海光学仪器厂;FA1 004 N电子天平:上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 体外生物安全性检测
1.3.1.1 细胞毒性检测
参照姜宏伟[14]的方法并稍加改进。取10 mL胎牛血清、1 mLL-谷氨酰胺、1 mL非必需氨基酸、1 mL青链霉素混合液于87 mL的DMEM高糖培养基,0.22 μm滤膜过滤除菌,作为完全细胞培养液。用完全细胞培养液配制成质量浓度为10、20、40、80、160 μg/mL的酵母甘露聚糖溶液。
取对数生长期的Caco-2细胞消化离心,采用细胞计数法计数,96孔板中每孔接种8 000个Caco-2细胞,培养24 h后,弃去培养液,PBS洗两次。每孔加入不同质量浓度梯度的多糖溶液200 μL,每个梯度设5个重复,用不含多糖的细胞培养液做空白对照。于37 ℃培养箱中孵育24 h后,加MTT(5 mg/mL,pH 7.4)20 μL继续孵育4 h。小心吸取孔中所有液体后加入150 μL DMSO,振荡10 min后,检测490 nm处溶液的吸光度。
细胞增殖率=OD1/OD2×100%,
式中:OD1为实验组的吸光度;OD2为空白对照组的吸光度。
1.3.1.2 酵母甘露聚糖的溶血性检测
参照樊坤等[15]的方法并稍加改进。取小鼠血加入肝素钠抗凝管,上下轻轻混匀,加生理盐水,1 000 r/min离心10 min,弃去上清液及白细胞层,再用生理盐水冲悬红细胞,重复离心3次。用生理盐水配制20%红细胞母液。精确称取1 mg酵母甘露聚糖,溶于1 mL生理盐水,得到1 mg/mL多糖母液。
在微量离心管中分别加入40、32、24、16 μL多糖母液,均与10 μL红细胞母液混合均匀,用生理盐水补足至200 μL,得到质量浓度为200、160、120、80 μg/mL的多糖、红细胞反应体系。阴性对照用生理盐水190 μL与10 μL红细胞母液混匀,阳性对照用190 μL蒸馏水与10 μL红细胞母液混匀。各组均设置5个重复。置于37 ℃培养箱孵育30 min后,离心2 min,吸取100 μL上清液于96孔酶标板中,检测540 nm处的吸光度。
溶血率=(OD1-OD3)/(OD2-OD3)×100%,
式中:OD1为实验组的吸光度;OD2为阳性对照组的吸光度;OD3为阴性对照组的吸光度。
1.3.2 多糖体内分布实验
1.3.2.1 葡萄糖的标准曲线
参照李传民[16]的葡萄糖标准曲线制作方法,配制质量浓度为100 mg/mL的葡萄糖标准溶液,将其分别稀释为0.012、0.024、0.048、0.097、0.195、0.390、0.780、1.560、3.125、6.250、12.500、25.000、50.000 mg/mL的溶液,将梯度稀释的葡萄糖标准溶液用苯酚-硫酸法反应20 min后进行测定。以蒸馏水溶液为空白对照,于490 nm处测定吸光度。以葡萄糖标准溶液质量浓度为横坐标,吸光度为纵坐标,绘制葡萄糖标准曲线,获得线性回归方程,计算肠道、内脏组织中的糖含量。
1.3.2.2 小鼠灌服及血糖含量测定
购买个体匀称、发育良好的SPF级KM小鼠(来自郑州大学动物实验中心,实验动物生产许可证编号为SCXK(豫)2017-0001)若干,在实验动物房饲养3~5 d使其适应环境。实验前一天晚上对小鼠进行断食、不断水处理。第二天称质量、分组,小鼠体重在24~26 g之间。实验组按照100 mg/kg小鼠体重的剂量灌服多糖,空白组灌服等量生理盐水。灌服后,于0、15、30、45、60、75、90、105、120 min,用GA-3血糖仪检测血糖值。
1.3.2.3 小鼠脏器糖含量的测定
分别于灌服后1、2、3 h,取空白组和实验组小鼠进行解剖,取心、肝、脾、肺、肾等脏器,称质量后,取心脏0.15 g、肝脏0.50 g、脾脏0.07 g、肺0.20 g、肾0.40 g于离心管中,与1 mL蒸馏水研磨混匀离心(12 000 r/min、10 min)之后,收集上清液。利用苯酚-硫酸法检测各脏器中糖含量。以空白小鼠的脏器糖含量做对照,计算各脏器中的糖量,分析多糖随时间在各脏器中的分布情况。
1.3.2.4 小鼠肠道糖含量的测定
灌服后,每隔30 min(即灌胃后的30、60、90 min)解剖小鼠。取含肠内容物的十二指肠、空肠、回肠于离心管中,取十二指肠0.15 g、空肠0.50 g、回肠0.30 g,与1 mL蒸馏水混匀离心(12 000 r/min、10 min)之后,收集上清液。利用苯酚-硫酸法检测各肠段中糖含量,以空白小鼠的肠道做对照组,计算残留在肠道中未吸收的糖量,分析多糖随时间在肠道中的流动和分布情况。
1.3.3 统计与分析
实验数据经Excel 2010整理后,采用SPSS软件进行ANONA显著性检验,并采用Duncan多重比较,分析各组之间的差异性。P<0.05表明差异显著,P<0.01表明差异极显著。使用Origin软件作图。
2 结果和讨论
2.1 酵母甘露聚糖对细胞的毒性
采用MTT方法检测不同质量浓度的酵母甘露聚糖对Caco-2细胞生长的影响,结果如表1所示。不同质量浓度的酵母甘露聚糖对细胞的生长没有明显影响(P>0.05)。当酵母甘露聚糖的质量浓度为10、80 μg/mL时,细胞的增殖率分别为97.17%和98.98%,其他质量浓度的酵母甘露聚糖则对细胞有轻微的促增殖作用,当质量浓度为160 μg/mL时,对细胞的增殖率促进效应最强,为115.60%,说明酵母甘露聚糖对细胞不仅无毒,还有轻微的促增殖作用。

表1 酵母甘露聚糖对细胞增殖的影响Table 1 Effect of mannan on the proliferation of Caco-2 cells
2.2 酵母甘露聚糖的溶血性检测
酵母甘露聚糖的溶血性变化如图1所示。图1表明:糖质量浓度对细胞溶血性影响较大(P<0.01)。多糖质量浓度为80、160、200 μg/mL,溶血率均为负值,略有凝血作用,多糖质量浓度为120 μg/mL时,溶血性为正值,但远远低于药典中规定的5%的溶血性,符合生物使用安全。因此,当该多糖溶液进入血液时,对机体无溶血性影响。

注:**表示差异显著(P<0.01)。图1 酵母甘露聚糖的溶血性变化Fig.1 Hemolytic change of mannan
2.3 葡萄糖质量浓度的标准曲线
葡萄糖质量浓度的标准曲线如图2所示。葡萄糖质量浓度与吸光度的线性回归方程:y=0.022 7x+0.050 7,R2=0.988 7。根据该方程计算肠道、脏器中的糖含量。

图2 葡萄糖质量浓度标准曲线Fig.2 Standard curve for glucose
2.4 酵母甘露聚糖对血糖的影响
酵母甘露聚糖对血糖的影响见图3。由图3可知,实验组和空白组的初始血糖值为3~4 mmol/L,空白组的血糖含量在前105 min时始终明显低于实验组。灌胃酵母甘露聚糖后,实验组小鼠血糖迅速上升,至45 min达到高峰,其原因可能为酵母甘露聚糖进入胃肠中后,被肠道酶分解、吸收入血,导致的血糖迅速升高,而后在胰岛素的作用下血糖逐渐降低。部分酵母甘露聚糖进入胃肠道,这与Hu等[17]研究亚洲车前草多糖的消化情况具有相似性。而Li等[18]在研究铁皮石斛多糖口服后,发现铁皮石斛多糖并不能被胃肠道消化吸收,主要调节肠道菌群。

图3 小鼠血糖变化Fig.3 Change of blood glucose in mice
2.5 酵母甘露聚糖对小鼠内脏糖含量的影响
由图4可知,血流量较大的肝脏中糖含量明显高于其他脏器。在灌胃后1 h,肝糖含量明显升高,而后逐渐下降;肺组织中糖含量也有类似的趋势;肾脏中糖含量明显高于心脏的糖含量,但肾和心脏中糖含量随时间的变化不大;脾中的糖含量随时间下降。

图4 小鼠内脏糖含量的分布变化Fig.4 Change of sugar content in mice organs
由图5可知:内脏中糖含量随时间延长而减少;灌胃后1 h,内脏糖含量提高,随后逐渐下降;肝脏中的糖含量是所有内脏中糖含量最高的,这与郑子明[19]在研究香菇多糖的药物代谢动力学时,具有相似性。多糖进入血液后,迅速集聚于肝脏,导致肝脏中糖含量较高。推测是酵母甘露聚糖形成了肝糖原储存在肝脏中,这还有待进一步实验证明。
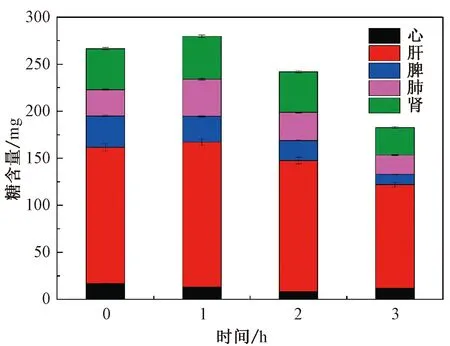
图5 小鼠内脏糖含量变化Fig.5 Distribution of total glucose content in mice organs
2.6 酵母甘露聚糖在小鼠肠道中的流动变化
由图6可知,十二指肠中的糖含量总是低于空肠和回肠,可能是糖快速流过十二指肠,所以残存在十二指肠的糖含量较低;随着实验时间的推进,糖到达空肠,灌服30 min后空肠中糖含量较高,直至60 min左右时,酵母甘露聚糖到达回肠,造成回肠的糖含量升高。有研究报道,糖类化合物在肠道消化吸收的主要部位是空肠和回肠[20]。因此推测酵母甘露聚糖通过口服被肠道吸收后,其主要吸收场所是空肠和回肠。

图6 小鼠肠道糖含量变化Fig.6 Change of sugar content in mice intestine
由图7可知:灌胃后30 min肠道糖含量增加,60 min肠糖含量最低,90 min反而稍有升高。推测肠道糖含量的变化是几个糖去向的总和:①从肠黏膜将糖吸收入血,减少肠道中糖含量;②未吸收的糖仍能少量增加肠糖含量;③可能存在类似药物外排机制的多糖外排效应,从肠道细胞中外排多糖到肠腔中。结合血糖变化认为:酵母甘露聚糖(20 kDa)一部分可在肠道被吸收入血,分布在各脏器;另一部分随肠道流动到空肠、回肠,排到盲肠、结肠,可能参与肠道菌群益生菌群的调节[21],这也是下一步实验的内容。

图7 小鼠肠道中糖含量变化Fig.7 Distribution of total sugar content in mice intestine
3 结论
研究结果表明:酵母甘露聚糖(20 kDa)有轻微促进细胞增殖作用;对细胞溶血率均在生物安全范围内。酵母甘露聚糖(20 kDa)具有明显的升高血糖的作用,在45 min时血糖质量浓度达到最大值,然后降低;吸收入血后分布于各个器官,肝脏的糖含量始终较高;肠道中酵母甘露聚糖随肠道流动,主要在回肠和空肠部分被吸收。研究结果有助于了解多糖在机体内的吸收分布机制,为多糖的研发提供基础数据。
