海带多糖通过促进Sirt3/MnSOD表达来改善受照射后小鼠的下颌下腺损伤
2021-07-13张思琴陈少勇王绍军
张思琴,敖 翩,陈少勇,柴 溶,王绍军,韦 力,徐 杨,陈 晨
(1.广西医科大学口腔医学院,南宁 530021;2.广西壮族自治区妇幼保健院,南宁 530021;3.广西医科大学人体解剖学教研室,南宁 530021)
放射疗法是一种主要用于头颈部恶性肿瘤治疗的有效方法,在杀死肿瘤细胞的同时却不可避免的会对其周围的正常组织也造成不同程度的损伤[1]。口干症是其最常见的并发症,它会引起一系列的不良后果,包括龋齿、吞咽困难、味觉障碍、粘膜感染等,严重影响了头颈部放疗患者的生活质量[2]。但是,目前临床上的治疗方法仍然是治标不治本,未能取得令人满意的效果。研究表明,辐射会诱导活性氧自由基的产生,从而引起组织的氧化应激损伤和功能障碍[3-4]。因此,寻求一种天然有效无害的抗氧化药物具有重要的临床意义。海带属于褐藻纲海带科的植物,中医入药时称作昆布,有软坚化痰、利水泄热等多种药用价值,其多种生物活性主要与多糖成分有关。有研究报道,海带多糖(laminaria japonica polysaccharide,LJP)具有抗肿瘤[5]、降血脂[6]、清除氧自由基和抗炎等[7]多种生物学功能。本课题组前期研究发现LJP对受照射后小鼠的脑损伤具有保护作用[8],因此,本研究拟建立放射性唾液腺损伤的小鼠模型,旨在观察LJP干预后唾液腺功能以及下颌下腺中与氧化应激有关的重要基因——沉默信息调节因子3(Sirtuin3, Sirt3)和锰超氧化物歧化酶(Manganese superoxide dismutase, MnSOD)的表达,探讨LJP对放射性下颌下腺损伤的防护作用及机制的研究,以期为未来防治放射性口干症提供新的理论依据。
1 材料与方法
1.1 材料
1.1.1实验动物
将购于广西医科大学实验动物中心的SPF级8周龄雌性昆明小鼠,体重(30±2)g,放于12 h光照和12 h黑暗的交替环境下饲养,正常摄食和饮水,室温(25±2)℃,湿度45%~55%,定期检测环境卫生,适应性饲养1周后开始进行实验,动物生产许可证号:SCXK(桂)2014-0002。本实验经广西医科大学动物伦理委员会批准,严格遵守国家有关实验动物伦理学和使用准则。
1.1.2主要试剂及仪器
LJP购于美国Sigma公司(批号:SLBM6723V,纯度≥98%);兔抗MnSOD多克隆抗体(批号:ab13533)、兔抗Sirt3单克隆抗体(批号:ab86671)、辣根过氧化物酶(HRP)标记的山羊抗兔二抗(批号:ab6721)、DAB试剂盒(批号:ab64264),均购自英国Abcam公司;通用RNA提取试剂盒(批号:9767)、反转录试剂盒(批号:R036A)、定量试剂盒(批号:R820A),均购于大连TaKaRa公司;电子分析天平(北京赛多利斯,型号:BSA124 S);60Co远距离治疗机(中国核动力研究设计院,型号:CWXJ80);光学显微镜(日本Olympus公司,型号:DP80)。
1.2 方法
1.2.1LJP准备
临用前称取0.4 g LJP粉剂溶于40 mL 0.9%NaCL中,配制成浓度为1%的LJP溶液,锡箔纸包裹于瓶外,于4 ℃避光保存。
1.2.2动物分组及处理
采取随机数字表法将小鼠分为对照组(Control group, Con)、LJP组(LJP group, LJP)、单纯照射组(Irradiation alone group, IR)和照射+ LJP组(Irradiation plus LJP group, IR+LJP),5只/组。给予LJP组和照射+LJP组小鼠腹腔注射LJP[100 mg/(kg·d)][9],每天一次,于照射前3 d开始持续到照射后4 d;对照组和单纯照射组小鼠给予等同容积生理盐水注射。在进行60Co γ射线照射之前,先用1%戊巴比妥钠(45 mg/kg)进行腹腔注射。参照已发表的照射方法[10],将已麻醉的小鼠仰卧位固定于自制的放疗定位罩模具中,仅将小鼠头颈部暴露于照射区域,照射源与体表距离为80 cm,剂量率1 250 cGy/min,身体其他部分均被12 mm厚的铅板所保护。单纯照射组和照射+LJP组小鼠接受一次性15 Gy的照射剂量,而对照组和LJP组小鼠麻醉后置于同样环境中,接受0 Gy的照射剂量。
1.2.3唾液收集
于照射结束后28 d将各组麻醉的小鼠给予0.02%毛果芸香碱(0.2 mg/kg)颈部皮下注射,注射完成后立即将3~5个预先称重的小棉球放入小鼠口内舌下,15 min后用镊子立即将小棉球从口内取出,放于归零的精密天平称重,并计算出唾液分泌的总重量。最后,将所得的每只小鼠唾液分泌量按照其体重进行标准化处理。
1.2.4HE及免疫组化染色
将唾液采集完成的小鼠进行安乐死并收集下颌下腺组织(Submandibular gland, SMG)。将取下的颌下腺组织固定在10%中性福尔马林中,24 h后进行石蜡包埋。将蜡块切成5 μm厚的组织切片用于HE和免疫组化染色。
将柠檬酸盐缓冲液(pH值为6.0)修复(98 ℃水浴5 min)后的切片用PBS清洗(5 min×3 次),再用5%牛血清室温封闭20 min后,给予一抗Sirt3和MnSOD(稀释浓度均为1∶150),4 ℃过夜,第2 d用PBS洗5 min×4 次后,滴加山羊抗兔二抗(1∶500),室温孵育 1.5 h,DAB显色。
1.2.5实时荧光定量PCR
按照其说明书步骤提取下颌下腺组织的总RNA,然后将其逆转录成cDNA,在冰上配置实时PCR反应体系,每个反应体系的总体积为25 μL,其中引物由TaKaRa生物公司合成,序列见表1。使用Applied Biosystems Step One实时荧光定量PCR仪,设置如下反应条件:95 ℃预变性30 s一个循环,95 ℃ 5 s,60 ℃ 30 s, 共40次循环。用2-△△Ct的方法计算Sirt3和MnSOD基因的相对表达量。
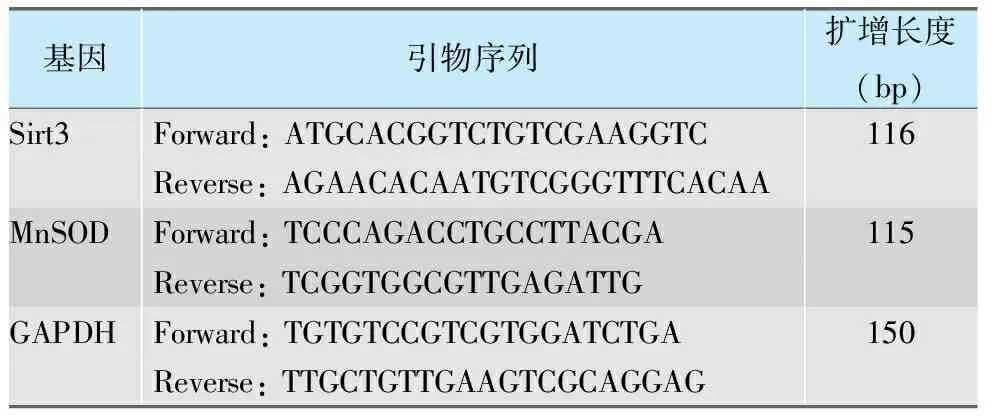
表1 引物序列
1.2.6统计学方法
采用SPSS 22.0和GraphPad Prism 7.0软件分别对所得实验结果进行统计学分析和制图,以均值±单次测量标准差表示,多组间比较采用One-Way ANOVA,先进行方差齐性检验,若方差齐,用SNK法进行分析;若不齐,则采用Dunnet’t3法进行分析,p<0.05为差异有统计学意义。
2 结果
2.1 小鼠唾液流量的比较
结果示于图1。由图1可见,与对照组比较,单纯照射组小鼠唾液流量降低(p<0.05);与单纯照射组比较,LJP组及照射+LJP组唾液流量均明显升高(p<0.05)。

注:*与对照组比较,p<0.05;▲与单纯照射组比较, p<0.05。
2.2 下颌下腺组织镜下观察
图2为各组小鼠下颌下腺组织镜下观察结果。由图2可见,对照组小鼠下颌下腺镜下显示其导管腺泡结构正常,排列整齐;单纯照射组下颌下腺镜下显示腺泡导管结构损伤破坏,不完整,可见空泡化,而给予LJP干预后照射小鼠颌下腺组织结构破坏明显改善。

注:A为对照组;B为LJP组;C为单纯照射组;D为照射+LJP组;Bar = 50 μm。
2.3 下颌下腺中Sirt3和MnSOD的表达及分布
图3为各组小鼠下颌下腺中Sirt3和MnSOD的表达及分布结果,图4为各组小鼠Sirt3和MnSOD阳性表达平均光密度值比较与对照组比较结果。由图3、图4可见,单纯照射组下颌下腺Sirt3和MnSOD阳性表达明显降低(p<0.05);与单纯照射组比较,LJP组及照射+LJP组Sirt3和MnSOD阳性表达均明显升高(p<0.05)。
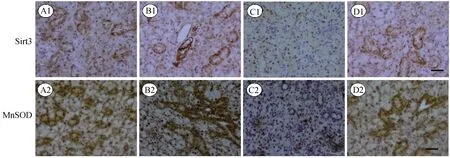
注:A1, A2为对照组;B1, B2为LJP组;C1, C2为单纯照射组;D1, D2为照射+LJP组;Bar = 50 μm。

注:A为各组小鼠Sirt3平均光密度值比较;B为各组小鼠MnSOD 平均光密度值比较;*与对照组比较,p<0.05;▲与单纯照射组比较,p<0.05。
2.4 下颌下腺Sirt3和MnSOD mRNA相对表达量
图5为各组小鼠Sirt3和MnSOD mRNA相对表达量比较结果。由图5可见,与对照组比较,单纯照射组下颌下腺Sirt3和MnSOD mRNA表达量明显降低(p<0.05);与单纯照射组比较,LJP组及照射+LJP组Sirt3和MnSOD mRNA表达量均明显升高(p<0.05)。

注:A为各组小鼠Sirt3 mRNA相对表达量比较;B为各组小鼠MnSOD mRNA相对表达量比较;*与对照组比较,p< 0.05;▲与单纯照射组比较,p<0.05。
3 讨论
电离辐射可诱导氧化应激反应活性氧(reactive oxygen species, ROS)自由基的产生,包括超氧自由基、羟自由基、过氧化氢等[11]。这些自由基会破坏组织细胞中的蛋白质、脂质和核酸,从而导致细胞功能障碍和死亡。因此,若能抑制氧化应激反应则可以减轻放射治疗中所引起的各种不良反应[12]。有研究表明Sirt3和MnSOD可以调节细胞中ROS水平,从而促进细胞增殖和存活[13]。Sirt3主要位于线粒体中,在改善氧化应激和线粒体功能障碍中起关键作用,并且有研究显示Sirt3可调节MnSOD和8-氧代鸟嘌呤DNA糖基化酶的乙酰化作用,将有害的超氧化物自由基转化为无毒的氧气,而这对于维持细胞线粒体DNA的完整性和减轻细胞凋亡至关重要[14]。有研究发现Sirt3基因敲除小鼠体内许多器官中会自发形成纤维化,部分原因是糖原合酶激酶-β的乙酰化增加,从而导致TGF-β1合成增加[15]。线粒体抗氧化剂MnSOD由基因组DNA编码,其线粒体中的歧化酶功能被完全激活,以解毒线粒体呼吸产生的氧自由基。一项关于成年果蝇的研究发现MnSOD过表达会诱导许多细胞信号通路激活[16],而MnSOD对多种细胞功能的调节可能会增强正常细胞对辐射的耐受性[17],这也表明了MnSOD介导的辐射防护机制可能是新的治疗靶点。此外,也有研究通过Nrf2/Sirt3/MnSOD信号传导,保护间充质干细胞免受高葡萄糖诱导的线粒体ROS产生和自噬细胞死亡[18]。
海带多糖因其低毒并具有多种药理作用,近年来开始受到国内外学者的关注。本研究显示在给予LJP干预后的照射小鼠唾液流量减少以及下颌下腺腺泡导管结构破坏均有明显的改善,这说明LJP可以保护照射后的唾液腺功能损伤。前期研究报道LJP可以抑制放疗后下颌下腺细胞的凋亡[19]和血管的损伤[20],然而其分子机制尚不清楚。此外,已有研究证明从海带中提取的多糖具有很好的抗氧化功效,因此,推测LJP可能通过抑制辐射过程中的氧化应激反应来保护辐射诱导的下颌下腺功能损伤。为了探讨其保护作用可能的分子机制,进一步观察了下颌下腺组织中与抗氧化应激有关的重要分子Sirt3/MnSOD的表达。在本研究中免疫组化和RT-qPCR实验结果均显示,单纯照射组小鼠下颌下腺组织中Sirt3和MnSOD表达明显降低,而给予LJP干预后两者的表达明显升高,这提示LJP可能通过上调Sirt3和MnSOD表达发挥抗氧化的作用[21]。HU等[22]在衰老小鼠皮肤模型中也发现LJP可以增强其皮肤组织中各种抗氧化酶(如超氧化物歧化酶,过氧化氢酶和谷胱甘肽过氧化物酶等)的表达来抑制衰老过程中ROS的产生,从而延缓小鼠固有皮肤的衰老,再次表明了LJP是一种有效的抗氧化剂。
综上,笔者推测LJP可能通过激活氧化应激相关Sirt3/MnSOD信号通路有效地抑制了辐射诱导的下颌下腺的损伤。在本次研究中,探讨了抗氧化应激相关信号通路Sirt3/MnSOD在下颌下腺组织辐射损伤中的表达和分布以及LJP干预后对其表达的影响。这为今后LJP用于临床上治疗头颈癌放疗患者口干提供了新的理论依据和分子治疗靶点。但是,此研究未进行细胞层面上信号通路的验证,下一步将完善相关的体外实验。
