采用钙镁共沉淀和二氧化锰沉淀浓集进行大体积水中Pu的分析
2021-07-13李鹏翔任晓娜马旭媛易武静韩玉虎杨芷萌
李鹏翔,任晓娜,马旭媛,李 周,易武静,张 静,韩玉虎,杨芷萌
(中国辐射防护研究院,太原 030006)
Pu是一种具有极毒性的放射性核素,且半衰期较长,环境样品中Pu是营运单位及环保监管部门非常重视的辐射环境监测对象。IAEA-SM-199/84[1]报告了美国东南部大西洋海岸河口中的钚[1],IAEA-SM-199/27[2]进行了孟买港的水环境中微量钚行为研究,欧盟[3]定期公布各成员国的核电厂和后处理厂流出物中Pu排放量。我国早在上世纪80年代就开始了水中钚的分析研究,冯忠良等人[4]介绍采用二氧化锰共沉淀和三正辛胺-聚三氟氯乙烯萃取的方法进行了水中钚分析方法研究,采用的是方法回收率,水样体积为40 L,方法回收率为(66.3~69.5)%。宋树林等人[5]采用氢氧化铁沉淀-离子交换法对海水中钚分析方法进行了研究,海水处理量为100 L,铁载体的加入量为1.5 g时,Pu的捕集率为(74±9)%(n=6),实际海水的回收率为(51.4~80.3)%。2001年付明等人[6]以活性Al2O3为吸附剂,采用吸附型大体积水样采集装置浓集100 L水中钚,放化回收率为(47.6±8.5)%,239Pu的探测下限为3.0×10-6Bq/L。
由于水中钚同位素含量极低,需要加大样品量以达到测量仪器的探测限,这就会面临大体积水样浓集的问题,通常采用沉淀浓集和蒸发的方法。蒸发用于低盐含量样品的预浓缩,既不适合处理大量样品(体积大于10 L),也不适合处理总溶解固体含量高的样品,如海水。常用的沉淀法是Fe(OH)2、Fe(OH)3和MnO2。我国国家标准方法[7-8]采用钙镁共沉淀-萃取色层法分析水中钚,水样处理量为50 L,适用于1.0×10-5Bq/L以上的水样。但是,一些环境水中钚含量往往低于该范围,无法给出满意的测量结果。
本文采用沉淀浓集-离子交换方法对大体积水中Pu分析方法进行了实验研究,针对浓集过程采用了MnO2沉淀法、CaCO3-Mg(OH)2沉淀法两种方案,对不同体积水样、不同沉淀量对分析结果的影响进行了实验。离子交换法相比于萃取色层法有一定的优势,不需要色层粉的调制,操作难度小。本方法对水样的最大操作量可达100 L,提高了全程放化回收率,对于具体的操作细节也给出了一些建议,可为大体积水中Pu分析工作提供参考。
1 材料与方法
1.1 主要试剂与仪器
1.1.1242Pu标准溶液
0.045 Bq/mL,介质为0.5 mol/L HNO3,参考日期为2013年7月18日,美国Eckert&Ziegler公司。
1.1.2NaOH溶液
包括10 mol/L和1 mol/L两种浓度。
1.1.3饱和KMnO4溶液
量取100 mL蒸馏水于200 mL烧杯中,加入适量高锰酸钾粉末搅拌溶解,不断加入高锰酸钾粉末直到不再溶解,将饱和溶液转移到棕色玻璃瓶中,摇匀备用。
1.1.4氨基磺酸亚铁溶液
称取3 g还原铁粉和12 g氨磺酸,用0.1 mol/L 硝酸溶解,过滤除去不溶物,滤液用水稀释至50 mL,密闭于棕色瓶中低温保存,使用期不得大于30 d。
1.1.5亚硝酸钠溶液:4.0 mol/L。
1.1.6阴离子交换树脂,205×7型,75~200目,天津南开和成科技有限公司。
1.1.7不锈钢镀片,φ20 mm×0.1 mm,材质为不锈钢,双镜面。
1.1.8α谱仪,7200-08型,美国CABERRA公司。
本实验中所用化学试剂均为分析纯,水为去离子蒸馏水。
1.2 大体积水中钚的浓集实验
对大体积水样中钚的浓集,采用了Ca-Mg沉淀法、MnO2沉淀法两种方法。以放化回收率为判断依据,比较两种方法的优劣。首先在小体积下比较了吸附剂的加入量、水样体积等对浓集和上柱分离的影响。样品量从5 L开始,依次为5 L、25 L、50 L、100 L,每组3个平行样。
1.3 分离纯化及制源测量
将已浓集Pu的沉淀转入烧杯中,按每100 mL溶液加入0.5 mL氨基磺酸亚铁溶液的量,还原5~10 min,再加入0.5 mL亚硝酸钠氧化5~10 min,然后在电热炉上加热煮沸,使过量的亚硝酸钠完全分解,冷却至室温;以0.5 mL/min的流速通过205×7型阴离子交换树脂柱,依次用7.5 mol/L HNO3和9 mol/L HCl淋洗离子交换柱,最后用0.36 mol/L HCl-0.1 mol/L HF混合溶液解吸Pu,收集解吸液60 mL;在解吸液中加入硫酸,蒸干,在硫酸-硫酸铵体系下进行电镀制源,用α谱仪测量。根据239+240Pu、242Pu的计数和示踪剂242Pu已知活度计算水中239+240Pu的含量。
2 结果与讨论
2.1 MnO2沉淀法
取一定体积的自来水放入聚乙烯塑料桶中,加入HNO3调节水样的pH值为2左右,加入一定量的242Pu示踪剂,搅拌均匀;加入一定量的饱和KMnO4溶液,搅拌均匀后,缓慢加入10 mol/L NaOH溶液和1 mol/L NaOH溶液调节水样的pH值为9~10,然后滴加0.5 mol/L NaHSO3溶液还原KMnO4,生成MnO2沉淀,间隔搅拌5~6次,静置12 h以上;采用虹吸法将上清液吸出,剩余溶液过滤,收集沉淀;用HCl将沉淀溶解,采用中速滤纸过滤,收集滤液,调节酸度为9 mol/L HCl,然后在9 mol/L HCl体系再上柱,依次用9 mol/L HCl、7.5 mol/L HNO3淋洗柱子,解吸后电镀制源及测量。分别对5 L、25 L、50 L、100 L、140 L体积的水样进行了实验,每个体积条件下,按饱和KMnO4溶液的加入量的多少分为两组,后一组中饱和KMnO4溶液的加入量是前一组的两倍,每组三个平行样。实验结果列于表1。
从表1可以看出,MnO2沉淀法对5 L、25 L水样中钚分析的全程放化回收率为70%左右,当水样体积增大到50 L时,MnO2沉淀法对水中钚的放化回收率为41.8%~50.4%,100 L和140 L时分别为18.0%~48.7%、17.7%~41.0%。同一种体积下,增加沉淀量没有明显提高回收率,25 L体积以下的水样中按照每升水样中加入0.6 mL饱和KMnO4可以实现较好的浓集效果。采用NaHSO3作为KMnO4生成MnO2沉淀的还原剂,要把握亚硫酸氢钠的加入量,过量加入会使MnO2再溶解。当样品体积增大后,生成的二氧化锰沉淀量成倍增加,沉淀溶解所需的酸量增加,给后续的上柱分离增加了难度,是回收率下降的主要原因之一。由此可见,通过增加水样的取样量来降低方法的探测限是不可行的。有研究者[9]提出通过给水样加热的方法可以提高浓集回收率,但是大体积水样的加热需要进一步寻找适合的方式和装置。
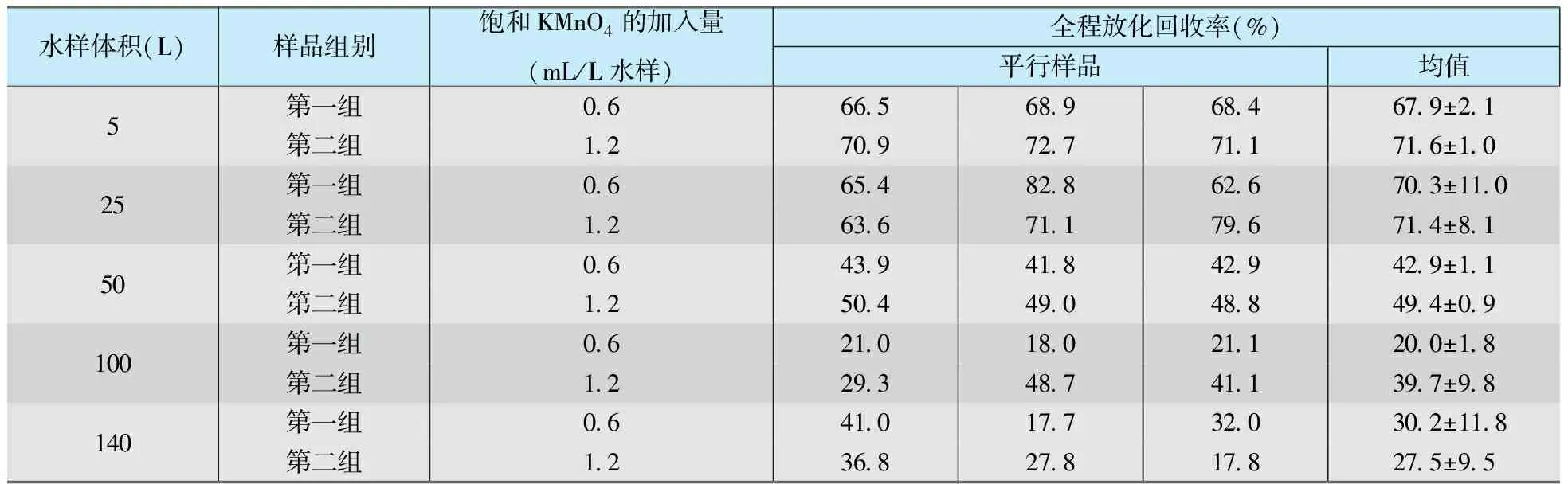
表1 MnO2沉淀法对不同体积水样中钚的分析结果
2.2 Ca-Mg共沉淀法
取一定体积的自来水放入聚乙烯塑料桶中,加入HNO3调节水样的pH值为2左右,加入一定量的242Pu示踪剂,搅拌均匀;加入一定量的CaCl2和MgCl2,待完全溶解后,缓慢加入NaOH溶液和Na2CO3溶液调节水样的pH值为9~10,生成白色絮状沉淀,间隔搅拌5~6次,静置12 h以上;采用虹吸法将上清液吸出,剩余溶液过滤,收集沉淀;用HNO3将沉淀溶解,过滤收集滤液,酸度调至7.5 mol/L HNO3,调节价态后上阴离子交换柱分离纯化和电镀制源。分别取5 L、25 L、50 L体积的水样进行了实验,每个体积条件下,按CaCl2和MgCl2加入量的多少分为两组,后一组的加入量是前一组的两倍,每组三个平行样。分析结果列于表2。

表2 Ca-Mg共沉淀法对不同体积水中钚的分析结果
表2结果显示,Ca-Mg共沉淀法对50 L及更小体积的水样获得全程放化回收率为70%左右,平行样品的标准偏差小于15%,方法的稳定性较好。当水样体积为25~50 L时,增加沉淀量没有明显提高回收率,当沉淀量成倍加大后方法的稳定性变差。主要是由于沉淀量增大给分离纯化带来了难度,综合考虑按照每升水样中加入0.3 g CaCl2和0.6 g MgCl2较宜。
取样量50 L时,方法的探测限为10 μBq/L。大多数的环境水样中Pu含量比该探测限低,如Pu在湖水中的平均浓度范围在3.7~18.5 μBq/L之间,在海水中为0.37 μBq/L[10],往往无法给出准确的分析结果,所以需要继续增加水样的取样量才能满足α谱仪的探测限要求。本实验取100 L水样进行了分析测定,实验结果列于表2。由表2可见,该方法的回收率为70.9%~77.1%,3个平行样品的标准偏差为3.1%,稳定性较好。在淡水样品浓集钚过程中发现,采用氢氧化钠调节pH值其效果要优于氨水,在大体积条件下,氨水调节pH值效果稳定性略差一些,而氢氧化钠没有这个现象,而且更利于氢氧化镁沉淀的形成。
2.3 实际水样分析
采集某地淡水样品共7个,采样量为89.3~108.3 L,加入HNO3调节水样的pH值为2左右,加入一定量的242Pu标液,搅拌均匀;按照每升水样中加入0.3 g CaCl2和0.6 g MgCl2的比例加入相应量的CaCl2和MgCl2,调节pH值至生成沉淀;用HNO3将沉淀溶解,调节Pu价态后在7.5 mol/L HNO3体系中上阴离子交换柱分离纯化,电镀制源,分析结果列于表3。

表3 实际水样中钚的分析结果
实际淡水样品中Pu分析结果显示:100 L水样的全程放化回收率为63.5%~80.2%,平均值为(74.6±5.9)%(n=7),水中239+240Pu活度浓度为9.32~15.6 μBq/L,测量结果均高于探测限。在测量时间为72 h,回收率74.6%,以体积100 L计算,本方法的探测限为3.1 μBq/L。
3 结论
(1)比较了MnO2沉淀法和Ca-Mg共沉淀法对大体积水中钚分析的效果,结果显示水样体积为25 L时,两种沉淀法对钚分析的全程放化回收率均可达到70%左右。当水样体积增大到50 L以上时,MnO2沉淀法的回收率明显低于Ca-Mg共沉淀法,此时采用Ca-Mg共沉淀法比较合适。Ca-Mg共沉淀法对50 L、100 L水样中钚分析的全程放化回收率达到68%以上。而当体积增大到50 L、100 L、140 L时,MnO2沉淀法的回收率降低为50%以下,体积越大回收率越低。
(2)100 L水样采用Ca-Mg共沉淀法浓集Pu,获得全程放化回收率为63.5%~80.2%,平均值为(74.6±5.9)%(n=7)。239+240Pu的最小可探测限为3.1 μBq/L(体积V=100 L,回收率Y=0.746,测量时间t=72 h)。
(3)增加沉淀量没有明显提高回收率,当沉淀量成倍加大后方法的稳定性变差,主要是由于沉淀量增大给分离纯化带来了难度。在淡水样品中钚的Ca-Mg共沉淀过程中,氨水调节pH值稳定性略差一些,推荐采用氢氧化钠溶液调节pH值,且利于氢氧化镁沉淀的形成。
