肾嫌色细胞癌ceRNA调控网络的构建与分析
2021-07-12李冰滢张庆梅葛盈盈农蔚霞肖绍文谢小薰
李冰滢, 刘 畅, 李 枫, 张庆梅, 罗 彬, 葛盈盈, 农蔚霞, 陈 芳, 肖绍文, 谢小薰
肾嫌色细胞癌(chromophobe renal cell carcinoma,CRCC)是一种来源于集合管上皮暗细胞的肾肿瘤,于1985年由Thoenes等[1]首次报道。CRCC多发于50~60岁,临床上无特殊病状和特征,部分患者可出现血尿或肿瘤压迫症状,仅有少数病例呈弥漫生长并侵及肾周脂肪组织和肾静脉[2-3]。有研究显示,CRCC的5年疾病无复发生存率(relapse-free survival,RFS)为89.3%,癌症特异性生存率(cancer-specific survival,CSS)为93%,并指出性别、TNM分期以及肉瘤样分化是预测CRCC预后的重要指标[4]。总而言之,CRCC是一种具有特殊形态、少见、低度恶性的肾细胞癌,相对于其他肾肿瘤而言,单纯CRCC预后较为乐观。非编码RNA(non-coding RNA,ncRNA)是指不编码蛋白质的RNA,主要分为短非编码RNA和长非编码RNA(long non-coding RNA,lncRNA)两类,其在基因的转录中起着重要的调控作用。lncRNA是长度>200 nt(核苷酸)的RNA分子,它不仅参与了机体正常的生物学功能,同时也与许多肿瘤疾病的发生、发展具有关联[5-7]。除lncRNA外,近年来微小RNA(micro RNA,miRNA)发现对肿瘤研究的发展也起到了重要作用,其是一类长约22 nt(核苷酸)的保守非编码单链小RNA,最早于1993年由Lee等[8]在秀丽虫中发现。当miRNA与信使RNA(messenger RNA,mRNA)结合时,可通过结合靶基因上的miRNA反应元件(microRNA response element,MRE)降解或沉默其靶基因从而抑制mRNA的翻译[9],其不仅参与细胞生长、衰老和凋亡的调节,而且与生命过程的各阶段密切相关[10-11]。但目前关于lncRNA与miRNA在CRCC中的研究仍鲜见。值得注意的是,近年有研究发现lncRNA具有“Spone”的功能,即与miRNA联系并调节miRNA的靶基因,这是一个更为复杂且精细的分子调控机制,称之为“内源竞争性RNA(competing endogenous RNAs,ceRNA)调控网络”。2011年Pier等首次提出ceRNA的假说,其核心认为ceRNA可通过MRE竞争结合相同的miRNA以调节靶基因的表达水平,即lncRNA可以作为ceRNA竞争性地结合miRNA以调控mRNA[12]。目前学者们已在肾透明细胞癌和肾癌中建立了ceRNA调控网络,使我们能更好地了解疾病的发生、发展机制,探讨治疗疾病的潜在靶点[13-14]。本研究使用癌症基因组图谱(the Cancer Genome Atlas,TCGA)数据库中的CRCC转录本数据,并筛选出在CRCC发生、发展过程中差异表达(differential expression,DE)的lncRNA、mRNA和miRNA,进一步构建CRCC的ceRNA调控网络,筛选出与CRCC预后相关的mRNA、lnRNA和miRNA,为CRCC的诊断和预后提供理论依据。现报告如下。
1 资料与方法
1.1TCGA数据收集 登陆TCGA数据库(https://cancergenome.nih.gov/),使用GDC API下载CRCC样本(65例)和正常肾样本(24例)转录组数据,获取样本的miRNA和mRNA数据。应用genecode v22 gtf文件提取lncRNA和蛋白编码基因(polycomb group,PCG)。对获取的数据进一步处理,根据每个mRNA、lncRNA和miRNA在样本的表达水平去除低丰度的mRNA、lncRNA和miRNA,筛选条件:表达水平>1。
1.2DEmRNA、DEmiRNA和DElncRNA筛选 使用R软件包DESeq2进行差异分析。差异表达基因的筛选条件:错误发现率(false discovery rate,FDR)<0.05,差异倍数的对数绝对值(log2|fold change|,log2|FC|)>2。根据该条件对选出的89例CRCC和正常肾样本的数据信息进行筛选,结果获得3 679个DElncRNA、297个DEmiRNA、5 914个DEmRNA,进一步使用R语言绘制DERNAs的热图和火山图。
1.3ceRNA调控网络构建 应用miRDB(http://mirdb.org)、miRTarBase(http://mirtarbase.mbc.nctu.edu.tw)和TargetScan(http://www.targetscan.org/vert_72/)三个数据库预测DEmiRNA靶向的mRNA作为靶mRNA集。应用mircode数据库预测DEmiRNA的靶lncRNA作为靶lncRNA集。以基于上述筛选出来互作的DERNAs,构建lncRNA-miRNA-mRNA互作的ceRNA调控网络,并通过Cytoscape 3.6.1绘制ceRNA调控网络图。
1.4生存分析和富集分析 下载Liu等[15]文章中的65例CRCC样本信息,将这些临床信息对应至ceRNA网络中的lncRNA、miRNA和mRNA,得到表达于临床样本的DERNAs。通过单因素分析计算两组的预后差异并选取关键节点,并对这些关键节点进行Kaplan-Meier曲线分析,筛选与CRCC生存预后相关的基因。应用STRING 11.0数据库(https://string-db.org/)构建筛选出基因的蛋白-蛋白互作(protein-protein interaction,PPI)网络,并进行GO与KEGG富集分析。P<0.05为差异有统计学意义。
2 结果
2.1DElncRNA、DEmiRNA和DEmRNA筛选结果 在3 679个DElncRNA中上调表达1 604个,下调表达2 075个;297个DEmiRNA中上调表达136个,下调表达161个;5 914个DEmRNA中上调表达2 531个,下调表达3 383个,见图1。进一步将所得DERNAs进行双向聚类分析,所得相应热图见图2。

橙色点表示高表达差异基因,绿色点表示低表达差异基因,蓝色点则表示无差异基因

横坐标为组织样本(蓝色为肿瘤组织样本,紫色为正常组织样本);纵坐标为DERNAs(红色表示上调,绿色表示下调)
2.2ceRNA调控网络构建情况 选取在CRCC中上调表达的DEmiRNA与其相对应的下调的DEmRNA和DElncRNA构建ceRNA调控网络,其中包括95个DEmiRNA、268个DEmRNA和737个DElncRNA。选取在CRCC中下调表达的DEmiRNA与其对应的上调的DEmRNA和DElncRNA构建ceRNA调控网络,其中包括85个DEmiRNA、234个DEmRNA和924个DElncRNA。最终构建出2个初始ceRNA调控网络,并借助cytoscape将其可视化。见图3,4。
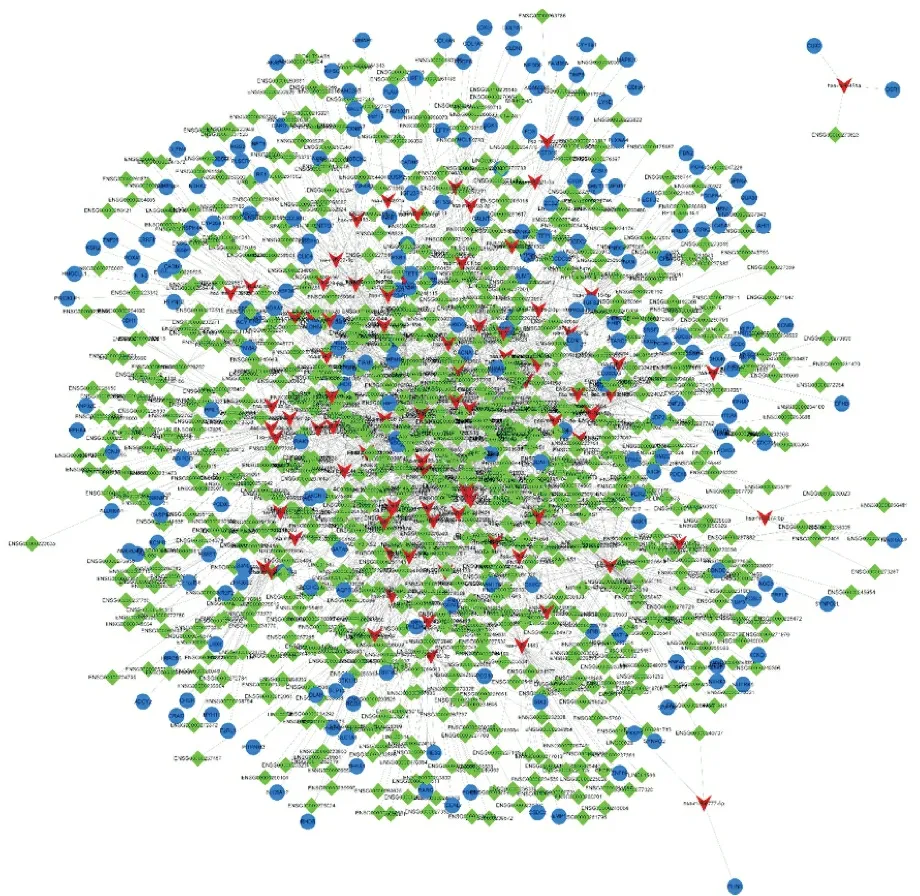
蓝色点表示DEmRNA,绿色点表示DElncRNA,红色点表示DEmiRNA

蓝色点表示DEmRNA,绿色点表示DElncRNA,红色点表示DEmiRNA
2.3ceRNA中DElncRNA、DEmiRNA、DEmRNA与CRCC预后相关性分析结果 应用Kaplan-Meier分析进一步探讨ceRNA调控网络中的DERNAs与CRCC预后的相关性。首先进行DEmiRNA预后分析,结果显示仅miR-26b-5p与CRCC预后具有相关性,miR-26b-5p高表达患者预后较好(P=0.11),见图5。从初始的ceRNA调控网络中抽出miR-26b-5p相关的ceRNA调控网络(见图6),发现miR-26b-5p靶向的DEmRNA共有19个,Kaplan-Meier分析显示仅DEPDC1、E2F7、SLC7A11与CRCC预后相关(P<0.05),见图7。miR-26b-5p靶向的DElncRNA有21个,但均未发现其与CRCC预后相关(P>0.05)。
2.4CRCC预后相关DEmRNA的PPI和富集分析结果 基于STRING 11.0数据库的PPI分析结果显示,DEPDC1、E2F7、SLC7A11和TOP2A、SLC3A2、E2F8、E2F1、TP53之间存在潜在的蛋白互作联系。进一步对其进行富集分析,GO富集分析结果显示,这些基因主要参与DNA损伤反应、p53介导的信号转导导致的细胞组织与启动子特异结合等,见图8。KEGG富集分析结果显示,这些基因功能主要富集于铁死亡、Cell cycle,MicroRNAs in cancer以及Pathways in cancer等信号通路上,见图9。

图5 has-miR-26-5p的Kaplan-Meier生存曲线图

蓝色为miRNA,红色为lncRNA,绿色为mRNA

图7 DEPDC1、E2F7和SLC7A11的Kaplan-Meier生存曲线图

ⓐ分子功能(molecular function,MF)结果,其中红色代表近端启动子序列特异性DNA结合;蓝色代表离子反转运活性;绿色代表中性氨基酸跨膜转运活性;黄色代表DNA结合转录抑制因子活性;紫色代表核酸结合。ⓑ生物过程(biological process,BP)结果,其中红色代表有丝分裂DNA完整性检查点;蓝色代表DNA损伤反应、p53-me类信号转导;绿色代表DNA内复制的正调控;黄色代表转录负调控参与有丝分裂细胞周期G1/S转换;紫色代表绒毛膜滋养层细胞分化。图中基因对应的颜色代表该基因参与的功能。ⓒ细胞组分(cellular component,CC)结果,红色代表转录因子复合体。

红色代表铁死亡;蓝色代表cell cycle;绿色代表MicroRNAs in cancer;黄色代表Pathways in cancer。图中基因对应的颜色代表该基因参与的信号通路
3 讨论
3.1肾癌是男性肿瘤中的第6大常见肿瘤,是女性肿瘤第10大常见肿瘤[16]。在世界卫生组织(World Health Organization,WHO)分级中肾癌共有12种亚型[17],CRCC占肾癌的5%,且是肾癌中预后最好的一种亚型。研究[3]显示,不同性别、病变位置(左侧或右侧)的CRCC发病情况无显著差异,TNM分期多为Ⅰ~Ⅱ期,但CRCC发生转移后更多地表现为肉瘤样变,预后比透明细胞癌更差。Geramizadeh等[18]在对123例CRCC的术后随访中发现仅20例(16%)患者发生疾病进展(局部复发、转移或死亡)。因此,寻找潜在的生物学靶点来防止CRCC的转移意义重大。
3.2随着测序技术的不断成熟,研究者可以从海量的数据库中筛选出影响疾病发生、发展的关键因子,从而更好地阐明其分子机制。ceRNA假说提出了一个编码RNA与非编码RNA之间更为复杂精细的调控,为目前研究RNA之间的相互作用提供了新思路,而miRNA、lncRNA和mRNA之间的相互作用具有重要的生物学意义。本研究中,我们筛选出TCGA数据库中CRCC组织和正常肾组织中的DEmRNA、DElncRNA和DEmiRNA,并构建了两个初始ceRNA调控网络:其一为上调DEmiRNA的ceRNA调控网络,包括95个DEmiRNA、268个DEmRNA和737个DElncRNA;另一为下调DEmiRNA的ceRNA调控网络,包括85个DEmiRNA、234个DEmRNA和924个DElncRNA。进一步的Kaplan-Meier分析显示,其中1个miRNA(miR-26b-5p)和3个mRNA(DEPDC1、SLC7A11和E2F7)与CRCC预后相关,且它们之间存在潜在的靶向关系。miRNA在肿瘤的增殖和转移等方面发挥着重要的作用,但在CRCC方面,miRNA的相关研究却鲜有。Zhang等[19]通过实验验证了miR-26b通过直接与DEPDC1的3′-UTR结合而抑制DEPDC1的表达,两者之间存在靶向关系。但目前仍没有研究对miR-26b-5p与E2F7之间的靶向关系进行验证,需进一步开展研究。miR-26b-5p在多种癌症中属于抗肿瘤基因,且miR-26b-5p的过表达可阻断细胞G1/S期,抑制膀胱癌、肝细胞癌、乳腺癌的增殖[20]。
3.3E2F7是转录因子家族中E2F家族抑制子中的一员,有研究[21]表明E2F7参与细胞周期的调控,其上调可造成细胞周期停滞,下调则可促进细胞周期的进展。目前仍未发现E2F7在CRCC中的生物学功能的文献报道,本研究结果提示E2F7可以作为CRCC预后的潜在预测因子。DEPDC1在多种人类癌症中显著增高,其可能是不同肿瘤疾病中的促肿瘤因子,如膀胱癌中DEPDC1上调表达,对癌细胞的生长至关重要[22]。本研究结果也表明DEPDC1在CRCC中高表达,并且是其潜在的预后预测因子。SLC7A11广泛存在于哺乳动物体内的星形胶质细胞和巨噬细胞等细胞中。SLC7A11基因缺失会扰乱细胞的生长、代谢甚至导致癌变。有研究[23]表明SLC7A11的高表达与肿瘤的生长、转移密切相关,并与疾病预后不良相关。相似的,本研究也发现SLC7A11在CRCC中高表达,并与CRCC预后具有关联。
3.4本研究PPI网络共发现8个蛋白互作基因,分别为TOP2A、E2F7、E2F1、E2F8、TP53、SLC7A11、SLC3A2和DEPDC1,进一步的富集分析结果显示,E2F1和TP53参与细胞周期调控,可抑制细胞增殖,并作用于Pathways in cancer、Cell cycle和MicroRNAs in cancer通路上。另外有研究[24]显示,SLC3A2在各类肾肿瘤,包括CRCC组织中呈高表达,这为寻找新的CRCC生物学标志物提供了线索。
综上所述,本研究构建了CRCC的ceRNA调控网络,并筛出与CRCC预后具有关联的RNA分子,其中miRNA-26b-5p在CRCC中呈低表达,而E2F7、DEPDC1和SLC7A11呈高表达,为CRCC的诊断、治疗以及预后提供了潜在的生物学靶点。
