莲房原花青素调控RAC1/PI3K/AkT信号途径抑制结肠癌的增殖、迁移与侵袭
2021-07-12马丹丹尚作宏
张 毅,马丹丹,龚 齐,黄 华,曹 定,尚作宏,张 翌
0 引 言
结肠癌是胃肠道中常见的恶性肿瘤[1]。近年来,随着饮食结构和生活习惯的变化,其发病率逐渐增加[2]。临床上结直肠癌主要采用手术、化疗、放疗及生物靶向等方法治疗[3]。但缺乏有效的分子标记物辅助诊断及判断预后的问题亟待解决。因此,探究结肠癌生长、转移的分子机制是提高结肠癌患者诊断及预后的关键。
莲房原花青素(procyanidins from lotus seedpod,LSPCs)是从睡莲科植物莲的成熟花托中分离的主要活性成分之一,是由儿茶素或表儿茶素以 C4-C8 或 C4-C6 键连接而成的 2-4 聚体所组成[4]。业已证实 LSPCs 体内外均具有强的清除自由基和抗氧化活性,能改善老龄及各种衰老模型动物学习记忆能力,抗肿瘤、改善心血管功能等,而莲房原花青素作为公认的强抗氧化剂和自由基清除剂,对炎症反应与氧化应激具有显著调控作用[5]。但是,目前关于莲房原花青素在结肠癌中的抗癌作用目前仍不清楚。
RAC1是普遍表达的Rho GTP酶,位于人染色体7p22,作为小分子GTP酶蛋白,已被证实参与多种肿瘤的进展[6]。已有大量研究表明,PI3K/AKT信号通路在大多数癌症包括结肠癌中被激活[7]。比如,UNC5B-AS1通过下调miR-622并抑制AMPK/PI3K/AKT通路从而抑制结肠癌的生长和转移[8]。此外,姜黄素通过使细胞中mTOR/PI3K/AKT信号传导途径失活从而抑制结肠直肠癌的生长[9]。但莲房原花青素能否通过调控PI3K/AKT信号通路的传导从而影响结肠癌的进展尚待探究。
鉴于以上研究基础,我们假设莲房原花青素在结直肠癌中发挥重要作用,通过调控PI3K/AKT信号通路的传导从而影响结肠癌的进展尚待探究,以期为莲房原花青素在结直肠癌中的抗肿瘤作用提供依据。
1 材料与方法
1.1 细胞培养与转染结肠癌细胞株(HCT116)购自AmericanTypeCultureCollection(ATCC, Rockville, MD, USA)。将这些细胞用含10%胎牛血清(fetalbovineserum, FBS) (ThermoFisherScientific,MA, USA)和1%青霉素/链霉素(Invitrogen, CA, USA)的RPMI1640 (ThermoFisherScientific, MA, USA)培养液、置于37 ℃、CO2体积分数为5%的培养箱中培养。在细胞的对数生长期采用0.25%胰蛋白酶(ThermoFisher, HyClone, Utah, USA)进行消化传代。
RAC1低表达质粒以及相应的阴性对照组均由GenePharma (Shanghai, China)获得。取HCT116细胞,以3×105个细胞/孔的密度接种于24孔细胞培养板,置37 ℃、5%CO2温育培养24 h后进行细胞转染。根据供应商的说明书用Lipofectamine© 3000 (Invitrogen; ThermoFisherScientific, Inc.) 转染HCT116细胞。用RT-PCR检测转染效率。细胞在37 ℃和5% CO2条件下孵育24 h,待进一步分析。
1.2实验分组对照组不予处理,实验组分别给予10 、20、40 μmol/L浓度的LSPCs干预24 h后,行CCK-8,Transwell及Western blot检测细胞增殖、转移及侵袭能力。HCT116细胞对照组不予处理,si-RAC组在给予确认敲低后24 h行不同的检测。
1.3RT-PCR实验根据制造商的方案(Invitrogen,Waltham,MA,USA),使用TRIzol试剂提取组织或细胞总RNA。我们用Nanodrop-spectrophotometer检测RNA浓度和纯度。根据制造商的方案,我们使用PrimeScript-RT Kit(Madison,WI,USA)从1 μg总RNA中合成互补DNA(cDNA),然后我们使用SYBR©Premix-Ex-TaqTM(Takara, TX, USA)和ABI7300系统进行quantitative reverse transcription-polymerase chainreaction (qRTPCR)。PCR体系的总体积为30 μL,每个样品含有300ng cDNA。扩增程序是在95 ℃下初始变性10 min,然后进行45个循环,即95 ℃10 s,60 ℃30 s,85 ℃20 s。我们将所有荧光数据转换为相对定量,GAPDH为RAC1的内参。重复所有RT-PCR反应3次。引物序列如下:Caspase-3前引物:GGATATGGCTCAGGGCAATG ,后引物:CAATTGGGAGTGGTAGGTC;Bax前引物:GGATTCCAGCCCACAGAACG,后引物:ACATTCTCGCTTCAGGGTGAA;Bcl-2前引物:GGCCTGCTGTTGGATCCTCTC,后引物:TCA TCTTGAGGGTCCGTCA;GAPDH前引物:GCTCTCTGCTCCTCCTGTTC,后引物:ACGACCAAATCCGTTGACTC。
1.4CCK-8法取对数生长期的HCT116细胞使用胰酶消化后,调整细胞密度至2×103/mL后,接种于96孔板,每孔100 μL细胞悬液,每组设3个复孔。之后将96孔板置于培养箱中继续培养。24 h后每个孔加入CCK8溶液(湖北百奥斯生物科技有限公司)10 μL,继续于培养箱中孵育1 h。终止培养后,将96孔板置于酶标仪中,测定450 nm波长各孔的吸光度(A值)。此后在第24、48、72小时各测定一次细胞的吸光度。
1.5Transwell assay检测细胞的侵袭能力按Chemicon公司的ECM550系列说明书要求,制备有基质胶的Transwell小室(Corting, NY, USA),将HCT116细胞分别接种200 μL于Transwell小室内,调整密度为5×105个/mL,24孔板下室内分别加入700 μL含FBS的培养液,培养24 h后,吸除小室内的培养液,用棉签轻轻擦去小室内的基质胶,用PBS清洗1遍后风干,将小室浸泡于甲醛内20 min后,用PBS清洗1遍后风干,将小室浸泡于结晶紫中染色20 min,染色后,用PBS清洗3遍后风干,于正置显微镜(Olympus,Tokyo,Japan)下成像。
1.6Western blot方法待细胞处理完毕,弃培养基,加入蛋白裂解液(Roche)并分离总蛋白。取50 g 总蛋白加样于12%聚丙烯酰胺凝胶中,100 V电泳2 h。然后电转移至聚偏氟乙烯(PVDF)膜。用5%脱脂奶粉室温封闭1 h后,TBST洗膜3次,每次10 min,Anti-Rac1 antibody(ab155938,1∶1000,abcam,MA,USA)Anti-PI3K antibody (ab191606,1∶1000,abcam,MA,USA),Anti-PI3k(phosphoY607)antibody (ab182651,1∶1000,abcam,MA,USA),Anti-pan-AKT antibody (ab18785,1∶1000,abcam,MA,USA),Anti-AKT (phospho T308) antibody (ab38449,1∶1000,abcam,MA ,USA)在4 ℃下孵育过夜。在TBST洗膜后,在室温下将膜用辣根过氧化物酶(HRP)标记二抗羊抗兔(ab150077,1∶3000,1∶1000,abcam,MA,USA)孵育1 h。TBST洗膜3次,每次10 min。最后用Western blot专用试剂(Invitrogen公司)显色成像,采用Image J分析各蛋白灰度值。
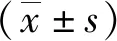
2 结 果
2.1 莲房原花青素抑制了结肠癌的增殖,促进其凋亡CCK8实验表明莲房原花青素干预后细胞的增殖水平显著下降,并且时间越长,增殖能力越弱(P<0.05);流式凋亡实验结果表明,莲房原花青素干预后细胞的凋亡水平较对照组显著增加(P<0.05),见图1。RT-PCR实验检测莲房原花青素对细胞凋亡的影响,结果发现,与对照组比较,莲房原花青素干预可以显著下调抑凋亡蛋白Bcl-2,并且显著上调促凋亡蛋白Bax表达水平,同时增加Caspase-3表达(P<0.05)。见表1。
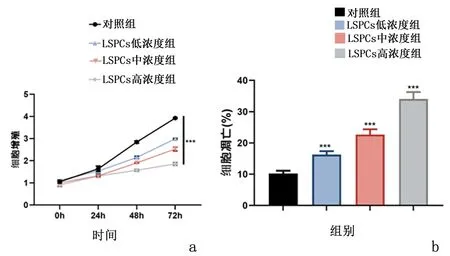
a:CCK8实验;b:流式凋亡实验图1 莲房原花青素抑制了结肠癌的增殖,促进其凋亡Figure 1 Lotus proanthocyanidin inhibited the proliferation of colon cancer and promoted its apoptosis

表1 RT-PCR实验检测Bcl-2、Bax、Caspase-3表达Table 1 Expression of Bcl-2, Bax and caspase-3 detected by RT-PCR
2.2莲房原花青素抑制结肠癌的转移、侵袭细胞迁移实验表明莲房原花青素干预的结肠癌细胞侵袭细胞数量显著低于对照组,同时莲房原花青素干预的结肠癌细胞迁移能力较对照组明显减弱,且呈浓度依赖效应(P<0.05)。见图2,表2。
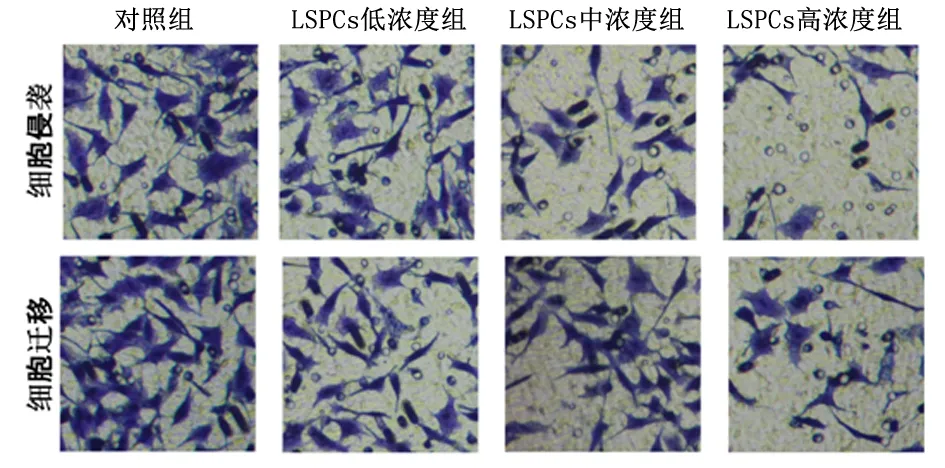
图2 莲房原花青素抑制结肠癌的侵袭、转移Figure 2 Inhibition of metastasis and invasion of colon cancer by lotus proanthocyanidins

表2 Transwell实验检测结肠癌细胞迁移、侵袭Table 2 Transwell assay for detection of migration and invasion of colon cancer
2.3莲房原花青素抑制结肠癌RAC1/PI3K/AKT的表达Western blot实验显示,与对照组比较,莲房原花青素能够抑制RAC1/PI3K/AKT的表达(P<0.01),随LSPCs浓度增加,抑制作用增强。见图3。
2.4抑制RAC1减弱了结肠癌的进展和PI3K/AKT的活化CCK8实验结果表明,与对照组比较,敲低RAC1后细胞的增殖能力显著下调(P<0.05),且同时流式细胞凋亡检测结果证实敲低RAC1后细胞凋亡显著增加,差异有统计学意义(P<0.05),见表3。Transwell实验表明,与对照组比较,敲低RAC1明显下调了HCT116细胞的迁移与侵袭(P<0.05),见表3。Western blot 实验结果显示,与对照组比较敲低RAC1后,PI3K/AKT的活化显著降低(P<0.05)。见图4。

表3 细胞凋亡及细胞迁移、侵袭改变Table 3 Lotus proanthocyanidins inhibit the expression of Rac1/PI3K/Akt in colon cancer (The effect of lotus proanthocyanidins on Rac1/PI3K/Akt was detected by Western blot
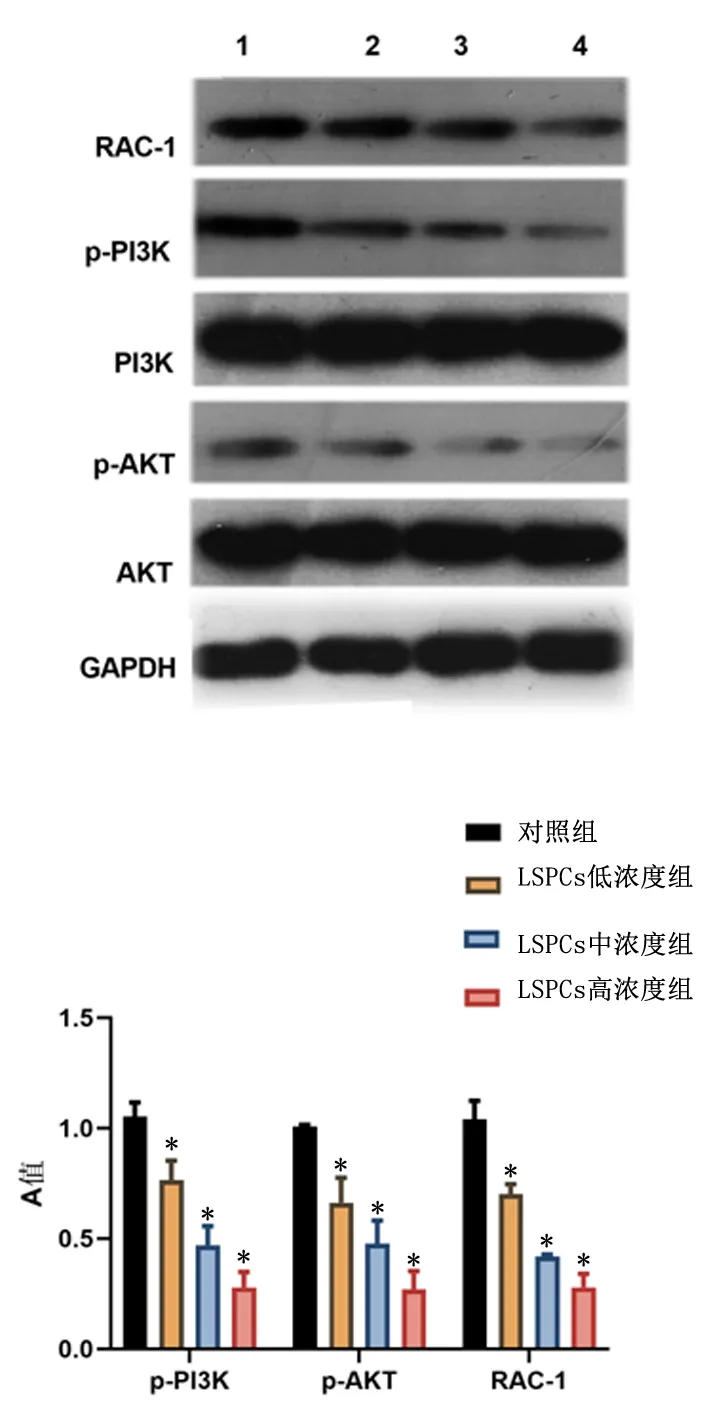
1:对照组;2: LSPCs低浓度组;3: LSPCs中浓度组;4: LSPCs高浓度组与对照组比较,*P<0.05图3 莲房原花青素抑制结肠癌RAC1/PI3K/AKT的表达Figure 3 Lotus proanthocyanidins inhibit the expression of Rac1/PI3K/Akt in colon cancer
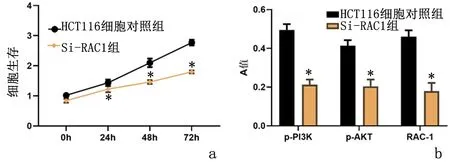
a:CCK8实验;b:Western blot检测与HCT116细胞对照组比较,*P<0.05图4 抑制RAC1减弱了结肠癌的进展和PI3K/AKT的活化Figure 4 Inhibition of Rac1 attenuated colon cancer progression and PI3K/Akt activation
3 讨 论
结肠癌是常见的发生于结肠部位的消化道恶性肿瘤[10]。其早期症状不明显,到中晚期时伴随着病灶转移,贻误了最佳治疗时期,因此提高结肠癌的早期诊断率、寻找新的分子治疗靶标迫在眉睫。LSPCs是从睡莲科植物莲的成熟花托中分离的主要活性成分之一,是由儿茶素或表儿茶素以 C4-C8 或 C4-C6 键连接而成的 2-4 聚体所组成[11]。业已证实 LSPCs 体内外均具有强抗肿瘤、改善心血管功能等[12]。鉴于以上研究,我们大胆猜测,LSPCs在结肠癌中也发挥重要的抗癌作用。令人惊喜地的是,在本研究中我们发现,LSPCs在结肠癌中具有显著的抑制肿瘤恶性生物学行为的作用,促进了结肠癌细胞的凋亡,抑制其增殖、迁移与侵袭,是结肠癌分子靶向治疗的潜在靶点。
已知LSPCs具有极强的抗氧化活性,是一种氧自由基清除剂和脂质过氧化抑制剂。研究表明LSPCs为抗氧化剂保健药物,已在较大范围内使用[13]。研究报道莲房原花青素可抑制肝细胞膜脂质过氧化,且可能具有一定的抗肝损伤作用,其作用机理与莲房原花青素对活性氧自由基的清除作用及其强还原性及螯合金属离子的特性有关[14]。但是,目前关于LSPCs在抗肿瘤中的作用的仍不清楚。近年来,有学者研究发现LSPCs导人肝癌HepG2细胞自噬和凋亡[15]。但是LSPCs在结肠癌中的作用仍不清楚。本研究的结果初步探索发现LSPCs在结肠癌中具有显著的抑制肿瘤恶性生物学行为的作用,促进了结肠癌细胞的凋亡,抑制其增殖、迁移与侵袭。并且,本研究还初步明确了LSPCs抑制结肠癌恶性生物学行为的可能机制,是通过抑制RAC1/PI3K/AkT信号传导途径实现的。
RAC1是GTPases Rho家族的重要成员之一,有研究报道,结肠癌细胞中RAC1阳性表达明显升高,且其结肠癌浸润和转移的机制可能与CDC42、smad4、ERK/JNK等信号的激活,继而促进EMT有关[16-17]。叶志强等人的报道显示,通过抑制RAC1的表达, 可以有效阻止GTPase的激活, 从而抑制结肠癌的迁移及侵袭。同时,解娜等人的研究也证实沉默RAC1的表达能减慢结肠癌细胞的增殖并抑制裸鼠移植瘤的生长[18]。此外,前人的研究已表明,RAC1/PI3K/AKT信号通路参与多种肿瘤的进展,例如,Neo1通过激活RAC1/PI3K/AKT途径正向调控ZEB1的表达从而促进胃癌的增殖,运动和黏附[19]。屈恒义等人的研究也表明,香烟烟雾通过激活RAC1/Smad2和RAC1/PI3K/AkT信号传导途径促进肺癌的上皮间质转化[20]。与上述研究结论基本相符,在本研究中,我们发现,RAC1在结肠癌中的表达显著上调,同时抑制RAC1明显减弱了结肠癌的进展和PI3K/AKT的活化,这些结果表明RAC1过表达可能参与结肠癌细胞恶性演进的生物学过程。
综上所述,我们的研究证实了LSPCs在结肠癌中具有显著的抑制肿瘤恶性生物学行为的作用,促进了结肠癌细胞的凋亡,抑制其增殖、迁移与侵袭,其具体机制可能是通过抑制RAC1/PI3K/AkT信号传导途径实现。这为结肠癌的治疗和预后提供了新的干预靶点, 也为进一步免疫生物过继治疗提供了必要的实验基础,但更多地分子机制还需更加深入地探究。
