“无机化学”中“化学键与分子结构”一章的教学探讨
2021-07-10张一兵
张一兵
(上饶师范学院 化学与环境科学学院,江西 上饶 334001)
自从2017年下半年我校实行新教学大纲以来,上饶师范学院化学与环境科学学院“无机化学”整学年的总课时持续缩减,现减为129个,其中第1学期5课时/周(40分钟/课时)、授课13周共计65课时;第2学期64个课时,4课时/周,分16周完成。作为新生的专业基础课“无机化学”的老师,面临两大主要困难:教学内容多且繁杂而授课时间少、学生化学基础差(扩招下的地方院校的录取分数低)。在如此严峻的形势下,如何确保教学任务完成,让学生顺利“出师”,老师就必须打破传统,在教学上改革创新,从教学内容、方法和手段上寻找出路。为了适应新形势,解决新问题,笔者为此做了一些尝试[1-2]。“无机化学”教学内容(我们采用武汉大学等三校编写的《无机化学》作教材[3],以北京师范大学等三校编写的《无机化学》为主要参考书[4])中“原子结构”和“化学键与分子结构”两章是公认的教学重点与难点,为此笔者认为需下更大功夫做更深入的教学研究,才能在时间紧、任务重、困难大的情况下圆满完成教学任务。“原子结构”一章教学研究已经述及[2],在此拟对“化学键与分子结构”一章的教学进行阐述,旨在抛砖引玉,不对地方敬请同行批评指正。
从“化学键与分子结构”整章内容的知识点上看,笔者认为可以简化为两个字:“力”与“形”。下面就按此思路对其进行阐述与分析。
1 力
从形成力的质点上看,力分为原子间作用力和分子间作用力。分子或晶体内相邻两个或多个原子(或离子)之间强烈的相互作用力,称作化学键。分子间的作用力称作范德华力,少数特殊情况下形成的范德华力叫氢键。化学键和范德华力均分为三种,前者有离子键、共价键和金属键,后者分为色散力、诱导力、取向力。形成氢键要有特殊条件(HY 分子间,且Y=F、O、N),所以它属于特殊形式的分子间力。氢键分为分子间氢键和分子内氢键。
从形成力的大小上看,存在如下关系:化学键>氢键>范德华力,它们的数量级范围大致如下:化学键键能102~103kJ/mol、氢键20~40 kJ/mol、范德华力小于10 kJ/mol。
从影响物质的性质方面考虑,化学键一般影响物质的化学性质,而氢键和范德华力主要是影响物质的物理性质。
1.1 化学键
为了让学生有效、快捷地掌握三种化学键,可从键的定义、形成本质、影响因素、存在对象、特点、形成晶体类型及其物理性质等方面进行对比分析(见表1)。三种化学键中,离子键和金属键相对比较简单,但共价键知识就显得较难且复杂,有关它的理论到目前为止主要有四个:价键理论(VB法)、杂化轨道理论、分子轨道理论(MO 法)、价层电子对互斥理论(VSEPR)。每个理论各有所长,可根据实际情况灵活选用,取长补短。表2比较了共价键的四大理论,并从理论要点、优点及不足进行了比较分析,有利于学生澄清是非,深度掌握。教学中要提醒学生注意在学习共价键理论之前必须掌握共价键的概念、类型等知识点。

表1 三大化学键比较

表2 四大共价键理论的比较分析
原子间通过共享电子对所形成的化学键称作共价键。有多少个成单电子就能形成多少个共价键。共价键根据原子轨道的重叠方式分为σ键和π键两类。原子轨道以“头碰头”方式重叠(沿键方向相向重叠)的称作σ键,以“肩并肩”方式重叠(沿键方向平行重叠)的称作π键。判断它们存在及个数很简单,如果两个原子间只有1个共价键,那它一定是σ键,如果两个原子间含有多重共价键,则除了1个σ 键外其他的均为π 键。表3对σ键和π键从原子轨道重叠方式、原子轨道重叠部位、原子轨道重叠程度、形成共价键的强度和活性等方面进行比照,以帮助学生学习掌握共价键知识。
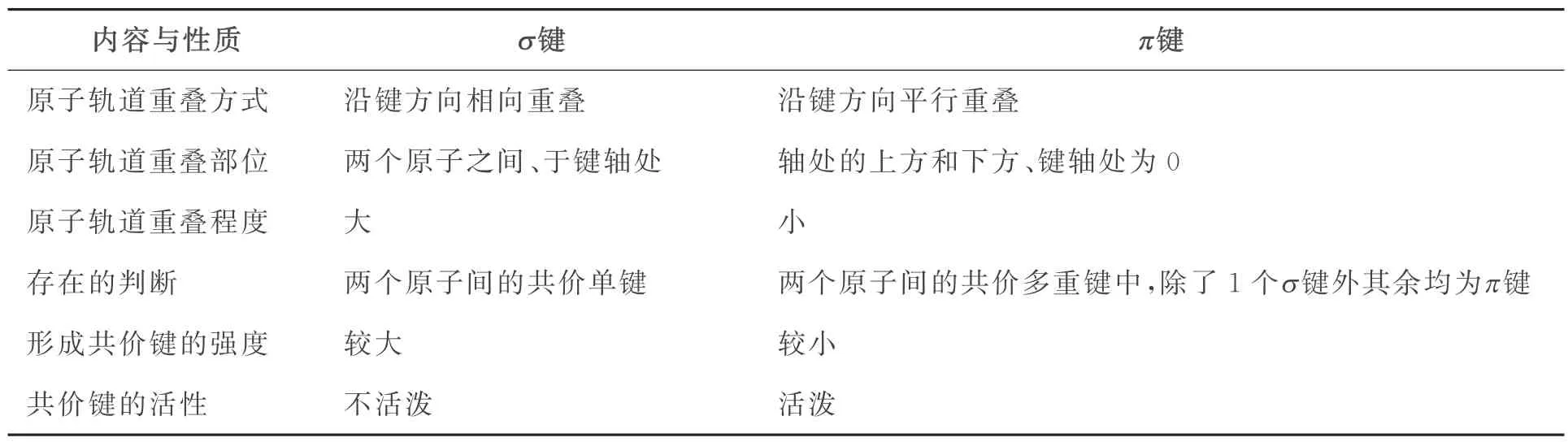
表3 σ 键与π键的特征比较
学生在高一阶段就学习了配位键,由于其知识水平参差不齐,有必要对配位键知识进行加深加固。知识巩固包括:作为一种特殊共价键,配位键是由一个原子提供孤电子对,另一个原子提供空轨道形成的共价键,以“→”表示。虽然配位键与共价键形成过程有所不同,但配位键一旦形成其结果与共价键就没有区别。
1.2 分子间作用力
把分子聚集起来的力称作分子间作用力,也叫范德华力。分子间作用力的本质是静电作用,与分子的极性和变形性有关。分子间作用力没有饱和性和方向性,比化学键弱得多。分子间作用力分为色散力、诱导力和取向力三种。它们具体存在于何种分子之间及产生原因,部分学生总是分不清楚。鉴于此对其列表4进行梳理,以使学生明晰概念,有效掌握该知识点。表4表明,色散力存在于一切分子之间,且在三类作用力中最为主要。只有极性很强的分子之间,如H2O、NH3之间才存在较明显的取向力(见表5),分子的极性增大,分子间作用力就增大。一般而论,极性分子间的作用力大于非极性分子间的作用力。

表4 三种分子间作用力存在和产生原因
1.3 氢键——特殊条件下的分子间作用力
尽管学生们在中学学习过氢键知识,但许多学生仍然不能完全掌握。要彻底根除这种现象,得对氢键进行全方位的归纳总结。
氢键的定义及表示通式:X—H…Y,式中X 和Y 代表F、O、N 等,X 和Y 可同可异;X 一般以共价键与H 相连,因X 有较高电负性可稳定负电荷,致使H 易解离而具有酸性(质子给予体)。Y 的电负性大,原子半径小、有孤对电子,容易吸引质子,故Y 与X 和H 原子形成三中心四电子键。
形成氢键必须具备两个条件:(1)必须有H 原子;(2)必须有电负性大、原子半径小、含有孤电子对的非金属元素原子如F、O、N。氢键属于特殊形式的分子间作用力。
氢键的本质:强极性键(X-H)上的氢核与电负性很大的、原子半径小且含孤电子对并带有部分负电荷的原子Y 之间的静电作用力。
目前人们对氢键的定义存在两种不同的理解:(1)视X—H …Y 整个结构为氢键,此氢键的键长是指X与Y 间的距离,如F—H…F的键长为255 pm;(2)视H…Y 为氢键,故H…F之间的距离为氢键键长163 pm。上述差别在选用氢键键长数据时应倍加注意。
氢键键能:把X—H …Y—H 分解成为HX 和HY 所需的能量。大小为20~40 kJ/mol,比普通范德华力稍大,比化学键弱得多。
氢键的特点:有饱和性、有方向性。由于H 原子特小而X、Y 原子较大,所以X—H 中的H 只能与一个Y 结合形成氢键,又因为拥有较多负电荷的Y 之间的同性相斥作用,造成另一个电负性大的Y 难再接近此H,导致氢键存在饱和性;氢键的方向性源自电偶极矩X—H 与Y 的相互作用,因为只有当X—H …Y 在同一条直线上时最强,同时Y 通常含有孤电子对,在可能范围内氢键的方向和孤电子对的对称轴一致,这样使Y 中负电荷分布最多的部分最接近H,由此形成的氢键最稳定[5]。
氢键分类:分子间氢键和分子内氢键。形成分子内氢键的分子不能(或削弱)形成分子间氢键。
物质大多在液态下形成氢键,但形成后有时也能继续存在于某些晶态甚至气态中。例如在气态、液态和固态的HF中存在氢键,水和冰中也都存在氢键。氢键的存在影响到物质的某些性质(主要是物理性质:如熔点、沸点、溶解度、密度、黏度等)。
2 形
这里所说的“形”是指的分子形状或分子立体结构。分子结构是根据光谱学数据,用以描述分子中原子的三维排列方式。由于涉及原子在空间中的位置,故分子结构相关于化学键种类和化学键参数(包括键长、键角等)。“形”在很大程度上影响着化学物质的反应性、生物活性、极性、磁性、相态、颜色等。
由离子键或金属键形成的物质,不存在单个分子,而是“巨型分子”,所以无从讨论单个分子的“形”。通常我们所说的分子结构一般就是指通过共价键形成的能独立存在的单个分子的形状(这是本节讨论的对象),它们形成的晶体属于分子晶体。而同样以共价键形成的原子晶体中不存在单个分子,属于“巨型分子”。
2.1 四种晶体
三种化学键形成的物质的晶体有四种:离子晶体(离子键)、原子晶体(共价键)、分子晶体(范德华力)和金属晶体(金属键)。它们的性质比较如表6所示。

表6 晶体的类型和性质的比较
固体包括晶体和无定形体。晶体是由离子、原子、分子等微粒在空间按一定规律的周期性排列所形成的物质。晶体分为离子晶体、原子晶体、金属晶体和分子晶体四类,分别例如:食盐晶体、金刚石、铁、干冰。晶体是固体,但固体不一定是晶体;原子或分子在空间的不规则排列所形成的固体称为无定形体,又称为非晶体,如玻璃、大蜡、松香,等。晶体和无定形体(非晶体)的比较列于表7。

表7 晶体与无定形体的比较
2.2 共价型分子的“形”
由共价键形成的分子结构可通过共价键理论来解释。如图1所示,共价键理论包括路易斯经典的电子配对理论和现代共价键理论,后者包括现代价键理论和分子轨道理论。目前现代价键理论有三个:价键理论(VB法)、杂化轨道理论和价层电子对互斥理论(VSEPR),它们均可不同程度说明分子形状,而包含离域电子的结构可借助分子轨道理论(MO 法)来理解。

图1 各化学键理论的关系
杂化轨道理论在解释多原子共价型分子的空间结构(特别是已知的)方面效果较好。形成共价型分子时,同一原子中若干不同类型、能量相近的原子轨道混合起来,重新分配能量和调整方向组成数目相同、能量相等的新的原子轨道称作杂化轨道。这种混合平均化的过程称作原子轨道的“杂化”。杂化轨道理论认为,在形成分子过程中,通常存在激发、杂化和原子轨道重叠等过程,但孤立的原子不会产生杂化。同种类型的杂化可分为等性杂化和不等性杂化。参与杂化的各原子轨道中所含的未成对电子数相等,杂化后所生成的各杂化轨道的形状和能量完全等同,或者说每个杂化轨道中所含s成分和p成分的比例均相等,这类杂化叫作等性杂化,如BeCl2、BF3和CH4分子中的中心原子分别为sp、sp2和sp3等性杂化,其分子的空间形状分别呈直线型、正三角形和正四面体,相应的键角分别为180°、120°和109°28'。随着p轨道成分的增多,杂化轨道间的夹角(键角)趋向90°(见表8),即p轨道间的夹角。参与杂化的各原子轨道中所含的未成对电子数不等,杂化后所生成的杂化轨道的形状和能量不完全等同,或者说在每个杂化轨道中所含s成分和p成分的比例不等,这类杂化叫作不等性杂化,如NH3分子中N 原子为sp3不等性杂化。产生不等性杂化的原因是由于参加杂化的原子轨道上电子数多于轨道数,即出现了孤电子对。

表8 等性杂化中p轨道成分对键角的影响
根据价层电子对互斥理论,无须知道杂化类型就可预测和解释许多共价键分子的空间构型,尤其是稀有气体化合物。该理论的核心就是ABn共价型分子中的中心原子A 的价层电子对(包括成键电子对和孤电子对)的相互之间尽可能远离,以使斥力最小。可根据价层电子对选择的排布方式(见表9),预测分子的空间形状(见表10,其中比照了相应的杂化轨道类型)。

表9 静电斥力最小的中心原子价层电子对的排布方式
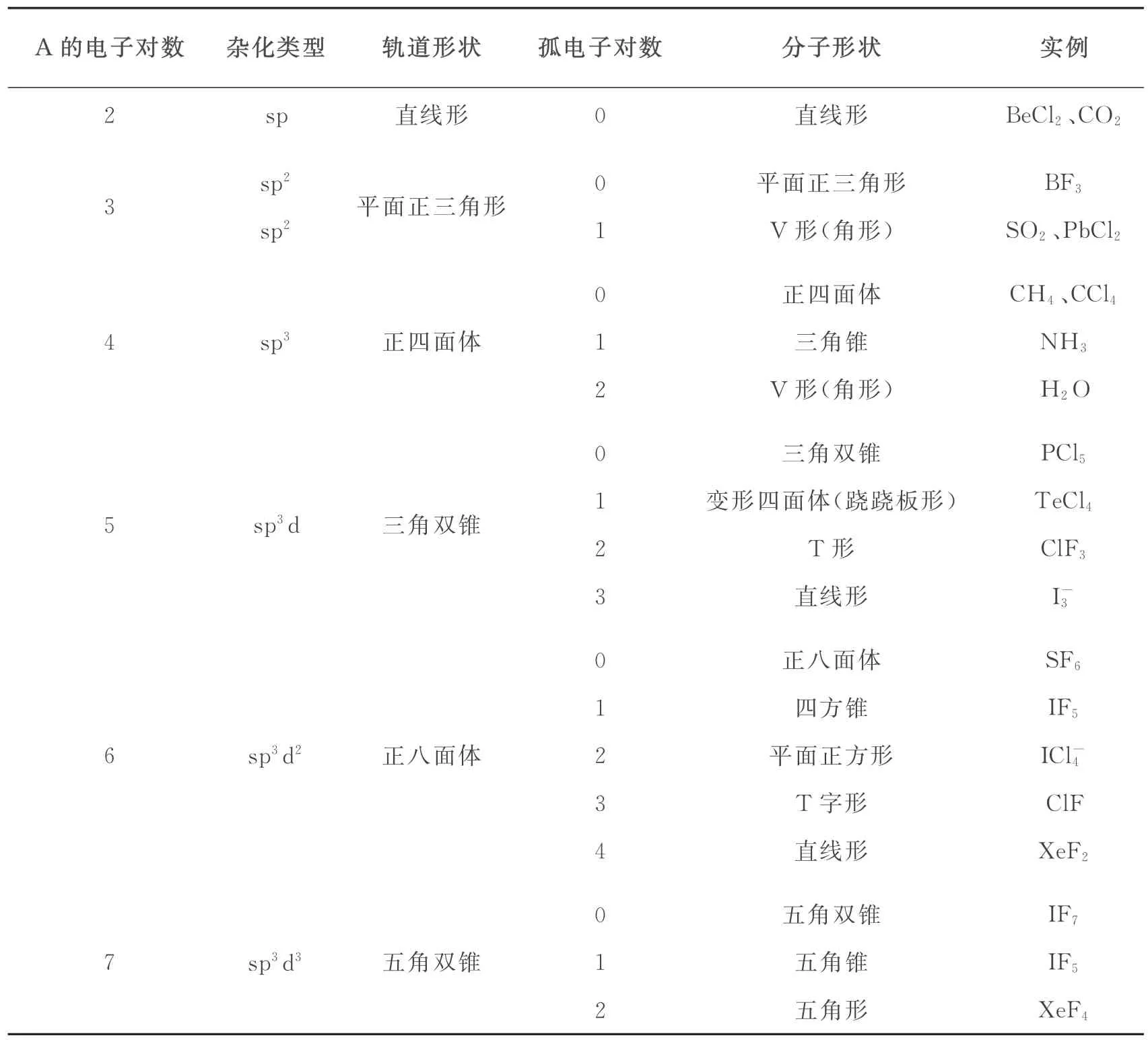
表10 价层电子对互斥理论预测的ABn分子空间构型表(比照原子轨道杂化类型)
2.3 微粒的变形
这里讨论的微粒的变形包括分子的变形和离子的变形。
2.3.1 分子的变形
分子被极化后其外形发生改变的结果称作分子变形。一般地,在讨论分子的极性时只考虑孤立分子中电荷的分布情况,因此若外加外电场时,分子中的电荷分布会产生变化。下面分别就非极性分子和极性分子进行讨论。
置于外电场下,非极性分子电子云与核分别向两极移动(产生相对位移),结果分子发生变形而产生偶极,此过程称作分子的变形,所形成的偶极叫作诱导偶极。外置电场越强,造成分子的变形程度越大,产生的诱导偶极也越大。若取消外电场,所产生的偶极则消失,分子复原为非极性分子。
极性分子本身就存在偶极(固有偶极或永久偶极)。对于非固态的极性分子,外置电场下其偶极会因电场的方向而定向,此过程称作取向;同时在外电场作用下,分子也会产生变形,形成诱导偶极,故极性分子的偶极为固有偶极和诱导偶极之和,导致其极性增加。各极性分子的固有偶极可视为一个外加电场,它会使相邻的分子(非极性或极性)极化变形。这种极化作用会对分子间力产生重要影响。
分子变形性的影响因素:分子越大,电子数越多,其变形性越大;分子越稳定,其变形性越小。
2.3.2 离子的变形
受外电场作用离子发生变形而产生诱导偶极的现象叫离子的变形。影响离子的变形性的因素有离子的半径(主要因素)和离子的电荷数及电子构型:(1)阳离子半径越大、电荷越低,变形性越大;(2)阴离子半径越大、电荷越多,变形性越大;(3)半径与电荷相近时,变形性大小:(18+2)电子型、18电子型的离子>(9~17)电子型离子>8电子型离子。总之,最易变形的是体积大的阴离子和具有(18+2)电子、18电子构型低电荷阳离子。
3 结语
对“无机化学”中“化学键与分子结构”一章主要难点进行梳理与辨析,运用一图十表进行归纳、对比和总结,言简意赅,利于学生掌握该章的知识点。从几年的教学结果看,该方法对提高学生学习本课程的兴趣及动力有帮助,对教学效果的提升有作用,也能更好更快地完成教学目标。
