分子轨道理论在无机化学中的案例教学
2016-06-18廖强强杨延孙丽梅
廖强强++++杨延++++孙丽梅++++闵宇霖++++刘海梅
摘 要: 物质结构理论是无机化学教学过程中一个较难的知识点,通过举例教学可以帮助学生更好地理解深奥的理论知识。以分子轨道理论的讲授为例,引入缓蚀剂的分子轨道理论分析,构建缓蚀剂分子与金属成键的吸附模型,用丰富的图像演绎抽象的理论描述,增强学生的理解能力。
关键词: 无机化学 分子轨道理论 案例教学
1.问题的提出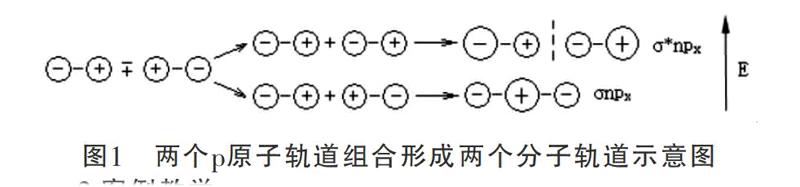
在天津大学编写的《无机化学》教材中,对于分子轨道理论(The Molecular Orbital Method)的基本概念做了如下描述:在分子中任何电子可看成在其所有核和其余电子所构成的势场运动,描述分子中单个电子运动状态的波函数被称为分子轨道;分子轨道可由原子轨道线性组合而成;n个原子轨道线形组合成n个分子轨道;每一分子轨道有一相应能量,分子的总能量等于被电子占据的分子轨道能量的总和;分子轨道同原子轨道一样,容纳电子时也遵循能量最低原理,Pauli原理,Hund规则。该教材将原子轨道组合成分子轨道用图1来描述,该描述中用“+”和“-”表示不同组合方式,分别形成成键轨道和反键轨道。对于这种描述,学生往往不能理解,会提出各种各样的问题。其实,“组合”这个词在这里解释为“原子轨道的叠加”,其中有一半分子轨道分别由正负符号相同的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bonding molecular orbital),如σ、π轨道。另一半分子轨道分别由正负符号不同的两个原子轨道叠加而成,两核间电子的概率密度很小,其能量较原来的原子轨道能量高,不利于成键,被称为反键分子轨道(antibonding molecular orbital),如σ*、π*轨道。把能量等于原子轨道能量的分子轨道称为非键分子轨道(non-bonding molecular orbital)。
2.案例教学
2.1成键轨道、反键轨道和非键轨道
为了对分子轨道理论的基本概念有更好的理解,在课堂教学中通过举例[1]阐述一些基本概念。
烯丙基正离子、自由基和负离子,其原子轨道通过不同的组合方式,所形成的成键轨道、反键轨道和非键轨道也不相同,可如图2表示。烯丙基正离子只在成键轨道上有成对电子,而烯丙基自由基在非键轨道上还有一个单电子,烯丙基负离子在非键轨道上还有成对电子。从图2可以看出,形成分子轨道后,其键能大小依次为:烯丙基正离子?烯丙基自由基?烯丙基负离子,也就是说这三者之中,烯丙基正离子能量最低,最活泼,最容易给出电子参与反应。将深奥的分子轨道理论用这种简单明了的示意图解释,同学们听了很容易理解,对其他类似问题也会用这种办法进行分析。
2.2最高占有分子轨道、最低未占有分子轨道和前线轨道
在分子轨道中,可能含有几个成键轨道,是不是都会参与成键呢?其实在分子轨道理论中还有一种前线轨道理论的概念。在电子占有的分子轨道中,能量最高的分子轨道叫做最高占有分子轨道最高占有分子轨道(Highest Occupied Molecular Orbital,HOMO);在电子未占有的分子轨道中,能量最低的分子轨道叫做最低未占有分子轨道(Lowest Unoccupied Molecular Orbital,LUMO)。把分子轨道中最高占有分子轨道和最低未占有分子轨道统称为前线轨道(Frontier Molecular Orbital)。处在前线轨道中的电子就像原子轨道中的价电子一样是化学反应中最活泼的电子,是化学反应的核心。换句话说,只有前线轨道才可能参与成键。
1,3-丁二烯分子中的四个p轨道线性组合成四个分子轨道,其能级分布和电子填充如图3所示。从图3可以看出,处于成键轨道中的HOMO轨道上的电子是最活泼的电子,容易给出电子,形成化学键。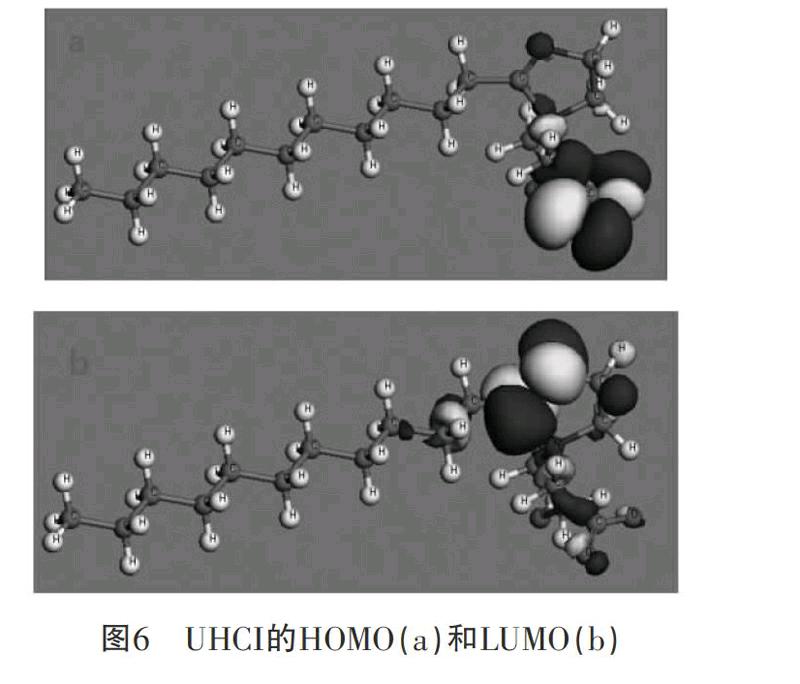
为了更形象地展示前线轨道HOMO和LUMO,采用高斯(Gaussian)软件模拟计算了一种缓蚀剂分子——二乙基二硫代氨基甲酸钠(DDTC)的分子结构,含有碳硫双键[2]。图4为DDTC的分子结构、HOMO和LUMO。从HOMO图上可以看出,电子云在碳硫双键上重叠,两个硫原子上的电子云密度最大,碳硫双键上硫原子最可能给出电子参与成键。通过量化计算将分子轨道中的活性位点直观地表现出来,同学们能实实在在地感受到分子轨道理论解释化学活性问题带来的便利性。
为了进一步直观显示DDTC在铜表面的吸附情况,采用SIESTA软件对其吸附过程进行模拟。图5为DDTC在铜表面的平衡吸附模型。从图5可以看出,DDTC在铜表面的吸附正是通过DDTC上的两个硫原子与铜原子成键完成的。因为硫原子上有未成键的孤电子对,而铜原子的d轨道上有空轨道,满足了形成配位键的基本条件,所以DDTC能牢固地吸附在铜表面。
咪唑啉分子是另一类非常有效的金属缓蚀剂。我们采用Materials Studio软件计算了2-十一烷基-N-羧甲基-N-羟乙基咪唑啉(UHCI)的HOMO和LUMO(图6),并模拟了在水溶液中其在铁表面的吸附模型(图7)。从HOMO图上可以看出,电子云在羧甲基上的重叠密度很大,羧基上的氧原子最可能给出电子参与成键。从图7可以看出,由于UHCI通过羧基上的氧原子牢固地吸附在铁表面,将水分子与铁表面隔开,从而保护铁免于腐蚀。
这两个例子通过分子轨道理论很好地解释了成键分子中的活性位点,以及如何与金属成键,直观、易懂,学生更容易理解。通过分子轨道理论的举例教学,不但将微观的分子结构立体地展现出来,而且很好地阐述了不同物质间的化学相互作用本质。这种教学方式有利于学生理解深奥难懂的概念及理论,从而提高学生的学习兴趣。
3.小结
通过举例教学,将分子轨道理论中一些比较抽象难懂的概念以示意图、模拟图的形式展示出来,有利于学生理解和掌握。这将在原子轨道理论、晶体结构等物质结构理论中进一步丰富举例教学的内容,提高学生学习兴趣。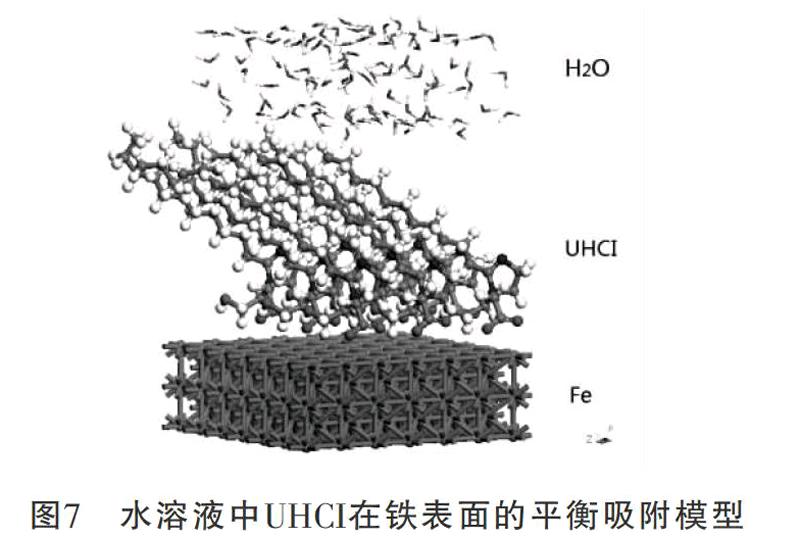
参考文献:
[1]田文芳,毕晓白,蔡民华.浅议生物教学中的举例[J].科学教育,2011,17(6):77-78.
[2]Q.Q.Liao,Z.W.Yue,D.Yang,Z.H.Wang,Z.H.Li,H.H.Ge,Y.J.Li.Inhibition of copper corrosion in sodium chloride solution by the self-assembled monolayer of sodium diethyldithiocarbamate[J].Corrosion Science,2011,53(5):1999-2005.
资助项目:上海电力学院重点核心课程建设项目。
