动态监测降钙素原联合T细胞亚群PD⁃1表达水平对脓毒症预后的预测价值
2021-07-10钟坚李少洪陈金成陈丹张伟李小悦
钟坚 李少洪 陈金成 陈丹 张伟 李小悦
作者单位:1.中山大学附属东华医院(东莞东华医院)急诊医学科,广东,东莞523110
2.遵义医科大学第五附属(珠海)医院重症医学科,广东,珠海519100
脓毒症是重症监护室(itensive care units,ICU)患者死亡的主要原因,调查统计,全世界每年脓毒症患病人数>1900 万,其中病死率高达25%~80%[1]。脓毒症病理机制较为复杂,相关研究表明[2],促炎与抗炎反应所致免疫抑制反应是其主要病理机制,而程序性死亡受体⁃1(programmed cell death⁃1,PD⁃1)在T 细胞亚群的持续性高表达可能是参与免疫抑制形成的直接因素。降钙素原(procalcitonin,PCT)是一种内源性非类固醇类抗炎物质,可调控细胞因子,评估机体感染程度。然而关于PCT 联合T 细胞亚群PD⁃1 表达对脓毒症预后的预测效能临床尚未完全明确,仍需进一步论证。基于此,本研究尝试动态监测PCT联合T 细胞亚群PD⁃1 表达水平对脓毒症预后的预测价值。
1 资料和方法
1.1 一般资料
选择2018年10月至2020年10月本院急诊监护室(emergency intensive care unit,EICU)及ICU收治的195 例脓毒症患者为研究对象,均符合脓毒症诊断标准[3];排除患有肿瘤、自身免疫性疾病及原发器官功能障碍者;入院前2 周使用糖皮质激素或其他能影响免疫功能药物者;长期心源性休克、急性脑血管病变或长期器官灌注异常者。其中女68 例,男127 例,45~72 岁,年龄平均(56.20±4.16)岁;根据28 d 后预后情况分为死亡组(n=37)与生存组(n=158)。本院伦理委员会经审核评议同意本研究,研究对象均知情同意。
1.2 方法
1.2.1 基线资料
采用一般调查问卷收集患者年龄、性别、感染来源、感染类型、急性生理与慢性健康评分(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)[4]、感染相关性器官功能衰竭评分(sepsis related organ failure assessment,SOFA)[5]等内容,其中APACHE Ⅱ评分范围为0~71 分,得分与病情程度呈正相关;SOFA 评分主要包含呼吸系统、血液系统、肝脏系统、心血管系统、中枢神经系统、肾脏等6 项,总分0~24分,评分越低,表示病情越轻,预后越好。
1.2.2 PCT、T 细胞亚群PD⁃1 表达检测
分别于入院时、入院3~4 d、7~8 d 后空腹取外周静脉血4 mL,均分为2 份:①取其中一份,常规离心处理[1 000×g 离心10 min(离心半径8 cm)],取上清液,-80℃低温保存,根据瑞士罗氏公司E170 全自动电化学发光免疫分析仪及配套试剂盒说明书测定血清PCT 水平;②另一份添加适量肝素抗凝,根据美国Becton Dickinson 公司流式细胞仪说明书测定CD3+T 细胞PD⁃1(PD⁃1/CD3+)、CD4+T 细胞PD⁃1(PD⁃1/CD4+)、CD8+T 细胞PD⁃1(PD⁃1/CD8+)、CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 表达。
1.2.3 治疗方法
所有患者均合理应用敏感抗菌药物,同时予以营养支持、扩充血容量、纠正水电解质、酸碱紊乱等基础治疗。
1.3 统计学方法
采用统计学软件SPSS 22.0 处理数据,计量资料用()描述、两组间比较用t检验;计数资料用n(%)表示、χ2检验;采用COX 回归分析脓毒症预后的影响因素;采用Pearson 相关系数模型分析PCT、T 细胞亚群PD⁃1 表达与APACHE Ⅱ、SOFA 评分的相关性;绘制受试者工作特征曲线(ROC)得到曲线下面积(AUC),检验入院3~4 d、7~8 d 后PCT 联合T 细胞亚群PD⁃1 表达对脓毒症预后的预测价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组基线资料比较
两组年龄、性别、感染来源比较差异无统计学意义(P>0.05);感染类型、APACHE Ⅱ评分、SOFA评分比较,差异有统计学意义(P<0.05)。见表1。
表1 两组基线资料比较[n(%),(±s)]Table 1 Comparison of baseline data between 2 groups[n(%),(±s)]
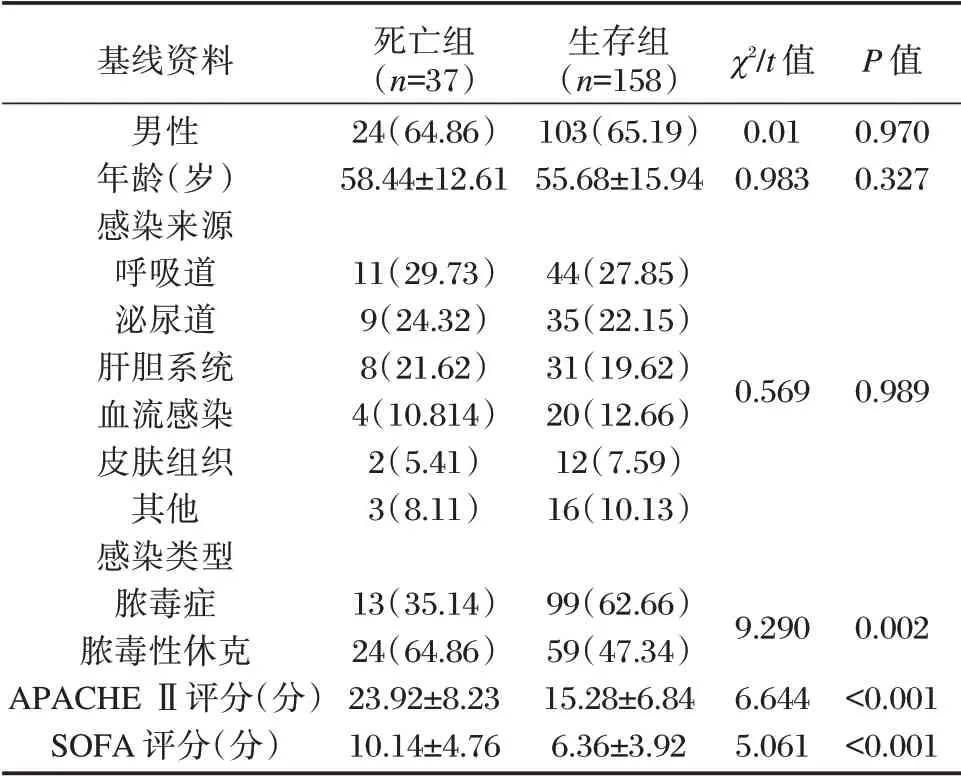
表1 两组基线资料比较[n(%),(±s)]Table 1 Comparison of baseline data between 2 groups[n(%),(±s)]
基线资料男性年龄(岁)感染来源呼吸道泌尿道肝胆系统血流感染皮肤组织其他感染类型脓毒症脓毒性休克APACHE Ⅱ评分(分)SOFA 评分(分)死亡组(n=37)24(64.86)58.44±12.61生存组(n=158)103(65.19)55.68±15.94 χ2/t 值0.01 0.983 P 值0.970 0.327 11(29.73)9(24.32)8(21.62)4(10.814)2(5.41)3(8.11)44(27.85)35(22.15)31(19.62)20(12.66)12(7.59)16(10.13)0.569 0.989 13(35.14)24(64.86)23.92±8.23 10.14±4.76 99(62.66)59(47.34)15.28±6.84 6.36±3.92 9.290 6.644 5.061 0.002<0.001<0.001
2.2 两组不同时间点PCT、T 细胞亚群PD⁃1 表达比较
死亡组入院3~4 d、7~8 d 后PCT、CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 均高于生存组,差异有统计学意义(P<0.05)。见表2。
表2 两组不同时间点PCT、T 细胞亚群PD⁃1 表达比较(±s)Table 2 Comparison of PCT and PD⁃1 expression of T cell subsets between the two groups at different time points(±s)
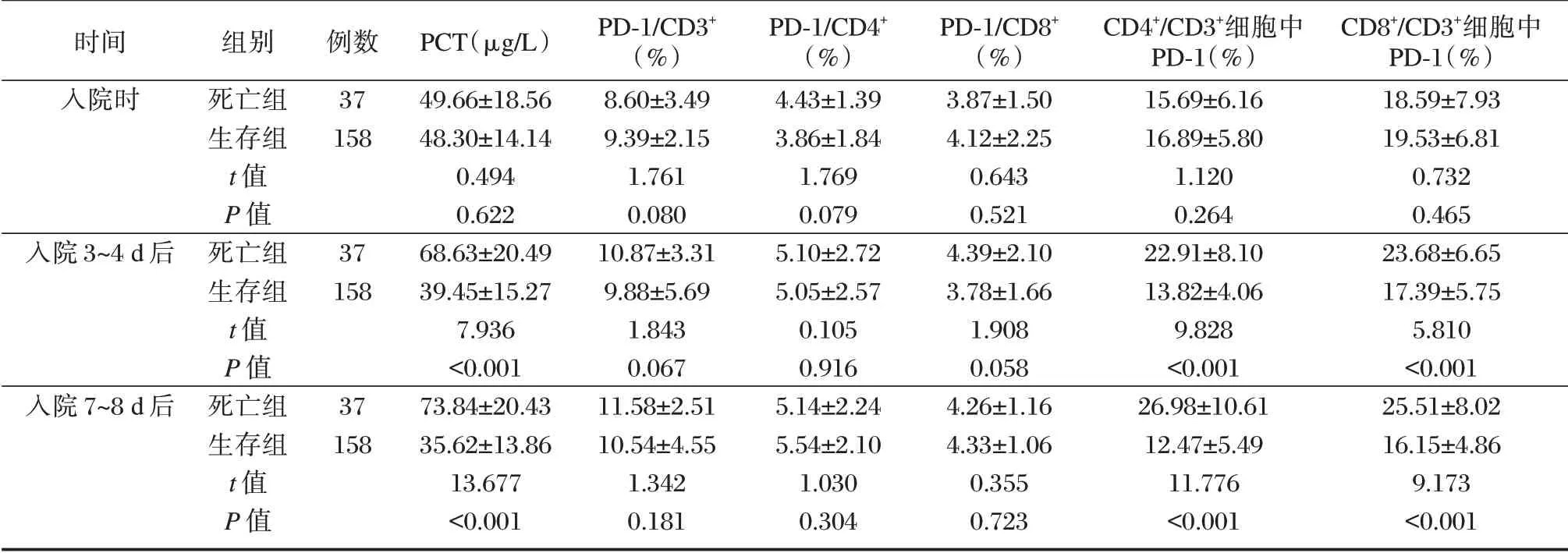
表2 两组不同时间点PCT、T 细胞亚群PD⁃1 表达比较(±s)Table 2 Comparison of PCT and PD⁃1 expression of T cell subsets between the two groups at different time points(±s)
时间入院时例数37 158入院3~4 d 后37 158入院7~8 d 后组别死亡组生存组t 值P 值死亡组生存组t 值P 值死亡组生存组t 值P 值37 158 PCT(μg/L)49.66±18.56 48.30±14.14 0.494 0.622 68.63±20.49 39.45±15.27 7.936<0.001 73.84±20.43 35.62±13.86 13.677<0.001 PD⁃1/CD3+(%)8.60±3.49 9.39±2.15 1.761 0.080 10.87±3.31 9.88±5.69 1.843 0.067 11.58±2.51 10.54±4.55 1.342 0.181 PD⁃1/CD4+(%)4.43±1.39 3.86±1.84 1.769 0.079 5.10±2.72 5.05±2.57 0.105 0.916 5.14±2.24 5.54±2.10 1.030 0.304 PD⁃1/CD8+(%)3.87±1.50 4.12±2.25 0.643 0.521 4.39±2.10 3.78±1.66 1.908 0.058 4.26±1.16 4.33±1.06 0.355 0.723 CD4+/CD3+细胞中PD⁃1(%)15.69±6.16 16.89±5.80 1.120 0.264 22.91±8.10 13.82±4.06 9.828<0.001 26.98±10.61 12.47±5.49 11.776<0.001 CD8+/CD3+细胞中PD⁃1(%)18.59±7.93 19.53±6.81 0.732 0.465 23.68±6.65 17.39±5.75 5.810<0.001 25.51±8.02 16.15±4.86 9.173<0.001
2.3 PCT、T 细胞亚群PD⁃1 表达与APACHE Ⅱ、SOFA 评分的相关性
Pearson 相关性分析可知,入院3~4 d、7~8 d 后PCT、CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 表达均与APACHE Ⅱ、SOFA 评分呈正相关(P<0.05)。见表3。
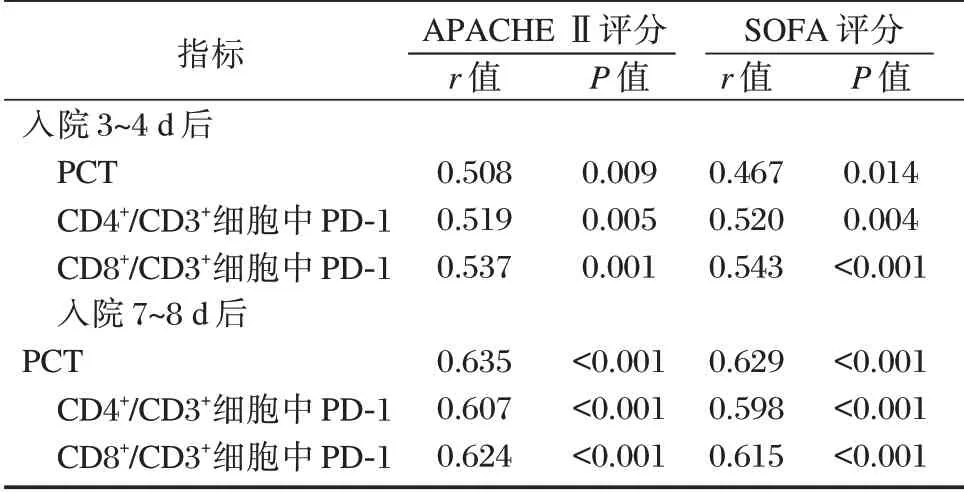
表3 PCT、T 细胞亚群PD⁃1 表达与APACHE Ⅱ、SOFA 评分的相关性Table 3 Correlation between PCT,PD⁃1 expression of T cell subsets and Apache Ⅱ,sofa scores
2.4 脓毒症预后影响因素
以患者28 d 后预后为因变量(生存=0,死亡=1),建立COX 回归模型,将感染类型、SOFA 评分、APACHE Ⅱ评分、血乳酸等其他因素调整后,入院3~4 d、7~8 d 后PCT、CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 表达仍是脓毒症预后的重要影响因素(P<0.05)。见表4。
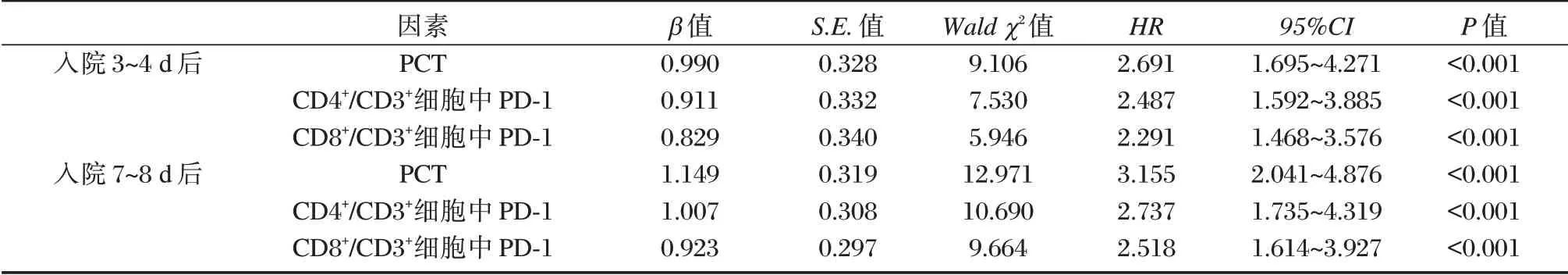
表4 脓毒症预后影响因素COX 回归分析Table 4 COX regression analysis of prognostic factors of sepsis
2.5 不同时间点PCT、T 细胞亚群PD⁃1 表达对脓毒症预后的预测价值
绘制ROC 曲线显示,入院7~8 d 后PCT、CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 表达联合预测脓毒症预后的AUC 大于入院3~4 d 后,敏感度、特异度分别为81.08%、94.30%。见表5。
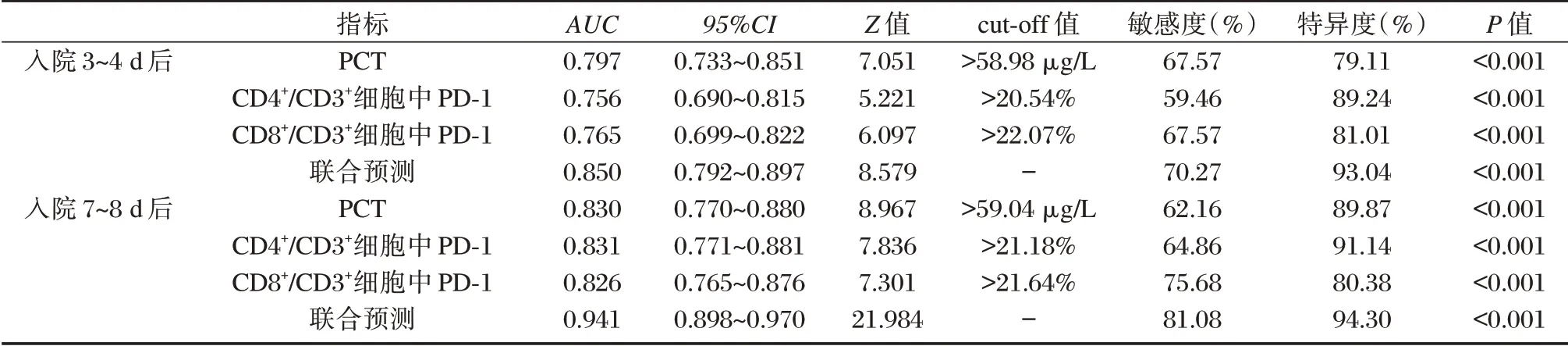
表5 不同时间点PCT、T 细胞亚群PD⁃1 表达对脓毒症预后的预测价值Table 5 the predictive value of PCT and PD⁃1 expression in sepsis at different time points
3 讨论
T 细胞耗竭是促使脓毒症免疫抑制形成的重要机制[6⁃7],而PD⁃1 通过结合程序性细胞死亡蛋白配体⁃1(PD⁃L1),可诱导免疫受体络氨酸转化为基序络氨酸磷酸化,诱导负性信号传输,从而产生负性调节,抑制T 细胞效应及增殖功能。另有学者指出[8],PD⁃1 作为负性共刺激分子,其表达持续上调,提示DCregs 分化,可抑制T 细胞活化,参与外周免疫耐受形成。
本研究显示,CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 在脓毒症死亡患者中呈异常升高表达,结合王宗培[9]研究分析其机制可能在于:T 细胞亚群PD⁃1 表达持续升高一定程度可引发线粒体呼吸功能障碍与糖酵解缺陷,提高CD4+T 细胞凋亡易感性,抑制CD4+T 细胞增殖,诱导Treg 细胞释放大量白细胞介素10,进而激活细胞过度活化保护性反应,降低T 细胞免疫功能,介导持续性不可逆免疫抑制形成,从而增加脓毒症患者死亡风险。APACHE Ⅱ、SOFA 评分是目前临床评估脓毒症患者病情程度的主要指标。本研究经Pearson 相关性分析,入院3~4 d、7~8 d 后CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 表达均与脓毒症死亡患者APACHE Ⅱ、SOFA 评分存在正相关性,这一结果间接反映了T 细胞亚群PD⁃1 表达对脓毒症患者病情严重程度具有研究潜力。
PCT 是临床广泛认可的细菌感染早期生物学标志,其水平在持续性炎症或自身免疫疾病中迅速急剧增加[10⁃11]。王绪松等[12]通过96 例脓毒症患者发现,随时间推移,脓毒症死亡患者PCT 水平出现持续升高,支持本研究观点,这可能归因于脓毒症死亡患者病情严重,感染无法得到有效控制,易诱发多器官障碍综合征,激活炎症级联反应,从而导致血清PCT 水平明显升高。进一步经COX 回归分析可知,入院7~8 d 后PCT HR 值为3.155,表示≥42.87 μg/L 患者在某时刻死亡的危险度是<42.87 μg/L 患者的3.155 倍,佐证了PCT 是脓毒症患者死亡的独立危险因素,但其与赵梦雅等[13]观点存在一定差异,可能与纳入样本量、感染部位、合并器官损伤等情况有关。但由于脓毒症患者病因复杂性及感染程度不一,临床均认为与单一指标预测相比,多个指标联合更能准确评估患者预后。
因此,本研究尝试联合预测,结果显示,入院7~8 d 后PCT、CD4+/CD3+细胞中PD⁃1、CD8+/CD3+细胞中PD⁃1 联合预测脓毒症预后的AUC 大于入院3~4 d 后。提示联合检测PCT、T 细胞亚群PD⁃1表达可作为开展个性化脓毒症治疗、判断患者预后的重要预测手段。
综上可知,动态监测PCT 联合T 细胞亚群PD⁃1表达可为脓毒症早期针对性治疗方案制定、预后预测提供可靠依据。但本研究为单中心病例对照,研究结果仍需大规模、多中心研究进一步证实。
