类风湿关节炎患者外周血腱糖蛋白C与CD4+T细胞亚群的关系
2021-07-09谢戬芳柏欢欢张文琦
王 霞 谢戬芳 柏欢欢 张文琦 郝 楠
类风湿关节炎(rheumatoid arthritis, RA)是一种慢性进行性自身免疫性疾病,其特征为滑膜炎与血管翳形成,关节软骨和骨破坏,最终导致关节畸形和功能丧失[1]。RA的发生、发展是诸多淋巴细胞异常作用的结果,其中CD4+T细胞亚群的失衡是导致RA发病的重要因素[2]。腱糖蛋白C(tenascin-C,TN-C)是一种与组织损伤和重塑相关的细胞外基质糖蛋白,在健康成人组织中的表达非常有限,而在急性炎症刺激下可特异性表达上调,在慢性炎症及组织重塑过程中持续的高表达,参与包括RA在内的多种疾病的发病[3~5]。然而,在RA中TN-C与CD4+T细胞亚群的关系尚不清楚。本研究主要通过观察RA患者外周血TN-C的表达情况,分析其与CD4+T细胞亚群的关系。
资料与方法
1.研究对象:选取2019年1月~2020年1月山西医科大学第二医院收治的RA患者130例,其中男性41例,女性89例,患者平均年龄53.66±14.01岁。所有患者均符合2010年ACR/EULAR的RA分类标准,排除合并其他自身免疫疾病、有严重器官衰竭、感染以及肿瘤患者、严重精神类疾病无法正常沟通者[6]。选择性别、年龄匹配的健康体检者40例为对照组。
2.临床资料:收集RA患者性别、年龄、肿胀关节数(SJC)及压痛关节数(TJC)等一般资料,RF、抗CCP抗体、抗核周因子抗体(APF)、抗角蛋白抗体(AKA)、葡萄糖6磷酸异构酶(GPI)、红细胞沉降率(ESR)、C反应蛋白(CRP)、CD4+T细胞亚群(Th17细胞、Treg细胞)等相关化验指标。同时计算与疾病活动相关的DAS28-ESR评分,将RA患者分为缓解组28例(DAS28≤2.6)和活动组102例(DAS28>2.6)[7]。
3.血清TN-C水平的检测:晨起空腹抽取所有受试者肘静脉血5ml,离心分离血清。采用ELISA检测血清TN-C水平,试剂盒购自美国Cloud-Clone公司。所有步骤均按照仪器规范和试剂说明书进行。
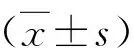
结 果
1.血清TN-C水平的比较:(1)RA患者与对照组血清TN-C比较:RA患者血清TN-C水平显著高于对照组(50.04±8.10ng/ml vs 40.58±4.38ng/ml,P=0.000)。其中活动期RA患者血清TN-C水平高于缓解期(50.58±8.31ng/ml vs 48.05±7.08ng/ml),但差异无统计学意义(P>0.05,表1)。(2)RA患者自身抗体阳性组与阴性组TN-C比较:RA患者中RF、抗CCP抗体、APF、AKA和GPI的阳性数分别为91、89、76、72和24例,阳性率依次为70.0%、68.5%、58.5%、55.4%和18.5%;其中RF、抗CCP抗体阳性血清TN-C高于阴性患者(51.23±8.12ng/ml vs 47.25±7.45ng/ml,51.11±8.06ng/ml vs 47.71±7.79ng/ml,P<0.05),血清TN-C水平与APF、AKA、GPI等比较,差异无统计学意义 (P>0.05,表2)。
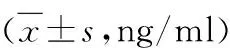
表1 RA组与对照组血清TN-C水平比较
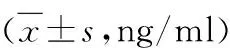
表2 RA患者自身抗体阳性组与阴性组血清TN-C水平比较
2.ROC曲线分析TN-C价值:TN-C的AUC为0.89,敏感度为63.10%,特异性为95.00%,95% CI为0.79~0.91(图1)。
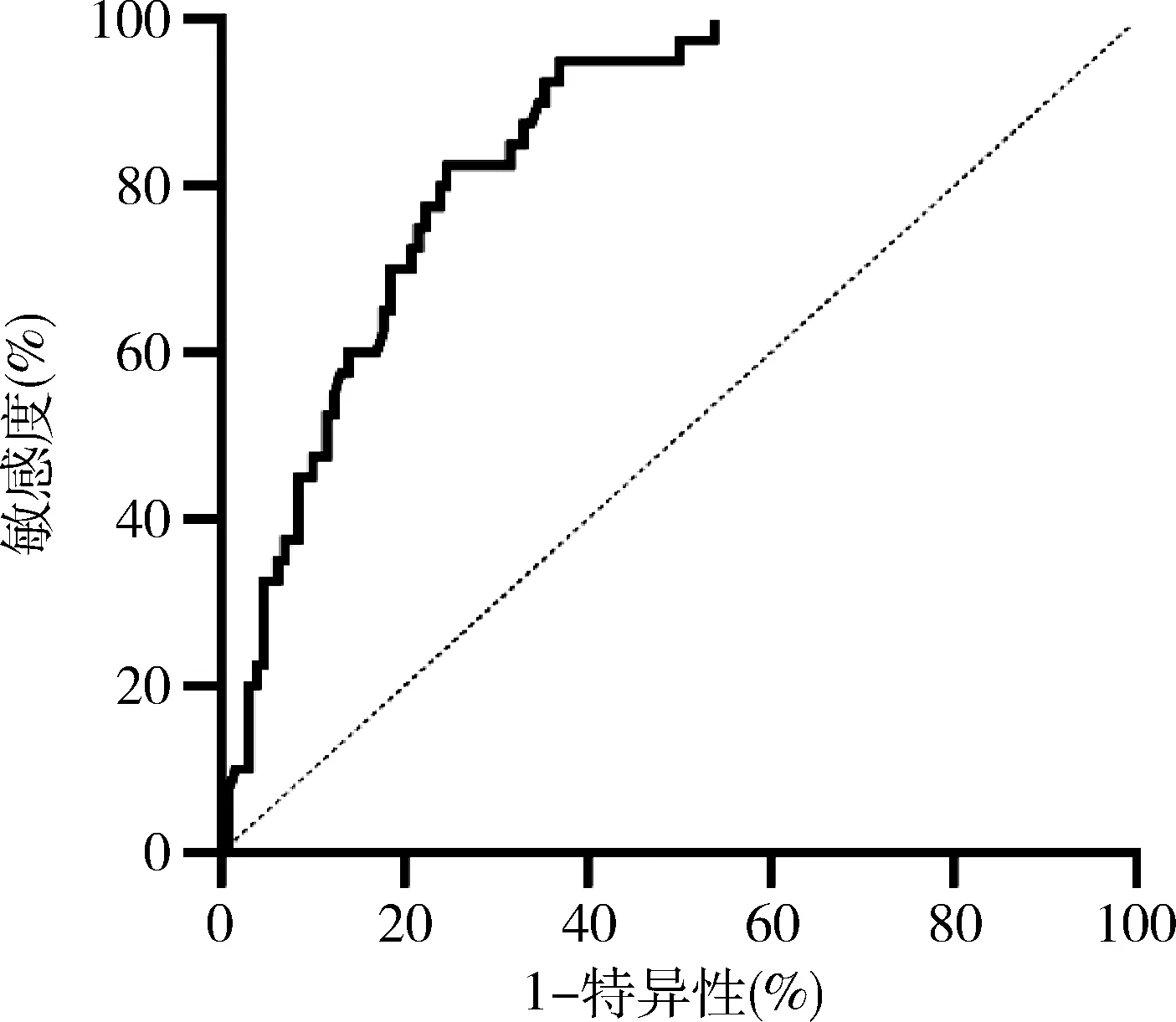
图1 血清TN-C水平的ROC分析结果
3.RA患者与对照组外周血CD4+T细胞亚群比较:通过 ROC曲线确定RA患者血清TN-C的临界值为46.93ng/ml,根据该临界值,将RA患者分为TN-C正常组(n=35)和TN-C升高组(n=95),并与对照组比较所对应的CD4+T细胞亚群计数及百分比。3组间Treg细胞计数及百分比、Th17/Treg比值比较,差异有统计学意义(P<0.01);与对照组比较,TN-C升高组Treg细胞计数及百分比降低,Th17/Treg比值升高(P<0.01),而TN-C正常组的Treg细胞计数及百分比、Th17/Treg比值比较,差异无统计学意义(P>0.05);与TN-C正常组比较,TN-C升高组Treg细胞计数及百分比降低,Th17/Treg比值升高(P<0.01,表3)。

表3 3组外周血Th17、Treg细胞及Th17/Treg比较[M(Q1,Q3)]
4.血清TN-C与CD4+T细胞亚群、临床指标的相关性分析:Spearman相关分析显示,RA患者血清TN-C水平与Treg细胞计数及百分比呈负相关 (r=-0.368、-0.237,P<0.01),与Th17/Treg比值呈正相关(r=0.229,P<0.05)。与Th17细胞计数及百分比、ESR、CRP、SJC、TJC、DSA28均无相关性(表4)。
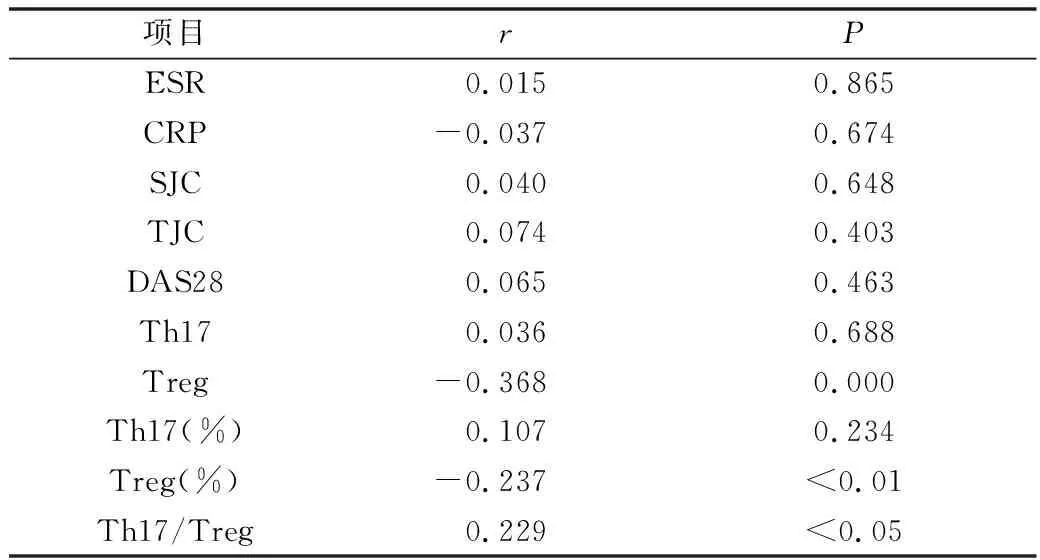
表4 RA患者血清TN-C相关性分析
结 果
RA是一种以慢性滑膜炎、关节进行性破坏为特征的自身免疫性疾病,具有病程长、致残率高、易反复等特点。目前其发病机制尚不明确,免疫细胞功能紊乱参与RA发病已达共识,其中Th17细胞和Treg细胞免疫失衡为关键环节[8]。然而,导致这种失衡的始动因素和调控机制目前尚不清楚。因此,探究RA发病机制,寻找新的有效治疗方法始终是国内外研究关注的热点。
TN-C是一种存在于细胞外基质的糖蛋白,是腱糖蛋白家族中发现最早且最重要的成员,可因mRNA的选择性剪接导致性质及分子量的变化而发挥不同的生物学功能。TN-C在健康成人组织中几乎不表达,但在血管形成、伤口愈合、肿瘤发生及炎症等过程中表达增加[9]。TN-C的表达受多种生长因子、细胞因子、血管活性多肽、细胞外基质蛋白及生物力学因素的调节[10]。研究发现RA患者滑液中TN-C水平较健康成人及骨关节炎患者明显升高[11]。进一步研究发现,RA滑膜成纤维细胞及巨噬细胞中TN-C mRNA的水平较其他细胞明显升高,提示此两种细胞可能与TN-C的合成有关[12]。另有研究发现,在小鼠的关节腔内注入TN-C后可以诱导滑膜炎症的形成,同时TN-C缺陷型小鼠较野生鼠来说炎症的严重程度更轻且更容易从关节炎症中康复[13]。此外,体外培养的滑膜组织中加入TN-C可促进IL-6、IL-8、TNF-α等细胞因子的产生[14]。本研究发现,RA患者血清TN-C高表达,这与既往研究结果相似[15]。然而,活动期RA患者血清TN-C水平仅略高于缓解期,且未发现血清TN-C与RA患者急性期反应物(ESR、CRP)呈相关性,提示TN-C可能通过与炎症无关的机制在RA的发病机制中发挥作用,或者是由于笔者研究的样本量较少,仍需扩大样本量开展进一步研究予以证实。通过ROC曲线分析TN-C诊断价值,AUC 为0.89,敏感度为63.10%,特异性为95.00%。敏感度虽不及RF、抗CCP抗体,但其特异性显著增强,在RA临床诊断上或许可当作一种潜在的辅助检测项目。
相关研究表明,TN-C主要在RA中作为一种损伤相关分子模式与相应受体结合发挥作用。TN-C的纤维蛋白原样球状结构域可与滑膜成纤维细胞及巨噬细胞表面的TLR4结合,通过细胞内信号转导途径诱导多种促炎性因子如IL-6、IL-8、TNF-α的产生,而促炎性因子的产生又可促进TN-C的释放,由此形成一个恶性炎症循环,介导持续性滑膜炎症和组织破坏[16]。TN-C的表皮生长因子样重复结构域及纤连蛋白Ⅲ结构域3~8的TN-C片段可诱导糖胺多糖释放和聚蛋白多糖酶活性,导致软骨基质的降解[17]。临床研究发现,RA患者血清TN-C表达水平与多普勒超声关节骨侵蚀评分相关[18]。RF、抗CCP抗体是目前RA临床诊断、病情严重程度及预后常用指标,此外抗CCP抗体阳性比阴性RA患者易发生严重的关节骨破环。本研究发现,RF、抗CCP抗体阳性患者血清TN-C水平分别高于阴性患者,提示TN-C可能对RA骨侵蚀早期诊断和病情评估具有较高的价值。目前有关TN-C在RA中作用机制的研究尚处于初级阶段,仅涉及与细胞表面受体的作用。既往研究表明,TN-C与其他细胞外基质蛋白及细胞间黏附因子相互作用在细胞移动、细胞外骨架形成等方面有重要意义[19]。RA中TN-C的作用有待于开展分子生物学方面的研究,同时TN-C的临床意义也需开展更多临床实验予以证实。
随着TN-C相关研究的不断深入,TN-C可能通过与树突状细胞(dendritic cells, DCs)表面受体结合,促进病理性Th17细胞分化,诱导IL-17的合成[20]。Machino-Ohtsuka等[21]研究发现,TN-C通过激活DCs和Th17细胞分化加重自身免疫性心肌炎。Mina等[22]研究发现,TN-C可诱导支气管上皮Th2细胞释放大量IL-4、IL-13,导致哮喘的发生。也有研究表明,三阴性乳腺癌患者高表达的TN-C与预后不良相关,与CD8+T细胞呈负相关。本研究中与对照组、TN-C正常组比较,TN-C升高组Treg细胞及百分比降低,Th17/Treg比值升高。此外,Spearman相关分析显示,RA患者血清TN-C水平与Treg细胞计数及百分比呈负相关,与Th17/Treg比值呈正相关。以上研究可知,Treg细胞数量变化、Th17/Treg比值失衡能引起机体免疫反应的异常,导致RA的发生。此外,TN-C可能在调节Treg细胞分化和Th17/Treg免疫平衡中发挥重要作用。
综上所述,RA 患者血清TN-C高表达,外周血Th17/Treg失衡,TN-C可能通过影响Th17/Treg免疫平衡参与 RA 过程,但二者之间的机制有待于进一步研究。
