利用InSyTe FLECT/CT成像技术动态观察急性肺结核小鼠感染模型的构建
2021-07-09李军丽石亚男占玲俊
李军丽 石亚男 占玲俊
阐明结核病发病机制,评估抗结核新药、疫苗和诊断试剂的实验研究中,动物模型是最有效且不可或缺的工具。目前,结核病小鼠模型的建立主要通过气溶胶雾化吸入、滴鼻、腹腔注射及尾静脉注射等常用感染方法,评价模型建立成功与否的金标准则是依照科赫法则(koch postulates)对靶器官荷菌量进行检测[1~3]。而就小鼠的数量、ABSL-3实验室空间以及实验过程中不同时间点获取和培养的动物组织所需其他资源而言,依赖靶器官菌落形成单位(colony-forming units,CFU)计数的常规终点即繁琐又昂贵,且增加了操作过程中的生物安全风险。同时,结核分枝杆菌生长缓慢,需要3~4周时间才能在固体培养基上形成肉眼可见的菌落,这严重阻碍了结核病疫苗和药物的研发速度。因此,需要一种可靠的非侵入性实时定量方法,可以在体外和活体动物中定量分析活的结核分枝杆菌,以缩短预防和治疗药物的筛选周期。
活体动物体内光学成像是近年来发展起来的新技术,通过活体生物发光或荧光成像,研究者能够直接观测荧光标记的活细胞或病原体在动物体内的生物学行为,目前已成为广泛应用于医学、生物学及药物开发等研究领域的前沿技术[4,5]。该技术对疾病动物模型微小病灶的检测敏感度极高,能够进行无创、实时、动态的动物活体观察,能更加准确地反映传染病动物模型中病原体在宿主体内定位及增殖情况,获得的实验结果更加直观可靠[6,7]。此外,对同一实验对象进行不同时间点的反复跟踪和动态观察,避免实验动物间的个体差异及减少实验动物的使用量,使科学研究更加符动物实验伦理中有关动物福利的替代、减少、优化的“3R”原则[8]。
目前,各种荧光素酶生物标记的细菌已用于高通量筛选抗生素和对分枝杆菌的药敏试验,且取得了不少成果[9,10]。本研究通过构建稳定表达近红外荧光蛋白的减毒牛型结核分枝杆菌,并利用InSyTe FLECT/CT多模态成像平台中将荧光断层成像与X线CT扫描相结合的优势,对不同感染途径下急性肺结核小鼠感染模型的建立进行可视化动态观察,为分枝杆菌在体内生长、转移及结核病治疗研究提供理想的动物模型。
材料与方法
1.质粒、菌种与动物:pMV261质粒,E.coli DH5α,Mycobacterium bovis BCG str. Pasteur 1173P2由上海晶诺生物科技有限公司提供,RAW264.7细胞由笔者所在实验室保存。6~8周龄SPF级雌性C57BL/6N小鼠购自北京维通利华实验动物技术有限公司[SCXK (京)-2016-0006]。
2.主要试剂:7H9培养基、7H10培养基、Middlebrook OADC增菌液购自美国BD公司,T4 DNA连接酶、Fast Digest HindⅢ、Fast Digest EcoRⅠ、Phusion®High Fidelity DNA Polymerase (2U/μl)购自美国Thermo Fisher公司,质粒提取试剂盒购自天根生物公司,胶回收试剂盒、细菌基因组提取试剂盒购自美国Omega公司,Trans2K Plus Ⅱ DNA marker购自北京全式金生物技术有限公司,PCR引物由生工生物工程(上海)股份有限公司合成。
3.荧光质粒构建:高保真聚合酶Phusion®High-Fidelity DNA Polymerase PCR扩增iRFP720基因,引物iRFP720-FP/iRFP720-RP分别为:5′-TCCAGCTGCAGAATTCATGGCTGAAGGATCCGTCGC-3′/5′-CGACATCGATAAGCTTTCACTCTTCCATCACGCCGA-3′,反应体系及扩增条件参考产品说明书。扩增目的DNA片段后,琼脂糖核酸凝胶电泳回收纯化目的DNA片段。回收后的目的DNA片段与EcoRⅠ和HindⅢ双酶切线性化的pMV261质粒经无缝克隆重组并转化E. coli DH5α感受态细胞。筛选阳性克隆子pMV261-iRFP720并测序验证,阳性质粒保存备用。
4.BCG感受态菌株制备:挑取新鲜的Mycobacterium bovis BCG str. Pasteur 1173P2(简称BCG)单菌落接种于5ml 7H9 + OADC液体培养基,37℃静置培养3~4周,至菌体的对数生长期(A600为0.6左右)。室温5000r/min离心10min收集菌体,10%无菌甘油洗涤菌体3次,最后经10%无菌甘油重悬菌体,每管200μl分装置-80℃冻存备用。
5.电击转化BCG感受态细胞:10μl阳性pMV261-iRFP720质粒加入200μl BCG感受态菌株中,混匀后室温静置10min,随后转入2mm电转杯中电击,电击参数为:电压2.5kV, 电阻1000Ω,电容25μF。电击完毕后,立即加入1ml 7H9+OADC液体培养基,37℃复苏12h。室温5000r/min离心10min,弃上清,200μl 7H9+OADC液体培养基重悬菌体并均匀涂布至含25μg/ml卡那霉素的7H10+OADC固体平板,37℃恒温培养。
6.BCG-iRFP720荧光菌株验证:37℃培养3~4周后,挑取单克隆菌株接种至含25μg/ml卡那霉素的7H9 + OADC液体培养基,37℃培养4~5周,收集菌体煮沸裂解,以裂解液为模板,PCR验证质粒是否转入菌株中,阳性菌株即为构建成功的Mycobacterium bovis BCG str. Pasteur 1173P2::pMV261-iRFP720荧光菌株(简称BCG-iRFP720)。PCR验证引物JDFP/JDRP分别为:5′-GTGGCAGCGAGGACAACTTG-3′/5′-CCCGACGTCAGGTGGCTAG-3′。
7.荧光菌株体外细胞实验:RAW264.7细胞传代至24孔细胞培养板(1×105cells/ml,100微升/孔),37℃、5% CO2培养5~6h。300μl DMEM培养基洗去未贴壁细胞,每孔细胞补加500μl DMEM完全培养基,同时加入100μl(1×106CFU/ml)BCG-iRFP720荧光菌株。呈米字形摇匀后,37℃分别静置培养24h和48h,300μl无菌PBS洗去凋亡细胞和未被吞噬的荧光菌株,随后进行荧光显微镜观察并拍照记录。
8.荧光菌株体内动物实验:C57BL/6N小鼠随机分成3组,即空白对照组、荧光菌株腹腔注射感染组和荧光菌株尾静脉注射感染组,每组6只小鼠。腹腔注射和尾静脉注射感染组分别经腹腔和尾部静脉注射100μl(1×107CFU/ml)BCG-iRFP720荧光菌株,而空白对照组接种等剂量BCG菌株。感染后1、3、5和7天分别进行InSyTe FLECT/CT活体成像。同时,解剖感染后7天小鼠肝脏、脾脏和肺进行器官离体荧光成像进行验证。全部动物实验操作经笔者单位实验动物管理和使用委员会(IACUC)批准,批准号为ZLJ2019001。
结 果
1.BCG-iRFP720荧光菌株构建及验证:目的基因iRFP720与经EcoRⅠ和HindⅢ双酶切的游离型载体pMV261质粒重组,并转化至E.coli DH5α感受态细胞。抽提质粒并测序验证,阳性质粒pMV261-iRFP720通过电击转化方法转入BCG菌株中,获得荧光菌株,最终通过利用载体上来源于结核分枝杆菌的hsp60基因启动子实现iRFP720基因的表达(图1A)。以抗卡那霉素单克隆阳性BCG菌体裂解液为模板,PCR验证电泳结果显示,pMV261-iRFP720质粒成功转入BCG菌株,获得BCG-iRFP720荧光菌株(图1B)。
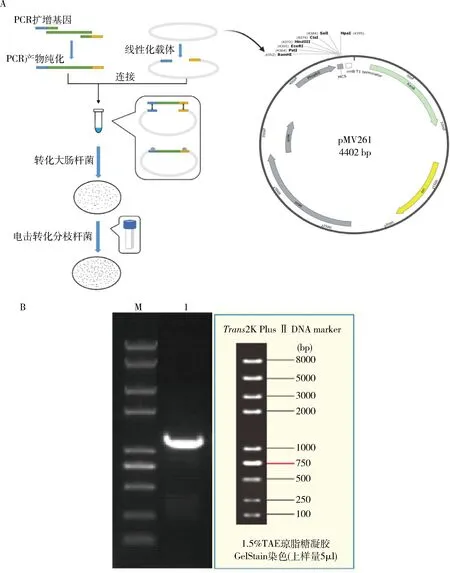
图1 BCG-iRFP720荧光菌株构建及PCR验证A.Mycobacterium bovis BCG str. Pasteur 1173P2::pMV261-iRFP720荧光菌株构建流程;B.PCR验证pMV261-iRFP720质粒转染BCG菌株;M.DNA marker;1.PCR验证BCG中含有pMV261-iRFP720质粒
2.BCG-iRFP720在体外细胞中的荧光信号:pMV261-iRFP720质粒导入BCG菌株,使得该菌株具备激发出红色荧光的特性,不同浓度菌悬液荧光成像显示,菌体红色荧光明显(图2A)。为进一步检测在细胞水平下该菌株的荧光表达情况,对数生长期荧光菌株BCG-iRFP720以MOI为10感染RAW264.7细胞,37℃共孵育24h和48h后,分别进行荧光显微观察。如图2B所示,BCG-iRFP720荧光菌株侵染RAW264.7巨噬细胞后可在细胞中持留并可见明显红色荧光。同时,被BCG-iRFP720荧光菌株感染的细胞形态均有变圆趋势,但随着吞噬时间的延长,红色荧光强度有所减弱。
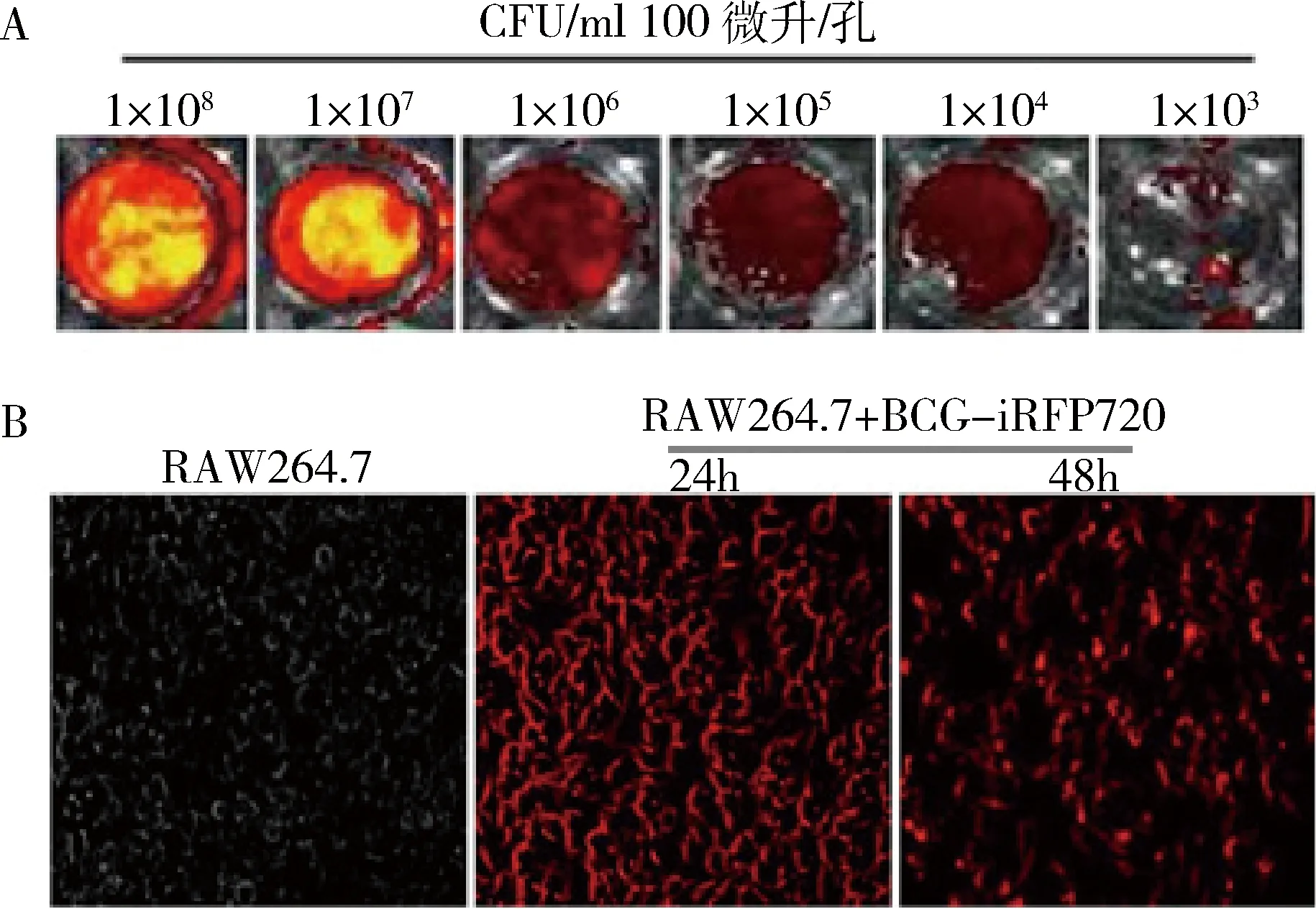
图2 BCG-iRFP720菌体及其在RAW264.7胞内荧光强度检测A.不同浓度Mycobacterium bovis BCG str. Pasteur 1173P2:: pMV261-iRFP720菌株(1×108CFU/ml到1×103CFU/ml, 100微升/孔)自体荧光强度检测;B.对数生长期Mycobacterium bovisBCG str. Pasteur 1173P2:: pMV261-iRFP720荧光菌株感染RAW264.7巨噬细胞24和48h后,胞内荧光强度检测
3.腹腔注射BCG-iRFP720在活体动物上的荧光信号:小鼠经腹腔注射感染BCG-iRFP720荧光菌株后,InSyTe FLECT/CT小动物多模态光学成像系统分析其在680通道波段(激发波长为670nm,发射波长为690~740nm)下的活体荧光成像。结果显示,BCG-iRFP720菌株注射后1、3、5和7天小鼠腹腔均可见明显荧光。随着注射感染时间延长,菌株开始由腹腔注射部位迁移扩散至胸腔及其他部位。并在感染后的第5天,可见胸腔肺部明显荧光(图3)。
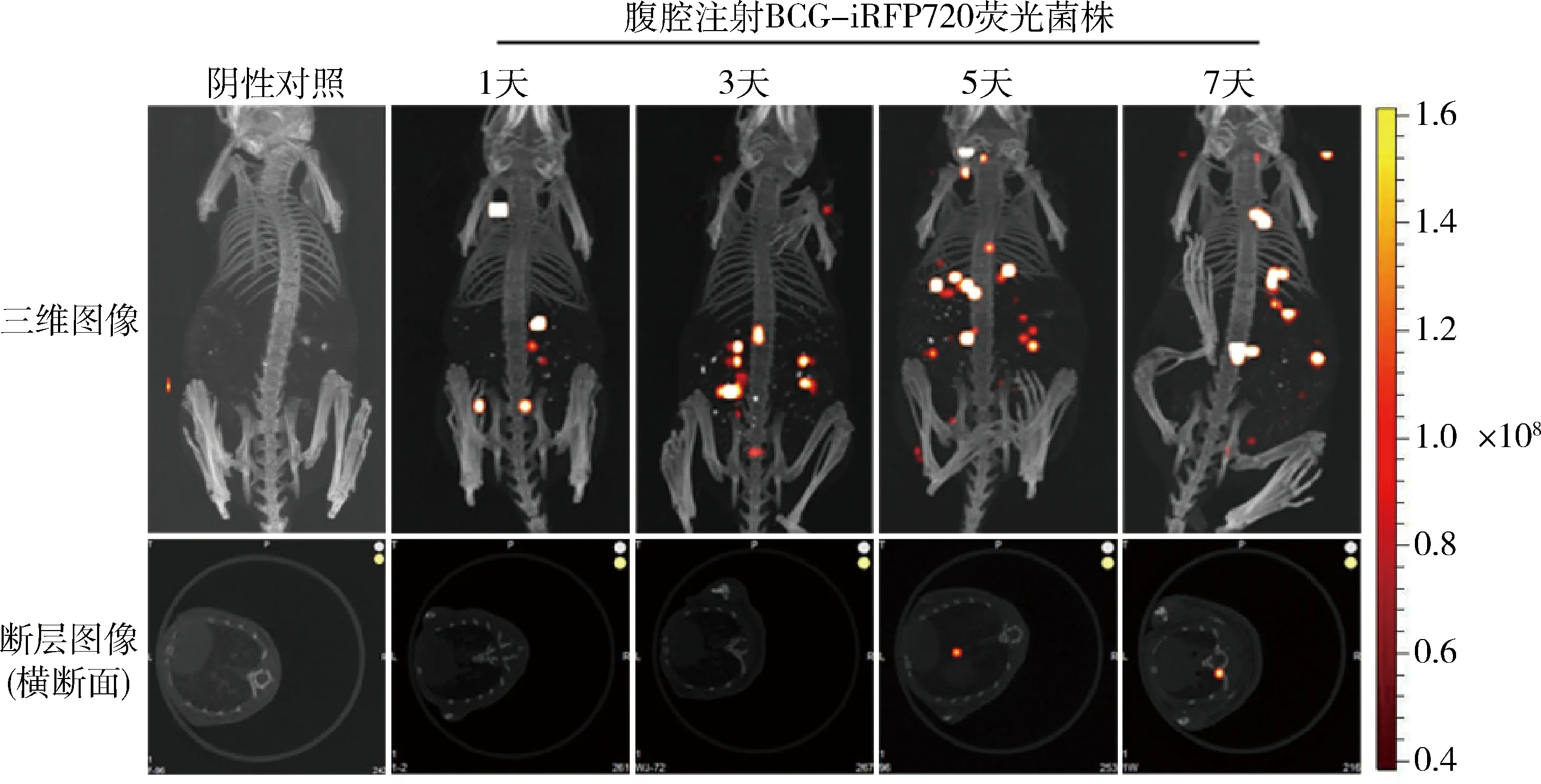
图3 腹腔注射BCG-iRFP720菌株后小鼠活体荧光成像小鼠经腹腔注射100μl的1×107CFU/ml Mycobacterium bovis BCG str. Pasteur 1173P2::pMV261-iRFP720荧光菌株后,不同时间点(1、3、5和7天)小鼠活体荧光成像分析。上图为小鼠正位三维图像,下图为小鼠肺部CT断层图像(横断面)
4.尾静脉注射BCG-iRFP720在活体动物上的荧光信号:BCG-iRFP720菌株经腹腔注射感染后第5天,荧光菌株由腹腔扩散至肺部,为进一步比较不同感染途径在建立急性肺结核模型上的差异,同等剂量荧光菌株经尾静脉注射感染小鼠并进行活体荧光成像动态观察。尾静脉注射感染后第1天,小鼠胸腔肺部即出现明显荧光,且随着感染时间的延长,肺部荧光逐渐增强(图4)。表明尾静脉注射感染后荧光菌株随血液循环至小鼠各脏器部位,且感染后1天左右即可构建急性肺结核小鼠感染模型。

图4 尾静脉注射BCG-iRFP720菌株后小鼠活体荧光成像小鼠经尾静脉注射100μl的1×107CFU/ml Mycobacterium bovis BCG str. Pasteur 1173P2::pMV261-iRFP720荧光菌株后,不同时间点(1、3、5和7天)小鼠活体荧光成像分析。上图为小鼠正位三维图像,下图为小鼠肺部CT断层图像(横断面)
5.BCG-iRFP720在离体器官上的荧光信号:为明确和验证不同感染途径下BCG-iRFP720荧光菌株在小鼠体内的分布情况,小鼠感染后7天,解剖分离肺、脾脏和肝脏进行离体组织器官荧光成像。腹腔注射感染后7天,BCG-iRFP720荧光菌株由腹腔扩散迁移至肺部和肝脏,离体器官荧光成像显示肺部和肝脏呈现明显红色荧光,但未见脾脏红色荧光出现(图5A)。尾静脉注射感染后7天,BCG-iRFP720荧光菌株迅速扩散迁移至肺、肝脏和脾脏,荧光成像可见肺、脾脏、肝脏等组织器官呈现明显红色荧光,且肝脏荧光强度更显著(图5B)。
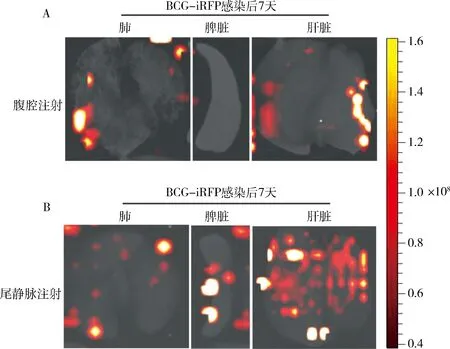
图5 不同感染途径下BCG-iRFP720菌株在小鼠肺、脾脏和肝脏分布情况小鼠经腹腔和尾静脉注射100μl的1×107 CFU/ml Mycobacterium bovis BCG str. Pasteur 1173P2::pMV261-iRFP720荧光菌株后7 天,解剖分离小鼠肺、脾脏和肝脏进行离体器官荧光成像分析
结 果
活体动物体内光学成像主要采用生物发光成像与荧光发光成像两种技术[11]。生物发光是将荧光素酶基因(luciferase)整合到细胞染色体上,使荧光素酶得到持续表达。观察前经外源途径注射其底物-荧光素(luciferin),即可在几分钟内产生发光现象。该类酶在ATP及氧气的存在条件下,催化荧光素的氧化反应才可以发光,且注射一次荧光素只能保持体内荧光素酶标记的细胞发光30~45min。荧光发光则有多种方式,既可以将绿色荧光蛋白(green fluorescent protein,GFP)、红色荧光蛋白(red fluorescent protein,RFP)等荧光报告基团或其突变体基因整合到细胞染色体DNA上以表达荧光蛋白,在激发光源的作用下而发光,也可以利用一些荧光染料标记特定的物质,注入小动物体内而发光。相比生物发光,荧光发光成像具有发光持续性强、无需外源反应底物或辅助因子参与、费用低廉且操作简单等优点。
近红外荧光蛋白是基于光敏素蛋白改造的新型荧光蛋白,近红外光源波长范围为700~900nm,为人类最早发现的非可见光区域[12]。本研究将近红外荧光蛋白基因iRFP720克隆至游离型载体pMV261质粒,最终电转至减毒牛型结核分枝杆菌,通过利用pMV261载体上来源于结核分枝杆菌的hsp60基因启动子实现iRFP720基因的表达。体外菌体、胞内感染以及动物体内感染实验均表明,在激发波长为670nm,发射波长为690~740nm,构建的荧光菌株均能被有效激发出红色荧光,且持续时间较长。荧光发光是通过激发光激发荧光基团到达高能量状态,而后产生发射光,动物体内很多物质如皮毛、血液和脂肪等在受到激发光激发后也会发出荧光,产生的非特异性荧光会影响到检测敏感度[13]。但研究表明,机体在近红外光波段的吸收系数最小、自发荧光最弱且相比于蓝绿光其在体内的穿透性效率高[14~16]。因此,利用表达的iRFP作为标志物,对细菌等生物基本功能单位在空间和时程上的改变进行活体荧光成像成为最佳选择。
在结核病研究中,新型抗结核药物的迫切需求促使药物快筛创新方法的出现以加快药物开发进程[17~19]。传统的结核病小鼠模型在抗结核药物快速筛选早期存在显著瓶颈,部分原因是动物模型中结核菌负担以靶器官组织匀浆CFU来衡量,而结核分枝杆菌在体外复制时间长,固体培养基上生长成肉眼可见菌落可能需要长达4周左右。InSyTe FLECT/CT多模态成像系统采用业界首创的旋转机架式全角度荧光断层成像技术,可以在完整的360°范围内获取CT和荧光数据,实现深层组织的无放射性同位素分子成像[20]。同时,其高敏感度、非损伤性、获取时间短、可实时提供疾病进展和治疗效果替代读数等优点,弥补了上述传统方法所处的困境,特别适合在小鼠中快速筛选候选药物。本研究利用构建成功的近红外BCG-iRFP720荧光菌株,借助InSyTe FLECT/CT多模态成像系统观察腹腔注射和尾静脉注射感染途径下荧光菌株在体内的分布情况,一方面比较两种感染途径在建立急性肺结核感染模型中的差异,利用其可视化的优点,准确定位菌株到达小鼠肺部情况。另一方面,充分获取InSyTe FLECT/CT多模态成像系统各类分析参数,为下一步长期观察H37Ra、H37Rv等有毒分枝杆菌可视化模型奠定基础。
综上所述,本研究成功构建了稳定表达近红外荧光蛋白的减毒牛型结核分枝杆菌菌株,并且运用InSyTe FLECT/CT多模态成像系统对不同感染途径构建的小鼠模型进行了比较观察,为结核药物快速筛选提供了可视化模型,也为今后在疾病模型研究中选择实验动物的活体影像学监测手段积累经验。
