Transferrin在小鼠脑缺血再灌注损伤中的表达及其意义
2021-07-09王志维
张 敏 王志维
心脏血管外科体外循环(cardiopulmonary bypass,CPB)后脑损伤主要表现为脑卒中、认知功能障碍及术后谵妄。心脏外科手术体外循环后脑缺血再灌注损伤是心脏血管外科患者术后预后不良的主要因素之一[1]。有研究表明,高龄(>65岁)、女性、糖尿病史、高血压史是影响CPB后脑缺血再灌注损伤的重要因素[2,3]。因此,降低CPB术后脑损伤的发生率,缓解CPB 术后神经系统并发症是现今心脏血管外科CPB术后亟需攻克的难题。
铁元素是人体所需微量元素中含量最高的元素之一,与人体健康和疾病的发生、发展密切相关,是人体内三羧酸循环及细胞呼吸相关酶类不可或缺的辅助因子。研究表明,在缺血条件下,大脑处于缺氧状态,脑组织所需氧含量增加,导致机体脑组织对铁元素需求增加[4]。此外,老年人作为颅内出血的主要发病人群,去铁胺能加速老年颅脑损伤患者颅内血肿的吸收并抑制脑部水肿[5]。因此,转铁蛋白(transferrin,TF)对维持脑组织细胞内铁稳态、保障铁离子准确、稳定转运至机体细胞极为关键。现今,对于TF在脑缺血再灌中的作用的相关研究较为匮乏,理清铁稳态及相关铁代谢蛋白在脑缺血再灌注损伤中的作用,对于临床心脏血管外科CPB术后脑缺血再灌注损伤防治有着重要意义。
材料与方法
1.动物模型构建与分组:12只雄性C57BL/6J小鼠购自湖北省疾病控制中心。小鼠按随机数字表法分为假手术组(Sham组)和脑缺血再灌注组(IR组),每组6只,饲养于湖北省人民医院动物实验中心。小鼠称重后腹腔注射戊巴比妥(80mg/kg)进行麻醉。待小鼠角膜反射消失后,将麻醉小鼠仰卧固定于操作台,颈部正中切口分离右颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)、颈内动脉(internal carotid artery, ICA)和迷走神经。近心端结扎CCA,动脉夹夹闭右CCA远心端,显微镜下,在动脉夹与近心端结扎处之间显微镊作一切口,插入线栓,取下动脉夹,向ICA方向缓缓推进。当推入阻力显著增强则立即停止插入,活结丝线固定线栓。缺血2h后拔出线栓,缝合手术切口,再灌24h。Sham组不插入线栓,其他操作与IR组一致。模型构建完成后,预冷0.9%氯化钠注射液经心脏灌注,除去体内血液,以4%多聚甲醛经心脏灌注固定各组小鼠脑组织标本,石蜡包埋切片,待后续实验检测。
2.实验细胞:源自大鼠肾上腺髓质嗜铬细胞瘤的PC12细胞系购自武汉大学细胞典藏中心,PC12细胞以含有10%胎牛血清(fetal bovine serum,FBS),5%马血清(horse serum,HS)及1%青链霉素的DMEM培养基进行培养,放置于5%CO2恒温细胞培养箱中。细胞缺氧复氧前弃去细胞原有培养基,PBS洗去剩余培养基,加入无糖无血清DMEM培养基,将细胞放入三气培养箱,缺氧后换正常培养基,放入培养箱复氧12h。其后收集细胞进行检测。通过PC12细胞缺氧复氧在体外模拟脑缺血再灌注病理生理环境,分为对照组(control组)、给予三气培养箱缺氧复氧组(HR组)、Transferrin重组蛋白处理组(TF组)和Transferrin处理后进行缺氧复氧组(HR+TF组)。
3.实验试剂:anti-Transferrin一抗、anti-TFR1一抗和anti-FPN1一抗均购自武汉Proteintech生物技术公司。anti-GAPDH一抗和免疫组化试剂盒购自武汉塞维尔生物公司。BCA试剂盒购自上海碧云天生物科技公司。Tunel试剂盒购自上海翊圣生物公司。
4.免疫组化:组织切片常规脱蜡、水化。0.2%Triton破膜15min,PBS洗3次,每次5min,枸橼酸盐缓冲液微波修复,3%H2O2室温下封闭组织内过氧化物酶,山羊血清封闭1h,封闭完毕后,血清弃去不洗,一抗4℃孵育过夜,次日清洗后,二抗室温孵育1h。DAB显微镜下显色,中性树脂封片,显微镜下观察。
5.免疫荧光:细胞爬片,按照实验分组要求处理完毕后,弃去培养基,预冷PBS洗去残留培养基,弃去PBS,4%多聚甲醛固定5min,PBS洗3遍,每次5min。0.2%Triton破膜10min,山羊血清封闭1h,血清弃去不洗,一抗4℃孵育过夜,洗去非特异性结合一抗。二抗常温孵育1h,洗去非特异性结合二抗,DAPI复染,抗荧光淬灭封片剂封片,全自动荧光显微镜下观察并拍照。
6.Tunel染色:细胞爬片,按照实验分组要求处理完毕后,弃去培养基,预冷PBS洗去残留培养基,弃去PBS,4%多聚甲醛固定5min。按照试剂盒操作说明书进行操作,其后以抗荧光淬灭封片剂封片,全自动荧光显微镜下随机选取5个视野进行统计分析。
7.Western blot法检测:细胞处理完毕后,预冷PBS洗去残余培养基,胰酶消化,培养基终止消化,收集消化所得细胞混悬液,1000r/min离心5min,弃上清。PBS重悬细胞,洗去残余培养基,1000r/min离心5min,弃上清,加入适量体积含蛋白酶抑制剂的RIPA蛋白裂解液,冰上裂解10min。超声后在预冷冷冻离心机内以离心。取上清,BCA法测蛋白浓度,加入蛋白上样缓冲液,100℃金属浴15min,蛋白样品制备完成后冻存于-80℃冰箱。制备10%浓度的SDS-PAGE凝胶,每孔蛋白上样量为20μg,浓缩胶电压65V,分离胶电压90V进行电泳;200mA恒流电转2h,一抗4℃孵育过夜;二抗常温孵育1h,Odessy荧光成像系统扫膜,所获条带以Image J进行半定量统计分析。
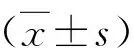
结 果
1.脑缺血再灌注对铁代谢相关蛋白表达的影响:通过免疫组织化可见,IR组TF表达较对照组显著上调;IR组TFR1、FPN1蛋白表达较对照组显著降低。表明铁转运相关蛋白在脑缺血再灌过程中有着极为重要的作用(图1)。
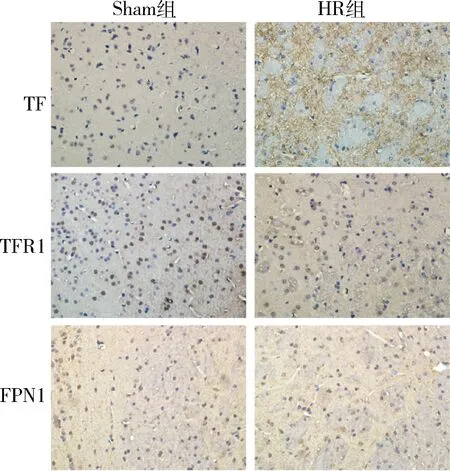
图1 小鼠脑缺血再灌后TF、TFR1、FPN1的表达变化免疫组化染色,×400
2.PC12细胞系缺氧复氧对铁代谢相关蛋白表达的影响:通过Western blot法检测发现,PC12细胞缺氧复氧后,HR组TF表达较对照组显著上调;HR组TFR1与FPN1表达较对照组显著降低,差异有统计学意义(P<0.05),与体内实验的结果基本一致(图2)。
图2 PC-12细胞缺氧复氧后TF、TFR1、FPN1表达变化A.Western blot法检测结果;B~D.分别为TF、TFR1、FPN1与内参GADPH比值统计图。与对照组比较,*P<0.05
3.TF处理后PC12活性氧情况比较:按照分组要求对细胞进行相应处理,收集细胞染色后行流式检测发现,HR组较对照组ROS水平显著上升,且差异有统计学意义;TF组与对照组ROS水平比较差异无统计学意义;HR+TF组与HR组比较,PC12中ROS水平显著降低,差异有统计学意义,可见给予TF重组蛋白可以显著减轻PC12细胞中由缺氧复氧所致ROS水平升高(图3)。

图3 TF重组蛋白处理后PC12细胞ROS水平变化A.流式结果;B.各组DHE平均荧光强度。与对照组比较,*P<0.05;与HR组比较,#P<0.05
4.TF处理后PC12细胞凋亡情况比较:在对各组细胞行Tunel染色发现,对照组与TF组无明显细胞凋亡;HR组较对照组细胞凋亡水平显著升高,且差异有统计学意义(P<0.05);而HR+TF组较HR组细胞凋亡比率显著降低,且差异有统计学意义。也就说明Transferrin能够在一定程度上减轻由缺氧复氧所致的PC12神经元细胞凋亡(图4)。
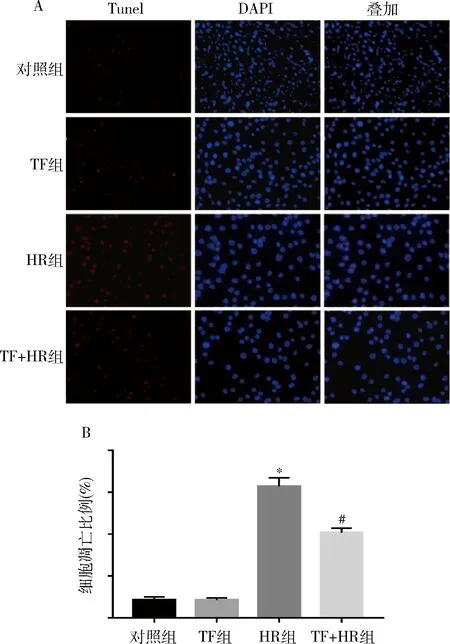
图4 TF重组蛋白处理后PC12细胞凋亡水平变化A.免疫荧光结果(Tuneil染色,400倍);B.各组细胞凋亡比例。与对照组比较,*P<0.05;与HR组比较,#P<0.05
讨 论
随着心脏外科技术与设备的不断发展,体外循环辅助下的心脏外科手术成功率稳步提升。但随着患者的年龄逐渐增加,脑缺血再灌注损伤仍然是CPB的主要并发症[3]。因此,研究脑缺血再灌中的具体机制及可能的干预靶点,对于CPB所致的脑缺血再灌注损伤的防治极为重要。Lee等[6]研究发现,短暂性前脑缺血(transient forebrain ischemia,TFI)后,铁超载会导致氧自由基产生和海马CA1区域神经元细胞延迟性死亡(delayed neuronal death,DND)。与此同时, Zhao等[7]通过体内外模型研究证实,装载番茄红素的纳米脂质体颗粒可以促进TF的表达,调节细胞内铁离子水平,抑制炎性细胞因子分泌,降低活性氧产生,进而保护神经元细胞免受脑缺血再灌损伤。
传统中医药与脑损伤后铁代谢也有诸多研究成果。葛等通过大鼠脑缺血模型发现,脑泰方可以降低脑出血所致神经元细胞铁超载水平,增加细胞抗氧化能力,减轻细胞凋亡,发挥神经保护作用[8]。与此同时,郭纯等[9]研究发现,安脑平冲方可以通过下调细胞内TF与TFR的表达,降低神经元细胞内铁离子水平,防止铁超载,进而起到脑出血后神经保护作用。可见铁稳态对于脑损伤相关疾病的发生、发展具有极其重要的作用。正常情况下,铁稳态受到铁代谢相关蛋白的严密调控,因此铁代谢调控相关蛋白极可能是脑缺血再灌注损伤发生的重要节点。
铁稳态调控相关蛋白主要包括TF、TFR1、FPN1等。铁离子主要经由小肠吸收,在体内通过与TF结合进行转运,TF与细胞膜上的TFR1及TFR2结合,形成TF-TFR复合体,通过细胞膜内吞作用进入到细胞内,胞内部分铁离子维持参与细胞正常生理功能,部分铁以铁蛋白的形式贮存于细胞内,进而参与到细胞正常的生理活动之中。铁离子进入细胞后,经由FPN1转运出细胞,主要来源于肝脏的铁调素可以调控FPN1的表达,进而实现铁代谢的动态调控[4]。关于铁代谢相关蛋白在缺血再灌注损伤中的表达及作用尚不明确,因此,本研究通过体内、外实验验证在缺血再灌注环境下,铁代谢相关蛋白的表达变化及其对缺血再灌注损伤所造成的影响。
本研究通过免疫组化检测了参与铁代谢相关蛋白的表达变化。可见TF在IR组表达较Sham组显著增多。TFR1、FPN1表达在IR组较Sham组表达明显降低。在体外实验中,通过对PC12细胞系进行缺氧复氧发现TF、TFR1及FPN1表达变化与在体脑缺血再灌基本一致。铁稳态调控过程中,TF表达增多导致铁转运入细胞内增多或FPN1的表达降低导致铁转出减弱,是否是所致神经元细胞内铁超载主要原因需要进一步研究。有研究表明,空载的TF可以结合胞外游离Fe3+,降低氧化应激反应并有利于呼吸衰竭的恢复[10]。Fe3+自身氧化还原特性对于ROS的产生极为重要,ROS积聚会导致神经元细胞氧化损伤。因此降低细胞外Fe3+浓度,减轻Fe3+的细胞氧化毒性对于神经元细胞保护极为重要[11]。
本研究发现,TF表达增高,推测其可能通过结合细胞外游离的Fe3+,降低胞外Fe3+的细胞毒性作用,进而对PC12细胞缺血再灌注损伤起到保护作用[12,13]。ROS水平升高与细胞凋亡增多是缺血再灌注损伤严重程度的主要指标,为了验证TF在脑缺血再灌注损伤中的作用,笔者检测各组PC12细胞内ROS水平,通过Tunel检测细胞凋亡比率发现,HR组细胞ROS水平及细胞凋亡水平较对照组显著增高,HR组+TF组较HR组细胞活性氧水平显著降低,细胞凋亡显著减少。可见在Transferrin重组蛋白处理细胞后,其可能通过结合培养基中的Fe3+,降低胞外游离Fe3+的浓度,并在一定程度上降低缺氧复氧所致PC12内的ROS水平,同时降低细胞凋亡率[14]。
综上所述,空载TF可以通过降低胞外Fe3+浓度,减少ROS积聚减轻CPB后脑损伤,针对CPB后脑损伤高危患者,通过外源性输注适量单位的TF或许对于CPB辅助心脏外科术后脑损伤的防治具有积极作用[15,16]。本研究通过体外细胞模型发现,在缺氧复氧条件下TF能降低PC12细胞系内ROS水平,同时减少细胞凋亡,对于TF应用于CPB后脑损伤提供基础研究依据。当然,本实验也存在一些不足,主要是未在体外模型中研究TF对脑缺血再灌注损伤的效果进行评估。再者,未评估TF对于机体其他组织器官的正常功能是否有影响,这些也是后续研究的内容[17,18]。
