Let-7d*在增生性血管疾病中的表达及其作用机制△
2021-07-09秦姗姗刘远辉
邵 帅,余 烊,秦姗姗,刘远辉,谭 宁
[广东省心血管病研究所心内科 广东省冠心病防治研究重点实验室 广东省人民医院(广东省医学科学院),广州 510080]
随着社会经济的发展,心血管事件发生呈逐年递增的趋势[1]。虽然目前已有公认的最佳治疗方法,但动脉粥样硬化等增生性血管疾病仍是全世界健康的主要威胁[2-3]。研究表明,在已确定的危险因素中,血管平滑肌细胞(vascular smooth muscle cell,VSMC)的增殖是动脉粥样硬化类血管疾病发病的主要因素[4]。而VSMC 的表型转化是VSMC 增殖的关键初始步骤,并且VSMC 的异常增殖与动脉粥样硬化的发展密切相关[5]。微小RNA(microRNA,miRNA)是一类新的内源性、小分子的非编码RNA,研究表明他们可调控细胞中超过30%的基因表达[6-7]。MiRNA 最初在细胞核中转录形成一个大分子的初始miRNA。然后,将初始miRNA 在细胞核中加工成长度约70 个核苷酸的miRNA 前体,之后,miRNA 前体进入细胞质。在细胞质中miRNA 双链中的一条链转变成长度约18~24 个核苷酸的成熟的miRNA。MiRNA 双链中的另一条通常会快速降解并被认为是无活性的产物,被称之为“过客miRNA”或miRNA*(miRNA*)。然而,最近的研究表明,一些miRNA*可以长时间维持在细胞质中,尽管它们的生物学功能仍不清[8-9]。研究发现,miRNA 通过调节VSMC 的增殖在动脉粥样硬化类血管疾病的发病过程中发挥功能性作用,所以miRNA 表达异常可能与心血管疾病的发生、发展有关。miRNA参与动脉粥样硬化等增生性血管疾病的分子机制已逐渐成为心血管研究的热点。Let-7是一个miRNA 家族,基本成员包括Let-7a-1、7a-2、7a-3、7b、7c、7d、7e、f7-1、7f-2、7g 和7i 等。众所周知,Let-7家族成员在不同物种间序列高度保守,并在血管系统中高度表达。目前的相关研究认为Let-7家族成员是VSMC增殖的关键调控因子,可能参与动脉粥样硬化等血管增生性疾病的发生、发展[10-15]。然而,迄今为止,Let-7家族中Let-7d*的表达谱及其在VSMC和血管疾病中的潜在生物学作用尚不清楚。因此,本研究探究Let-7d*在增生性血管疾病中的表达及其相关作用机制。
1 材料和方法
1.1 动物及细胞来源
本研究所使用的无特定病原体(SPF)级雄性SD 大鼠均由美国Jackson Lab 提供。所有实验动物均给予实验动物3R 原则的人道主义关怀。本研究采用酶分离法从5 周龄雄性成年SD 大鼠主动脉中获得VSMC,VSMC 采用含有10%胎牛血清和1%青霉素/链霉素的DMEM 细胞培养基进行培养。对于所有实验,均使用培养至第3 至6 代的大鼠的VSMC。
1.2 主要试剂
细胞培养基及细胞培养常用试剂:高糖型DMEM 培养基(Dulbecco′s modified eagle′s medium,DMEM)、DMEM/F12 50/50、1X 培养基(Dulbecco′s modified eagle′s medium,DMEM/Ham′s F-12 50/50 Mix)购自美国Cellgro 公司;胎牛血清(fetal bovine serum,FBS)、马血清、胰蛋白酶均购买自美国Sigma 公司;磷酸盐缓冲液(phosphate-buffered saline,PBS)购自美国Fisher Scientific 公司。细胞处理试剂:本实验消化处理大鼠血管组织所用的胶原酶是购买自Worthington Biochemical 公司;本实验所用的各种siRNA 产品均购自美国Dharma⁃con 技术有限公司;RNA 提取试剂TRIzol 购自美国Thermo Scientific 公司;转染试剂购自美国加利福尼亚州查茨沃斯凯杰公司。逆转录实验试剂:逆转录酶(MultiScribeTMreverse transcriptase)、逆转录缓冲液[Taq DNA Polymerase PCR Buffer(10×)]以及无酶水购自美国Thermo Scientific 公司;随机引物(Random Primer)购买自Integrated DNA Technol⁃ogies 公司;终浓度 为100 mmol/L 的dNTP 预混液(dNTP Mixes)购自Biotium公司;核糖核酸酶抑制剂(RNase inhibitor)购买自Fisher Scientific 公司。定量聚合酶链反应(quantitative polymerase chain re⁃action,qPCR)实验所用试剂:qPCR 主混合工作液(Luminaris HiGreen qPCR Master Mix)购自美国Thermo Scientific 公司;特异性引物(Primer)购买自Integrated DNA Technologies 公司;无酶水购自美国Thermo Scientific 公司。本实验选用其他试剂盒:MMT 实验试剂购买自Sigma-Aldrich 公司;4′,6-二脒基-2-苯基吲哚(4′,6-Diamidino-2-Phenylin⁃dole,DAPI)染料购自Vector Laboratories 公司;EdU试剂购自美国Fisher 公司。腺病毒购买自美国Clontech 公司,异氟烷购买自美国VET one 公司。
1.3 主要仪器设备
实验仪器包括qPCR 仪QuantStudio3(美国Thermo Scientific 公司),NanoDrop2000/2000c(美国Thermo Scientific 公司),细胞培养二氧化碳(car⁃bon dioxide,CO2)孵育箱(美国Thermo Scientific),倒置显微镜(日本Olympus 公司),超净工作台(美国Thermo Scientific 公司),-80 ℃超低温冰箱(美国Thermo Scientific 公司),-20 ℃无霜低温冰箱(美国Thermo Scientific 公司),4 ℃低温冰箱(美国GE 公司),微量分析天平(瑞士Ohaus 公司),PCR 仪(美国Thermo Scientific 公司),高速离心机(美国Ther⁃mo Scientific 公司),超速冷冻离心机(美国Thermo Scientific 公司),数字照相显微镜(日本Olympus 公司),荧光照相显微镜(日本Olympus 公司)。石蜡切片机(德国徕卡公司),动物手术显微镜(美国AmScope 公司),小动物呼吸麻醉机(美国Kent Sci⁃entific 公司),组织标本显微镜拍照系统(SZ61;SC180),术后加热康复系统(美国Stryker 公司),显微外科手术器械(德国F.S.T 公司),电灼刀(美国Bovie 公司),22 号套管穿刺针(美国Thermo Sci⁃entific 公司),6-0 带线缝合针(日本MANI 公司)。
1.4 大鼠球囊损伤模型构建方法
大鼠完成麻醉与备皮后,铺无菌单,在解剖显微镜下,通过颈中线切口露出右颈总动脉。通过动脉切开术将一个2F Fogarty 导管(Baxter Edwards生命科学公司)引入颈外动脉,然后将导管推入肩胛舌骨肌的近端。为了造成颈动脉损伤,我们用0.9%氯化钠溶液将球囊充气,然后在肩胛舌骨肌近端到颈动脉分叉处抽3次。出现球囊损伤后,在颈总动脉的结扎段连续输注(100 μL)Ad-Let-7d*(5×109pfu/mL)或Ad-GFP(5×109pfu/mL)溶液30 min[16]。之后,使用6-0缝合丝线永久性结扎颈外动脉,恢复颈总动脉中的血流。上述操作完成后,可将大鼠放入鼠笼,腹腔注射镇痛剂布托啡诺镇痛。
1.5 血管内膜损伤形成的形态测定分析方法
通过计算机图像分析系统Scion Image CMS-800 对苏木素伊红染色切片进行形态测定分析,具体参考文献[16-17]。将受损颈动脉分成6 等份,从而获得6个切片(5 μm厚)用于该分析。针对每个切片,计算内膜面积与中膜面积的比例I/M,然后取平均值,并将平均I/M值用作各对应老鼠的I/M数值。
1.6 增殖性血管平滑肌细胞的诱导方法
在培养至第3至6代的大鼠VSMC中,加入浓度为20 ng/mL 血小板源性生长因子(platelet derived growth factor,PDGF)或血清(10%FBS)诱导其增殖。
1.7 Let-7d*表达的测定方法
分别采用miRNA 芯片及q-PCR 测定正常大鼠颈动脉及球囊损伤大鼠颈动脉中的Let-7d*表达水平;分别采用miRNA 芯片及q-PCR 测定正常VSMC 及增殖性VSMC 的Let-7d*的表达水平。
1.8 统计学分析
采用SPSS 17.0 统计软件对数据进行分析。计量资料以()表示,采用双侧t检验和单因素方差分析,以P<0.05 为差异有统计学意义。对于基因相对表达,溶剂对照组的平均值设定在100%或1。
2 结果
2.1 正常大鼠颈动脉与球囊损伤大鼠颈动脉中的Let-7d*表达比较
Let-7d 家族的star 表达谱包括Let-7a-1*、7a-2*、7a-3*、7b*、7c*、7d*、7e*、7f-1*、7f-2*、7g*、7i*[18]。通过miRNA 芯片测定后,结果显示只有Let-7d*(7d*)在正常大鼠动脉中高度表达。并且在大鼠血管中使用miRNA 芯片测定未发现Let-7家族其他成员的miRNA*的表达。如图1A 所示,miRNA 芯片测定结果显示,在球囊损伤诱导新生内膜生长的大鼠颈动脉中的Let-7d*表达比在正常大鼠颈动脉中明显降低。为了验证Let-7d*在球囊损伤大鼠颈动脉中的异常表达,分别于球囊损伤大鼠颈动脉后的第7 天、14 天、28 天收样,从中提取RNA(在这3个时间点的血管都有内膜增殖),用q-PCR 检测Let-7d*在球囊损伤大鼠颈动脉中的表达,结果如图1B 所示:与正常对照组相比,在血管内膜增殖的大鼠颈动脉中Let-7d*表达显著下降。
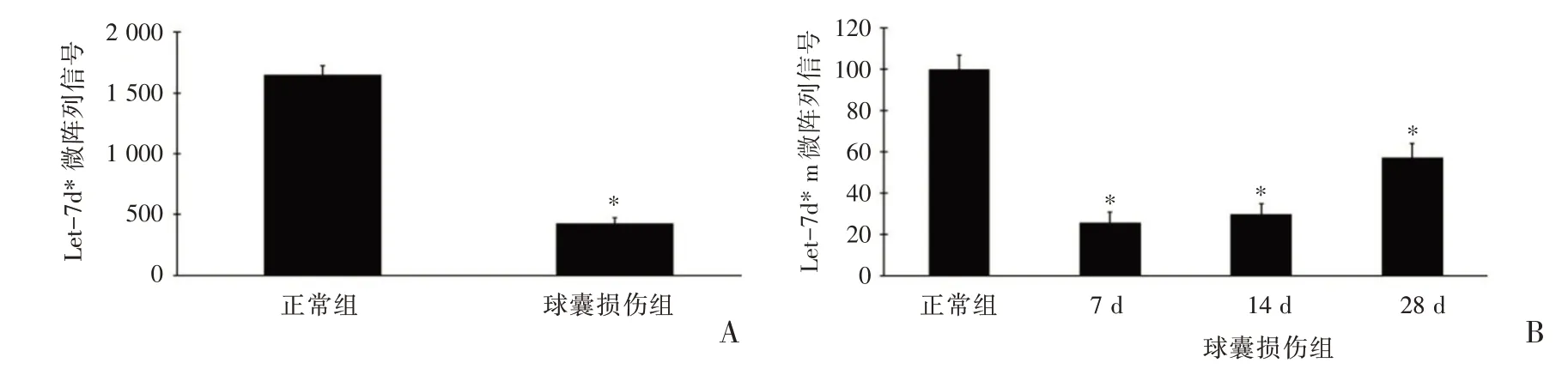
图1 正常大鼠颈动脉与球囊损伤大鼠颈动脉中的Let-7d*表达比较(A 图为Let-7d*miRNA 芯片测定结果比较;B 图为球囊损伤大鼠颈动脉后的第7 天、14 天、28 天q-PCR 检测结果比较)
2.2 正常VSMC与增殖性VSMC的Let-7d*表达比较
VSMC 是血管壁的主要组成细胞,尤其是在球囊损伤后的血管。因此,我们假设VSMC 中Let-7d*表达的变化可能反映了动脉粥样硬化的血管中let-7d*表达的变化。为了验证这一点,我们首先测定了Let-7 家族中star miRNAs 的表达谱,结果表明,在人工培养的VSMC 中只发现了Let-7d*,并且高度表达,这与我们从血管中获得的结果是一致的(图2A)。增殖性VSMC 的Let-7d*的表达与正常VSMC 中的表达比较,显著下降,差异有统计学意义(P<0.05),见图2B 和2C。
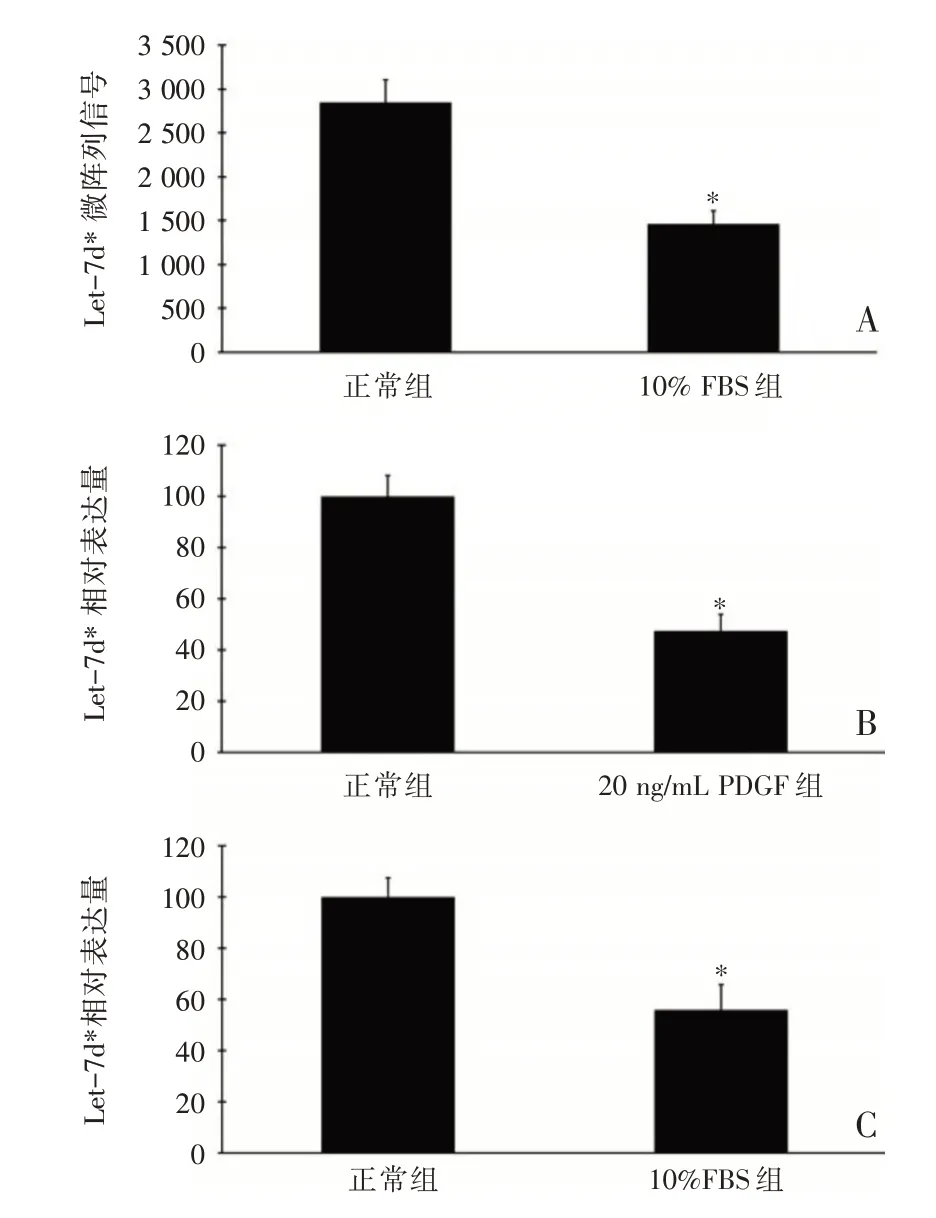
图2 正常VSMC 与增殖性VSMC 的Let-7d*表达比较(n=6,A 图为Let-7d* 的miRNA 微阵列信号;B 图为正常VSMC 与体外培养的20 ng/mL PDGF 诱导增殖的VSMC 的Let-7d*表达比较;C 图为正常VSMC 与体外培养的10%FBS 诱导增殖的VSMC 的Let-7d*表达比较)
2.3 正常大鼠颈动脉与球囊损伤大鼠颈动脉中的pri-Let-7d*及成熟Let-7d*表达比较
与正常大鼠颈动脉比较,球囊损伤大鼠颈动脉的成熟Let-7d*表达明显下降,差异有统计学意义(P<0.05);球囊损伤大鼠颈动脉pri-Let-7d*的表达与正常大鼠颈动脉比较,差异无统计学意义(P>0.05),见图3。
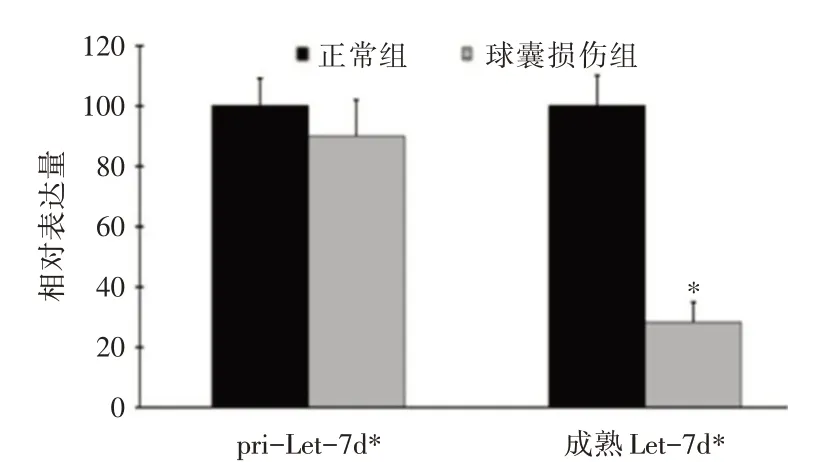
图3 正常大鼠颈动脉与球囊损伤大鼠颈动脉中的pri-Let-7d*及成熟Let-7d*表达比较
2.4 正常VSMC 与增殖性VSMC 的pri-Let-7d*及成熟Let-7d*表达比较
与正常VSMC 比较,增殖性VSMC 的成熟Let-7d*表达明显下降,差异有统计学意义(P<0.05);增殖性VSMC 的pri-Let-7d*的表达与正常VSMC比较,差异无统计学意义(P>0.05),见图4。

图4 正常VSMC 与增殖性VSMC 的pri-Let-7d*及成熟Let-7d*表达比较
2.5 过度表达及下调Let-7d*表达对体外培养的VSMC 的增殖作用比较
为了测试Let-7d*在VSMC 的增殖中的潜在作用,在体外培养的VSMC 中通过pre-let-7d*(30 nmol/L)(过度表达)和Anti-let-7d*(30 nmol/L)(下调)分别调控细胞中Let-7d*的表达水平(图5A)。Anti-Let-7d*下调Let-7d*基因的表达增加了细胞的增殖(图5B~5D);图5E 显示了不同组VSMC 的典型EdU 图像。
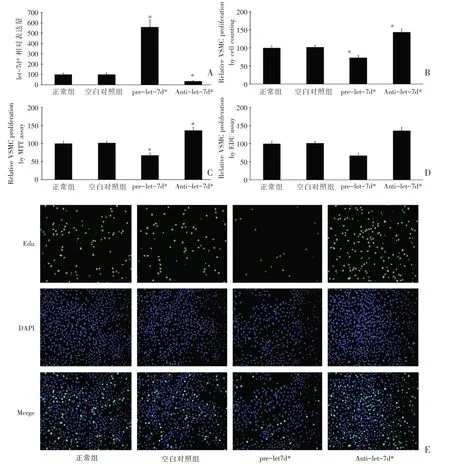
图5 过度表达及下调Let-7d*表达对体外培养的VSMC 的增殖作用比较(A 图为在体外培养的VSMC 中通过30 nmol/L pre-let-7d*和30 nmol/L Anti-let-7d*分别调控细胞中Let-7d*的表达水平;B 图为细胞计数法测定结果;C 图为MTT 法测定结果;D 图为EDU 法测定结果;E 图为各组VSMC 的代表性EDU 图像)
2.6 Let-7d*对大鼠球囊损伤后颈动脉血管内膜损伤形成的影响
为了研究Let-7d*对血管内膜损伤形成的影响,我们制备了表达Let-7d*的腺病毒(adenovirus,Ad),并将其导入球囊损伤的大鼠颈动脉。如图6A 所示,Ad-let-7d*增加了Let-7d*的表达。在球囊损伤后2 周,与空白对照组及空白Ad(Ad-GFP)治疗的大鼠相比,Ad-let-7d*治疗的大鼠血管内膜损伤形成明显受到抑制(图6B)。Ad-GFP 组和Ad-let-7d*治疗组大鼠颈动脉的典型苏木素伊红染色显微照片如图6C 所示。

图6 Let-7d*对大鼠球囊损伤后颈动脉血管内膜损伤形成的影响(A 图为Ad-let-7d*增加了Let-7d*的表达;B 图为球囊损伤后2 周,空白对照组、空白Ad(Ad-GFP)组及Ad-let-7d*治疗组大鼠血管内膜损伤情况比较;C 图为各组大鼠颈动脉的典型苏木素伊红染色光学显微镜下图片)
3 讨论
增生性血管疾病的主要特征是血管内膜增生,其中VSMC 的增殖是关键性的细胞活动。动脉粥样硬化性血管疾病是威胁全世界人民健康的主要杀手[19-20],因此,研究增生性血管疾病新机制并探索新的治疗途径具有重要性和紧迫性。
近年来,miRNA 中let-7 家族已经被广泛研究,并被发现在血管疾病中发挥重要作用[10-14],但其在血管细胞生物学和血管疾病中的作用尚未被探索。本研究结果显示,在let-7 家族的众多成员中,只有Let-7d*在VSMC 和血管壁中高度表达。通常情况下,miRNA*在体内迅速降解,因此,在细胞中没有或只有极低水平的miRNA*。VSMC 和血管中有高水平Let-7d*的原因目前尚不清楚。本研究的另一个重要发现就是Let-7d*在VSMC 和增生性血管疾病血管壁中的表达显著降低。
miRNA生物合成的调控是复杂的,它可能发生在转录水平(从DNA 到初级miRNA)和转录后水平(从初级miRNA到miRNA前体,或从miRNA前体到成熟miRNA)这些阶段[21]。本研究发现,Let-7d*表达的转录后调节是其在增殖性VSMC和增生性血管疾病中下调的主要机制,从pri-Let-7d*到成熟的Let-7d*的转录后表达调控是导致Let-7d*在增殖性VSMC和病变动脉中异常表达的关键步骤。
Let-7d*在VSMC中的生物学功能尚不清楚。本研究发现,Let-7d*在VSMC的生长中有很强的抑制作用,表现为通过Anti-let-7d*下调Let-7d*基因的表达使VSMC的细胞增殖增加,以及通过Pre-Let-7d*使Let-7d*过度表达可使VSMC的细胞增殖减少。
由于Let-7d*在球囊损伤后内膜增生的动脉中的表达下降,本研究应用了Ad载体递送的Let-7d*来检测其对血管内膜增生的影响。研究结果表明,Let-7d*对大鼠颈动脉新生内膜增生有明显的抑制作用。
虽然本研究阐明了Let-7d*在大鼠及细胞模型中的表达趋势和其相应的生物学功能,但是Let-7d*在人体的表达及人体细胞模型中的具体功能仍有待进一步探究。同时,从pri-Let-7d*到成熟的Let-7d*的转录后表达调控的具体分子机制也有待进一步研究。本课题组通过生物信息学分析发现,高尔基体Golph3 在其3‘非翻译区(3′-UTR)中具有Let-7d*的结合位点。因此,高尔基体Golph3 可能是Let-7d*的潜在直接靶基因。但确认Golph3 是否为其直接靶基因,还需要通过后续系列的实验来验证。
综上所述,本研究发现,在VSMC 和内膜增生的血管壁中Let-7d*表达下调,并且从pri-Let-7d*到成熟的Let-7d*的转录后表达调控是导致Let-7d*在增殖性VSMC 和病变动脉中异常表达的关键步骤。本研究通过在大鼠与细胞模型中调控Let-7d*的表达,发现Let-7d*在VSMC 的生长中有很强的抑制作用,并且对大鼠颈动脉新生内膜增生有明显的抑制作用。因此,Let-7d*可能成为临床上针对增生性血管疾病一种新的检测指标,同时,靶向作用于Let-7d*及其上下游分子通路的药物可能为增生性血管疾病提供一种新的治疗方法。
