微流控芯片法在非洲猪瘟病毒核酸快速检测中的性能分析
2021-07-08邵靓陈弟诗陈斌卢先东邓飞张毅刘艳红周莉媛李丽
邵靓,陈弟诗*,陈斌,卢先东,邓飞,张毅,刘艳红,周莉媛,李丽
(1. 四川省动物疫病预防控制中心,四川 成都 610041;2. 宁波爱基因科技有限公司,浙江 宁波 315100)
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的一种急性、热性、高度接触性传染病,发病率和死亡率可达100%。目前尚无有效疫苗。被世界动物卫生组织(OIE)列为法定报告疫病,被我国列为一类传染病[1-2]。到目前为止,我国共发生非洲猪瘟疫情190余起,覆盖全国31个省份。根据非洲猪瘟防控新形势,农业农村部正在逐步建立常态化防控机制。当前,各养殖企业、屠宰场、无害化处理场等场所,以及各级兽医主管部门、动物疫病防控和卫生监督机构等都在广泛开展非洲猪瘟实验室检测,亟需大量敏感、快速、操作简便的检测试剂。
微流控芯片技术是通过生物学、化学、医学、电子、材料、机械等多学科交叉,将样品前处理、分离及检测等过程集成到几平方厘米的芯片上,从而实现分析的微型化、自动化、集成化和便携化的技术,具有样品消耗少、检测速度快、操作简便、多功能集成、体积小和便于携带等优点,极大地拓展了体外诊断的应用空间,已在分子生物学、化学分析、医学等多个领域得到应用[3-5]。本研究评估了微流控芯片法在ASFV核酸快速检测中的各项性能,并和市场上的ASFV荧光定量PCR检测试剂盒进行比对分析,为ASF的快速检测提供了新手段,也为我省ASF的防控提供了技术支持。
1 材料与方法
1.1 主要试剂
磁珠法核酸提取试剂盒购自天隆生物科技有限公司;明日达ASFV微流控芯片快速检测试剂盒由宁波爱基因科技有限公司提供;ASFV荧光定量PCR检测试剂盒购自哈尔滨国生生物科技股份有限公司。
1.2 样品
ASFV VP72质粒标准物质由中国动物疫病预防控制中心提供。
猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪传染性胃肠炎病毒(TGEV)、猪圆环病毒2型(PCV2)和伪狂犬病毒(PRV)培养物由四川省动物疫病预防控制中心提供。
ASFV临床样品为采集自四川养殖场、屠宰场的猪全血、口鼻拭子、环境拭子,共43份。
1.3 病毒核酸提取
按照磁珠法核酸提取试剂盒说明书提取各检测样本核酸,置于-20 ℃保存备用。
1.4 微流控芯片检测系统
本研究采用了预埋好特异性扩增引物的微流控芯片(如图1A),扩增靶基因为ASFV VP72。芯片由4个独立单元构成,每个单元由2个加样孔和8个反应槽构成,每个加样孔与 4个反应槽相连,但加样孔之间以及反应槽之间不连通。将核酸和反应液混匀后加入加样孔,用透明膜密封加样孔,利用离心力定向驱动样本流动进入反应池(图1B,绿色部分所示),样本可以均匀分配到4个反应孔;放入微流控芯片检测仪恒温扩增(如图1C);经过实时荧光读取,信号输出,呈现结果。当待检样品在30 min内扩增出特异性曲线,判为ASFV核酸阳性;当待检样品在30 min内未扩增出特异性曲线,判为ASFV核酸阴性。
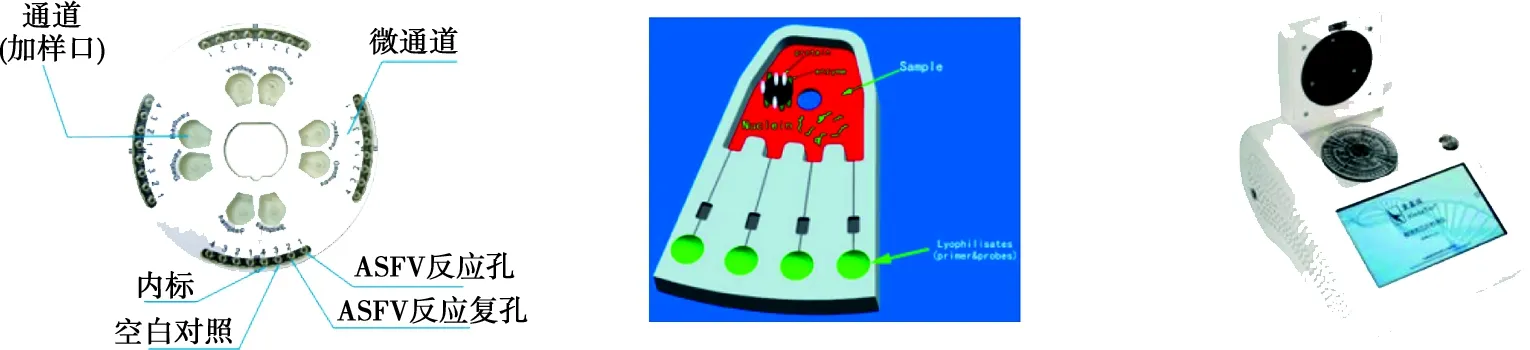
A. 微流控芯片;B. 微流控芯片的加样孔、微通道和检测孔结构;C. 微流控恒温扩增仪
1.5 敏感性试验
将ASFV VP72质粒标准物质进行梯度稀释后,用ASFV微流控芯片法检测,分析该方法的敏感性,并与荧光定量PCR结果进行比较。
1.6 特异性试验
采用CSFV、PEDV、TGEV、PCV2、PRV培养物样本,分析ASFV微流控芯片特异性,ASFV VP72质粒标准物质作为阳性对照。
1.7 重复性试验
用稀释到2.5和5×101copies/μL的ASFV VP72质粒标准物质作为重复性测试试验的样本,用微流控芯片法和荧光定量PCR法同时进行检测,重复8次。计算微流控芯片测得的2种浓度样本CV值,评估该方法的重复性。
1.8 临床样本检测
收集43份临床样本,采用微流控芯片法进行检测,并与荧光定量PCR法进行对比,分析结果,并计算符合率。
2 结果
2.1 ASFV微流控芯片敏感性
采用梯度稀释的ASFV VP72质粒标准物质(5×103、5×102、5×101、25、5、2.5、1.0、0.5、0.05 copies/μL),分析ASFV微流控芯片的检测敏感性,结果如图2、表1所示,微流控芯片的最低检出限是2.5 copies/μL,与市场上商品化的荧光定量PCR试剂盒的敏感性一致。
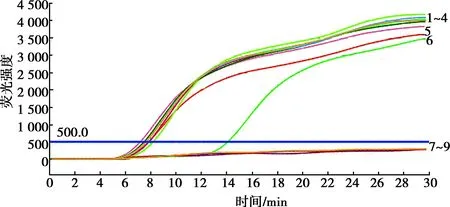
1~9. 分别为5×103、5×102、5×101、25、5、2.5、1.0、0.5和0.05 copies/μL
2.2 ASFV微流控芯片特异性
如图3所示,除阳性对照出现明显“S型”扩增曲线外,其他样本检测结果均为阴性,表明该ASFV微流控芯片与其他病原无交叉反应,特异性良好。
2.3 ASFV微流控芯片重复性
用稀释到2.5 copies/μL的ASFV VP72质粒标准物质作为重复性测试试验样本时,3次阳性,5次阴性(图4A、表2),微流控芯片法和荧光定量PCR法结果一致;用稀释到5×101copies/μL的ASFV VP72质粒标准物质作为重复性测试试验样本时,8次结果均为阳性(图4B、表2),微流控芯片法和荧光定量PCR法结果一致。计算微流控芯片测得的2种浓度样本CV值,结果表明2.5 copies/μL的测试样本和5×101copies/μL的测试样本的CV值分别为2.1%和2.2%(表3),重复性良好。
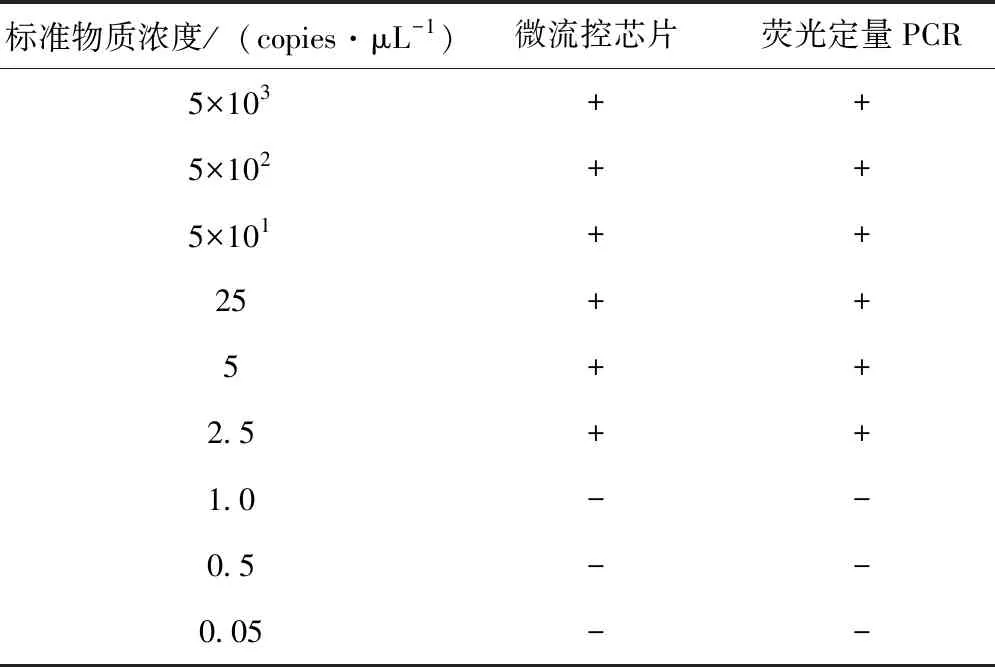
表1 ASFV微流控芯片与荧光定量PCR敏感性测试结果
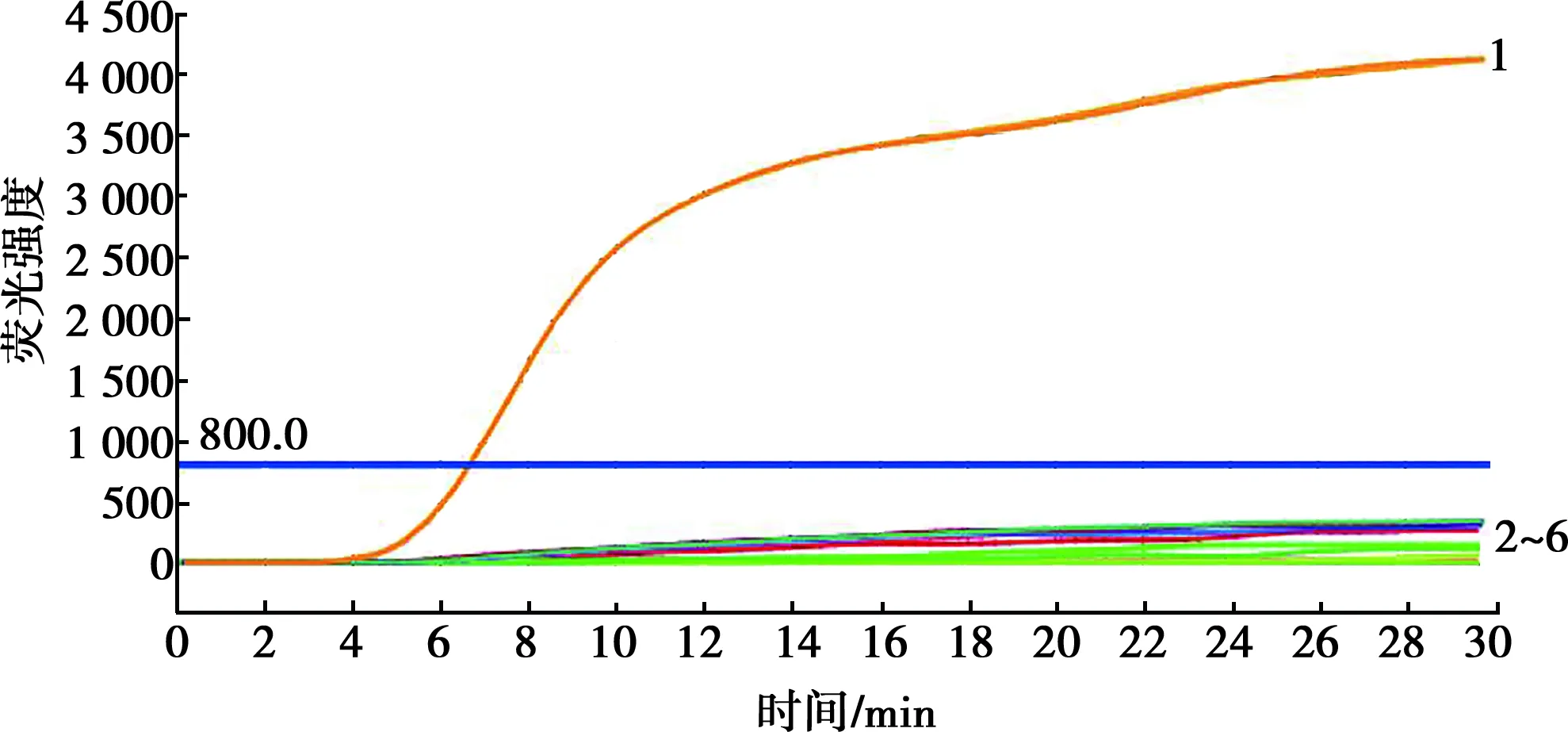
1. ASFV VP72质粒标准物质;2~6. 分别为CSFV、PEDV、TGEV、PCV2、PRV培养物
A. 标准物质浓度2.5 copies/μL;B. 标准物质浓度5×101 copies/μL
表2 ASFV微流控芯片与荧光定量PCR重复性测试结果
表3 ASFV微流控芯片检测重复性的CV值
2.4 临床样本检测分析
如表4所示,微流控芯片法与荧光定量PCR法对43份临床样品的检测阳性率分别为检测结果符合率为97.67%(42/43),不符合的1份样本为环境拭子样品,荧光定量PCR法检测为阴性,而微流控芯片法为阳性。
表4 微流控芯片与荧光定量PCR对临床样本的检测
3 讨论
荧光定量PCR是目前生产实践中用于检测ASFV最常见的一类方法。与常规PCR相比,具有快速、敏感的特点,最低检出限可达几个到几十个病毒拷贝。尽管如此,荧光定量PCR反应需在不同的温度区循环,对仪器要求高;微量加样步骤多,对操作专业要求高;出结果时间较久;且成本也相对高昂。环介导等温扩增(LAMP)方法由日本学者Notomi等[6]发明,是一种核酸恒温扩增技术,只需水浴锅或恒温箱等简单设备即能开展实验,并通过在反应体系中加入特殊物质使得反应结果肉眼可见,具有灵敏度高、操作简单、反应时间短、临床使用不需要特殊仪器等优点,特别适合在现场和基层部门应用。从目前国内学者建立的ASFV的LAMP检测方法来看,该方法具有较高的核酸检测敏感性以及良好的特异性[7-8]。ASFV微流控芯片检测是在已有的LAMP扩增基础上结合Exo-NAT技术的一种新的恒温扩増技术,扩增时间仅需要30 min,同时敏感性提高了3~4倍,近年来得到许多研究者的青睐[9]。
本次试验运用微流控芯片法和荧光定量PCR法对ASFV标准物质、临床样本和其他病毒培养物样本进行检测,结果表明微流控芯片检测方法的敏感性、重复性和特异性等性能不低于荧光定量PCR方法,符合对ASFV诊断的要求。在敏感性方法,ASFV微流控芯片法可实现2.5 copies/μL的最低检出限;在特异性方面,该方法对CSFV、PEDV、TGEV、PCV2和PRV等5种病毒培养物均未出现交叉反应;同时,该方法具有良好的检测重复性;运用该方法与荧光定量PCR法对临床样本进行检测,检测结果符合率为97.67%,不符合的一份样本检测结果荧光定量PCR法为阴性,而微流控芯片法为阳性,提示微流控芯片法可能具有更高的检出率。此外,由于ASFV微流控芯片法检测时间短,不需要温度循环,检测仪便于携带和运输等特点,特别适合于现场快速检测和基层部门应用。
本次试验仅对ASFV微流控芯片快速检测试剂盒及ASFV荧光定量PCR检测试剂盒的某一批号做了简要比较分析,如有条件,需扩大样本量,进一步验证ASFV微流控芯片快速检测试剂盒的各项性能,为政府监管部门、食品生产企业、畜牧水产养殖企业的相关病原体检测及监控提供有力工具。同时,随着微流控和基因芯片等新技术开始不断应用于动物疫病检测领域,未来ASFV病原学检测将更加快速、准确及自动化,必会进一步为ASF防控提供有效支持。
