miR-215-5p通过靶向NCOA3基因抑制固始鸡腹部前脂肪细胞的增殖和分化
2021-07-08靳文姣翟彬苑鹏涛范升鑫李远方闫峰宾孙桂荣田亚东康相涛李国喜
靳文姣,翟彬,苑鹏涛,范升鑫,李远方,闫峰宾,孙桂荣,田亚东,康相涛,李国喜
(河南农业大学动物科技学院/河南省家禽种质资源创新工程研究中心,河南 郑州 450046)
家禽生产中,腹部脂肪组织的特征与鸡的经济性状高度相关[1]。腹腔内脂肪过度沉积常常对肉质性能产生负面影响,并增加饲料成本[2-4]。近年来,随着规模化养殖的发展,地方鸡种腹脂过度沉积现象也越来越严重[5]。地方鸡种是我国家禽育种和优质鸡生产的重要素材,因此,理解地方鸡腹部脂肪组织发育的分子机制,将有益于资源的保护和开发利用。固始鸡是主要分布于河南省固始县境内的蛋肉兼用型地方品种,因其肉质具有鲜嫩、可口和风味独特的优良特征,而经常被用作育种和生产的素材。但目前仍然缺乏对固始鸡腹部脂肪组织发育分子机制的理解。
MicroRNA (miRNA)是一类长度18~24 nt的内源性小的非编码RNA,可与特定mRNA的3′-UTR区结合,在转录后水平上调控基因的表达[6],广泛参与机体发育、代谢以及细胞增殖、分化、凋亡等生物学过程的调控[7-8]。脂肪组织发育涉及新脂肪细胞的增加(增生)和脂肪细胞中脂类蓄积的增加(肥大)等复杂的过程[9],许多研究显示miRNA也参与脂肪细胞增殖、分化和脂类代谢等脂肪组织发育相关的许多生物学过程调控。例如,bat-miR-33b[10]、miR-21[11]、miR-204[12]、 miR-378[13]、miR-125a-5p[14]、miR-200b[15]等miRNA已被证实可参与脂肪细胞增殖或分化调控。这说明,miRNA可作为研究动物脂肪组织发育相关分子机制的新靶标。但目前的一些研究还仅局限于少数农业动物。
有关鸡腹脂发育相关miRNA的研究已有报道[16-20]。例如,Huang等[18]通过深度测序,从93日龄慢长型中国地方鸡北京油鸡(低腹脂)和快长型商业化肉鸡品系科宝鸡(高腹脂)的腹脂中鉴定到了230种已知miRNA和83种潜在的新miRNA。Yao等[19]和Wang等[20]分别从鸡腹脂衍生前脂肪细胞中检测到159种已知miRNA和33种差异miRNA。这些研究表明,鸡腹脂发育受许多miRNA的调控。但先前的研究还主要集中于少数品种和腹脂发育特定阶段miRNA鉴定,而对特定miRNA在鸡腹脂发育中的作用机制研究还很少。
前期,我们完成了6、14、22、30周龄固始鸡腹脂miRNA的高通量测序,筛选鉴定到507种已知miRNA和53种新的miRNA,发现miR-215-5p在固始鸡腹脂4个发育阶段间高丰度差异性表达[21]。NCOA3基因可与核激素受体互作,与脂类代谢和沉积密切相关[22]。Wang等[23]研究显示,NCOA3基因的表达量随着肌内脂肪含量的增加而升高,表明NCOA3基因对脂肪沉积可能存在正向调控作用。靶基因预测表明,在NCOA3基因3′-UTR上,存在miR-215-5p的结合位点。这表明,miR-215-5p可能通过靶向作用于NCOA3而调控固始鸡腹脂发育。基于此,本文研究了miR-215-5p对固始鸡腹部前体脂肪细胞增殖和分化的影响及其与NCOA3基因的靶向关系,所得结果为更好地理解固始鸡腹部脂肪组织发育的分子机制提供新的见解。
1 材料与方法
1.1 试验动物与样品采集
选择14周龄健康固始鸡6只,解剖后,取心脏、肝脏、脾脏、胰腺、腿肌、皮脂、肾脏、腹脂等组织,液氮速冻后保存于-80 ℃冰箱待用,用于miR-215-5p组织表达谱分析。另外,选择14日龄固始鸡雏鸡,解剖分离腹部脂肪组织,用于原代前体脂肪细胞分离培养。
1.2 原代前脂肪细胞分离培养
取14日龄固始鸡雏鸡,无菌条件下处死后于75%酒精中浸泡10 min,解剖分离腹部脂肪组织,用含0.8%链霉素/青霉素的PBS连续冲洗3次后剪碎。将剪碎后的组织块置于含1 mg/mL胶原蛋白酶Ⅱ(9001-12-1,索莱宝)的DMEM(SH30023.01,HyClone)中,37 ℃消化1 h。消化完全后加入红细胞裂解液,室温下裂解10 min,随后分别通过100目、200目和500目的筛网过滤,1 000 r/min 的转速离心滤液5 min。用完全培养基(DMEM+10% 胎牛血清(04-001-1ACS,BI)+1%双抗(P1400,索莱宝)重悬细胞后,铺于培养瓶中,在37 ℃、5% CO2培养箱中培养。前脂肪细胞的诱导分化,于6孔板中进行,当细胞达到90%融合时,用含160 mol/L油酸的完全培养基进行诱导分化,每隔1 d更换1次培养基,分别在诱导后0、2、4、6、8 d收集细胞样品。
1.3 细胞转染试验
采用lipofactamine 2000试剂(11668019,invitrogen),按照试剂盒操作说明,将浓度为50 nmol/L 的miR-215-5p mimics(5′-AUGACCUAUGAAUUGACAGCA-3′,5′-CUGUCAAUUCAUAGGUCAUUU-3′)和mimics NC(5′-UUCUCCGAACGUGUCACGUTT-3′,5′-ACGUGACACGUUCGGAGAATT-3′)以及浓度为100 nmol/L的miR-215-5p 抑制剂(5′-GUCUGUCAAUUCAUAGGUCAU-3′)和抑制剂对照 (5′-CAGUACUUUUGUGUAGUACAA-3′)(锐博生物)分别转染到前体脂肪细胞中。试验在12孔板或96孔板中进行,当细胞融合达到60% ~ 70%(增殖试验)或70% ~ 80%(分化试验)时,完成转染;转染后6 h更换为完全培养基,48 h后收集细胞样品。
1.4 实时荧光定量RCR(qRT-PCR)分析
分别采用Primer SeriptTMRT reagent Kit和Mir-XTMmiRNA First-Strand Synthesis试剂盒(R323,R312,诺维赞)对总RNA进行反转录,获得mRNA、miRNA所对应的cDNA。定量PCR分析,在Roche LightCycler®96仪器上进行;mRNA所用引物序列见表1,由尚亚生物技术有限公司合成;miR-215-5p和U6的反转录和定量引物购自锐博生物有限公司,RT-PCR反应程序为 :95 ℃预变性 5 min;95 ℃变性 12 s,60 ℃退火 40 s,72 ℃延伸 30 s,共40个循环。所有试验均重复3次。分别以U6、β-actin作为miRNA和mRNA定量的内参基因,采用2-ΔΔCt法计算miRNA或mRNA相对表达量。

表1 qRT-PCR分析所用引物
1.5 CCK-8和EdU分析
通过CCK-8 (MA0218,美仑生物) 和EdU(C10310-1,锐博生物)分析,评价miR-215-5p对前脂肪细胞增殖的影响。当接种细胞生长至60% ~ 70%融合时,将miR-215-5p mimics和mimics NC以及miR-215-5p inhibitors和inhibitors NC转染细胞。对于CCK-8分析,按照试剂盒操作说明在96孔板上进行,分别于转染后12、24、36、48 h,向每孔细胞各加入10 μL CCK-8试剂,置于37 ℃孵育2 h,用酶标仪(波长450 nm处)检测细胞活力。对于EdU分析,在6孔板上进行,转染后 36 h,用25 μmol/L浓度的EdU溶液孵育细胞4 h,染色后使用荧光倒置显微镜拍照。上述试验各处理均设置6个重复。
1.6 油红O染色和甘油三酯含量分析
将前体脂肪细胞接种于12孔板内,待细胞70%~80%融合,转染miR-215-5p mimics和mimics NC以及miR-215-5p inhibitors和inhibitors NC,并于转染24 h后更换含160 mol/L油酸(112-80-1,索莱宝)的诱导培养基,诱导分化后24 h,进行油红O染色和甘油三酯含量分析,以评价脂肪细胞充脂情况。对于油红O染色,用4%多聚甲醛溶液固定处理细胞30 min后,加油红O染液,室温孵育20 min,弃掉染液用PBS清洗细胞3次,荧光倒置显微镜下拍照。然后,向每孔染色后的细胞中加入500 μL异丙醇,10 min后用酶标仪在500 nm波长处测量OD值。另外,采用组织细胞甘油三酯(TG)酶法试剂盒 (E1013-105,普利莱) 检测脂肪细胞内甘油三酯含量,细胞裂解后,按照试剂盒操作对裂解后的细胞进行处理,用酶标仪检测蛋白含量(595 nm处)和甘油三酯含量(550 nm处)。上述试验各处理均设置3个重复。
1.7 载体构建和双荧光素酶活性分析
使用正向引物5′-CCGCTCGAGGTGCTGTACAAAAAAGGTCATATTTTTGGC-3′ 和反向引物5′-ATAAGAATGCGGCCGCGGTATTTCAGGGCTGGCTCTAC-3′扩增包含miR-215-5p结合位点的NCOA3-3′-UTR序列(NCOA3-3′-UTR-WT);使用突变引物(F:5′-CCGCTCGAGGTGCTGTACAAAAAGTTCAGTATTTTTGGC-3′, R:5′-ATAAGAATGCGGCCGCGGTATTT-CAGGGCTGGCTCTAC-3′)扩增包含突变miR-215-5p结合位点的NCOA3-3′-UTR序列(NCOA3-3′-UTR-Mut), 片段长度均为130 bp。2个片段扩增成功后,进行胶回收,用XhoⅠ、NotⅠ限制性内切酶进行双酶切并分别与T载体连接;随后再利用XhoⅠ、NotⅠ限制性内切酶,对NCOA3-3′-UTR-WT、NCOA3-3′-UTR-Mut和 psiCHECK2空载体进行双酶切,并将酶切产物连接psiCHECK2载体。最后,对成功连接psiCHECK2载体的菌液进行大量摇菌,提取重组质粒,分别命名为WT-NCOA3和MUT-NCOA3。
荧光素酶活性分析,在鸡成纤维细胞系(DF1细胞)上完成,细胞于37 ℃、5% CO2培养箱中进行培养。在24孔板内,当细胞生长至70%融合时,利用lipofactamine 2000试剂,将miR-215-5p mimics与WT-NCOA3或MUT-NCOA3分别共转染DF1细胞。转染后48 h,按照Dual-Luciferase报告基因检测系统试剂盒 (Promega) 操作说明,对细胞进行裂解并检测双荧光素酶活性。
1.8 统计分析
所有数据均采用“平均值±标准误”表示,使用SPSS 22.0软件进行统计分析。P值的计算采用非配对t检验,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 鸡miR-215-5p的表达谱特征
采用qRT-PCR分析了miR-215-5p在固始鸡14周龄8种组织中以及腹部前体脂肪细胞分化过程中的表达情况。结果显示,miR-215-5p在腹脂中相对表达量最高,其次为肾脏和皮脂(图1A),这表明miR-215-5p可能与鸡腹部脂肪沉积相关。另外,在前脂肪细胞分化的前两天,miR-215-5p表达水平呈递增趋势,至第2天达第一个峰值;从前脂肪细胞分化后第4天,miR-215-5p的表达又逐渐上升,到分化后第8天达到峰值(图1B)。前体脂肪细胞分化前期伴随着细胞增殖,因此miR-215-5p的这种动态表达结果表明,其在鸡前体脂肪细胞增殖和分化过程中可能均发挥作用。
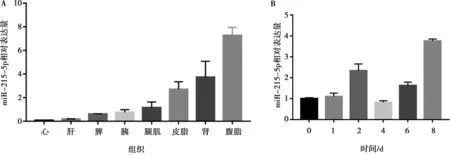
A. 在不同组织中的表达;B. 在腹部前脂肪细胞分化不同时间点的表达
2.2 miR-215-5p抑制鸡腹部前体脂肪细胞增殖
分别将miR-215-5p mimics和mimics NC以及miR-215-5p inhibitors和inhibitors NC转染固始鸡腹部前体脂肪细胞,以评价miR-215-5p对鸡前脂肪细胞增殖的影响。当转染miR-215-5p mimics后,前脂肪细胞中miR-215-5p表达水平提高了350倍(图2A);相反,转染miR-215-5p inhibitors后,前脂肪细胞中miR-215-5p的表达水平下降了50倍(图2B)。实时荧光定量PCR分析显示,转染miR-215-5p mimics的前脂肪细胞中,细胞增殖标志基因(CDK1和PCNA)的表达水平比对照组极显著下降(P<0.01),而细胞周期阻滞因子(p21)的表达水平比对照组极显著升高(P<0.01)(图2C)。相反,在转染miR-215-5p inhibitors的前脂肪细胞中,与对照组相比CDK1和PCNA的表达水平显著上升(P<0.05),p21的表达水平显著下降(P<0.05)(图2D)。EdU分析表明,过表达miR-215-5p可显著降低EdU阳性细胞比例(图3A,3B),而抑制miR-215-5p可显著提高EdU阳性细胞的比例(图4A,4B)。CCK-8检测证实,转染miR-215-5p mimics可显著降低前脂肪细胞总数(图3C),而转染miR-215-5p inhibitors可显著增加前脂肪细胞总数(图4C)。这些结果证明,miR-215-5p可抑制鸡腹部前脂肪细胞的增殖。
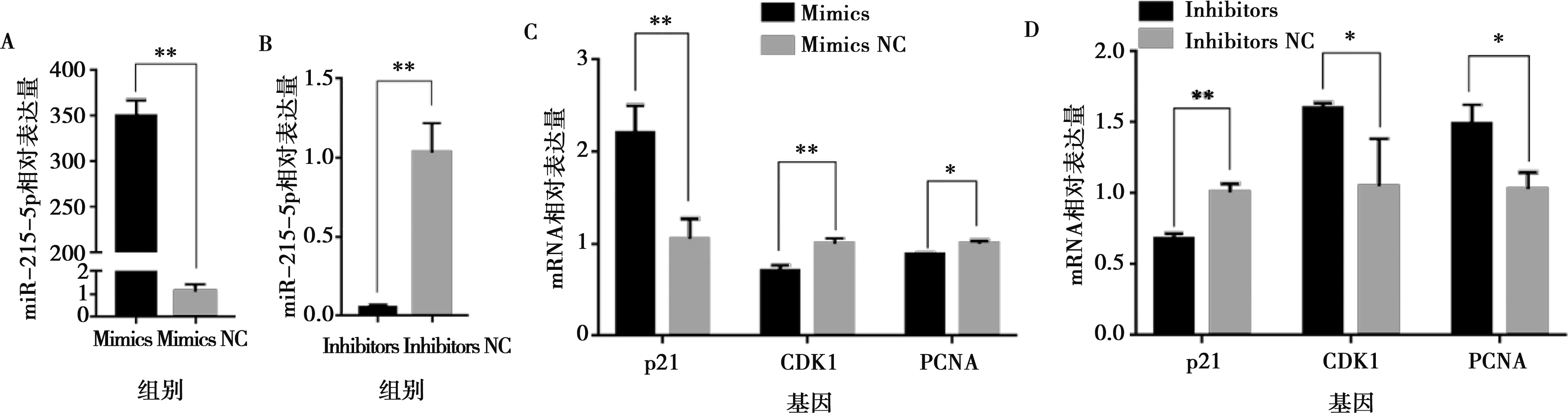
A和B分别为miR-215-5p mimics和inhibitors转染后前脂肪细胞中miR-215-5p的表达量;C和D分别是miR-215-5p mimics和inhibitors转染后前脂肪细胞中增殖标志基因的表达量。*P<0.05,**P<0.01。下同
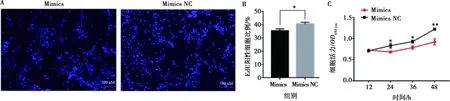
A.EdU检测分析;B. EdU阳性细胞占比统计;C. CCK-8分析

A. EdU检测分析;B. EdU阳性细胞占比统计;C. CCK-8分析
2.3 miR-215-5p抑制鸡腹部前体脂肪细胞分化
将miR-215-5p mimics和mimics NC以及miR-215-5p inhibitors和inhibitors NC分别转染固始鸡腹部前脂肪细胞并进行诱导分化,以评价miR-215-5p对鸡前脂肪细胞分化的影响。结果显示,与对照组相比,转染miR-215-5p mimics可显著抑制脂肪细胞分化标志基因PPARG、CEBPA、FABP4和LPL的表达(图5A),而miR-215-5p inhibitors处理则得到了相反的结果(图5B)。相应地,过表达miR-215-5p显著减少了分化脂肪细胞中脂滴的数量,降低了脂质积累(图6);抑制miR-215-5p表达则显著增加了分化脂肪细胞中脂滴的数量,促进了脂质积累(图7)。同样,转染miR-215-5p mimics的脂肪细胞中甘油三酯含量极显著降低(P<0.01),而转染miR-215-5p inhibitors的脂肪细胞中甘油三酯含量则显著升高 (P<0.05)(图8)。这些结果表明,miR-215-5p可抑制鸡腹部前体脂肪细胞的分化。
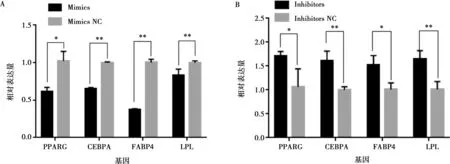
图5 过表达(A)/抑制(B)miR-215-5p对脂肪细胞分化标志基因相对表达量的影响
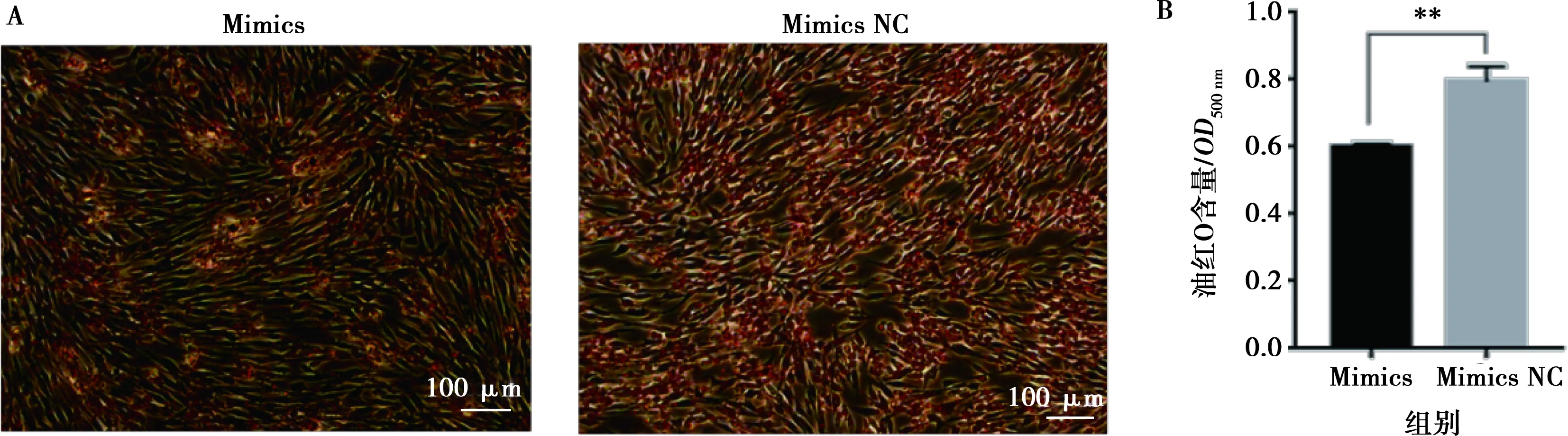
A.油红O染色;B.油红O含量分析(500 nm波长处读取的OD值)
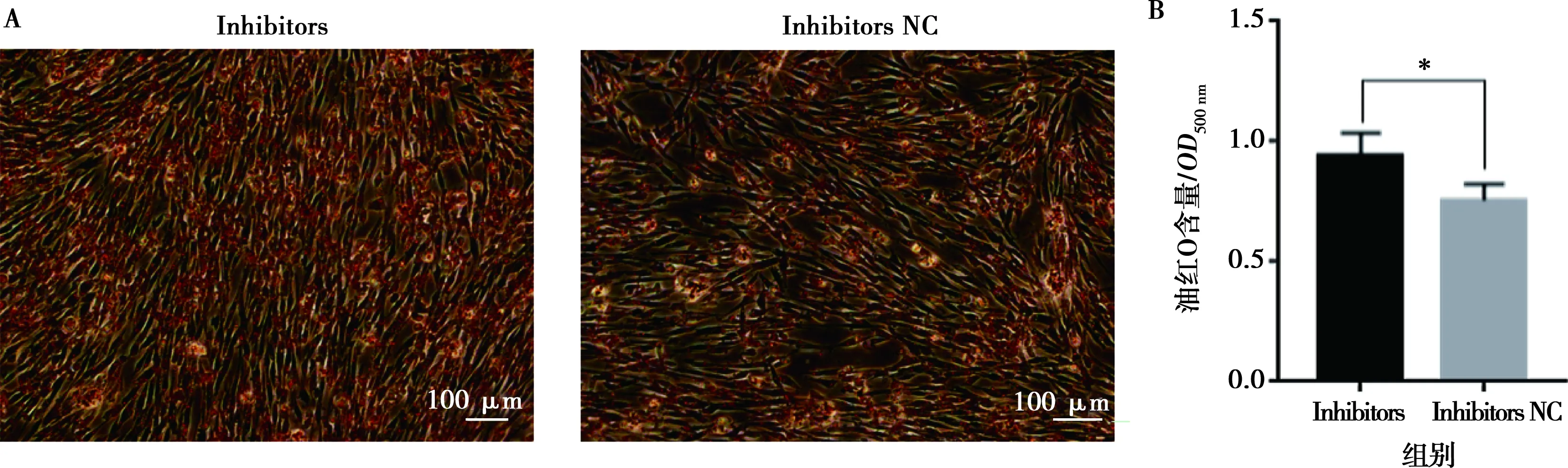
A.油红O染色;B.油红O含量分析(500 nm波长处读取的OD值)
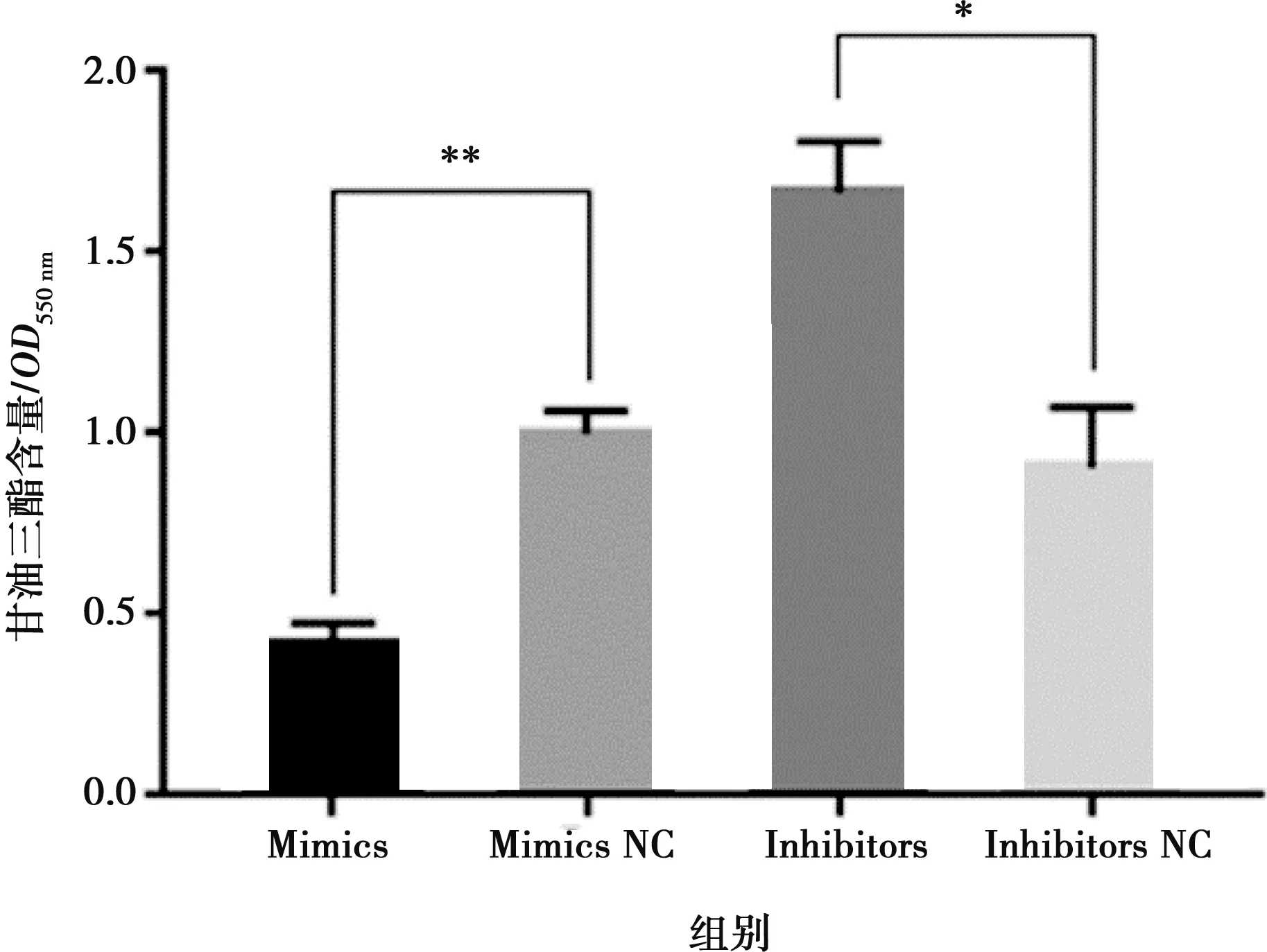
图8 过表达/抑制miR-215-5p后脂肪细胞内甘油三酯
2.4 miR-215-5p可直接靶作用于NCOA3基因
为揭示miR-215-5p在鸡腹部前脂肪细胞增殖和分化中的作用机制,利用TargetScan在线软件预测发现,鸡NCOA3基因3′-UTR存在miR-215-5p种子区序列的结合位点(图9A)。在细胞中过表达miR-215-5p时,可显著抑制NCOA3基因的表达(P<0.01);相反,抑制miR-215-5p表达时可显著促进 NCOA3基因的表达(P<0.05)(图9B)。这表明,在鸡腹部前体脂肪细胞增殖和分化过程中,miR-215-5p和NCOA3基因可能存在潜在的靶向互作关系。基于此,在DF1细胞上,通过双荧光素酶报告系统试验,验证了miR-215-5p和NCOA3的直接靶向关系。结果显示,将miR-215-5p mimics和野生型或突变型psiCHECK2-NCOA3-3′UTR载体共转染DF1细胞48 h后,miR-215-5p可显著抑制野生型载体荧光素酶活性(P<0.01),而miR-215-5p与突变型载体共转染则可解除该抑制效果(图9C)。结果表明,miR-215-5p可直接靶作用于NCOA3基因。
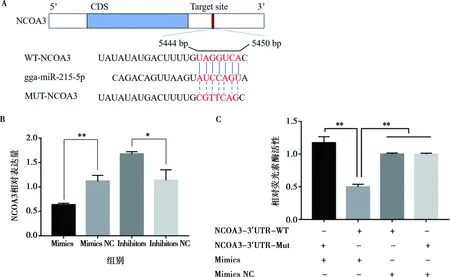
A.miR-215-5p在NCOA3基因mRNA 3′-UTR的结合位点和突变位点序列;B.过表达/干扰miR-215-5p后脂肪细胞中NCOA3的相对表达量;C.双荧光素酶报告试验
3 讨论
miR-215属于mir-192基因家族成员,其在物种间高度保守,对维持物种进化具有重要作用[24]。在人类中,miR-215为基因内miRNA,与其宿主基因一起转录;而miR-215宿主基因异亮氨酰tRNA合成酶2(isoleucyl-tRNA synthetase 2,IARS2)为丙氨酰tRNA合成酶的一种,在蛋白质合成第一步催化氨基酸与同源tRNA的共价结合。研究显示,miR-215和IARS2的表达在Hirschsprung疾病患者中呈正相关[25]。另外,miR-215位于常见的脆弱位点(common fragile site)FRA1H(1q41-q42.1)内,而该位点在许多类型的癌症中缺失[26]。因此,miR-215是人类疾病中被广泛研究的一个miRNA,尤其是在不同类型的癌症中作为致癌基因而受到重视[24]。与此相比,有关鸡miR-215的研究报道还很少。Cai等[27]证实,miR-215-5p在鸡心脏中可靶作用于CTCF,而硒缺乏可通过直接靶向作用于miR-215-5p/CTCF轴影响心肌发育和分化;同时,也证明miR-215-5p可通过直接结合PI3K基因3′UTR,通过调节PI3K/AKT/TOR通路和 ROS-dependent MAPK通路而调控心肌细胞存活,在调控反馈环中发挥自噬调节作用,促进鸡心肌自噬[28]。这表明,miR-215在鸡组织器官发育调控中也发挥重要作用。在本研究中,我们通过qRT-PCR分析了鸡miR-215-5p的表达谱特征,发现miR-215-5p在鸡肾脏组织高表达,这与先前报道的 miR-215在人肾脏正常组织中高度富集的结果相一致[29]。尤其重要的是,在所检测的8种组织中,miR-215-5p在鸡腹部脂肪组织中表达水平最高,进一步的分析显示miR-215-5p在鸡腹部前脂肪细胞分化过程呈现明显的时序表达特征。这表明,miR-215-5p与鸡腹脂发育或脂肪沉积密切相关。
脂肪组织发育是新脂肪细胞增生和脂肪细胞肥大的结果[9],而腹部脂肪块的大小则由该部位脂肪细胞的数量和体积决定的。因此,揭示脂肪细胞增殖和分化机理是阐释鸡腹部脂肪组织发育及相关性状形成分子机制的关键。虽然许多miRNA已被证明可参与动物脂肪细胞增殖和分化调控[10-15],但有关鸡腹脂发育过程特定miRNA功能研究还很少。先前的许多研究已证实,miR-215在细胞和组织发育、细胞凋亡、细胞周期和增殖、细胞迁移和侵袭、细胞微环境和代谢等基本细胞过程中发挥重要调控作用[24]。为此,本研究通过miR-215-5p mimics和mimics NC、miR-215-5p inhibitors和 inhibitors NC转染试验,阐明了miR-215-5p对腹部前脂肪细胞增殖和分化的影响,以解释miR-215-5p在鸡腹部脂肪组织发育的作用。在前脂肪细胞增殖方面,我们发现,miR-215-5p mimics处理可提高p21的表达水平,而显著降低CDK1和PCNA的表达;相反,miR-215-5p innibitors处理显著降低了p21的表达水平,而显著提高了CDK1和PCNA的表达水平。已知CDK是细胞周期的关键调节因子[30],PCNA是DNA聚合酶的一种辅助性因子[31],二者对细胞增殖起着正向调控的作用;而p21可抑制 CDK家族各成员的活动[32],从而阻滞细胞增殖。因此,上述结果表明,miR-215-5p可抑制鸡前体脂肪细胞增殖,尤其是EdU和CCK-8的试验结果也证实了这一结论。已知PPARG、CEBPA和LPL是前脂肪细胞分化早期标志基因[33-34],而FABP4(aP2)则是脂肪细胞分化后期标志基因[35]。当固始鸡腹部前脂肪细胞过表达miR-215-5p时,可显著抑制这些脂肪分化标志基因的表达,同时脂滴蓄积明显减少;而抑制miR-215-5p则获得了相反结果。这些结果表明,miR-215-5p可抑制鸡腹部前体脂肪细胞分化,这与先前在3T3-L1细胞上的研究结果相一致[36]。总之,miR-215-5p是鸡腹部前脂肪细胞增殖和分化的负调控因子,其通过抑制前脂肪细胞的增殖和分化而影响鸡腹部脂肪组织的发育。
miRNA通过与其靶基因mRNA的3′-UTR结合而在转录后水平调控基因的表达。因此,靶基因鉴定是揭示miRNA作用机制的关键。许多研究证明,一些miRNA可直接靶作用于脂肪形成相关基因而影响脂类代谢或沉积,如miR-155可直接靶作用于脂肪形成的关键转录因子C/EBPβ[37],miR-200b-3p在3T3-L1细胞中过表达可降低PPARγ的表达水平[38]。已知NCOA3基因可参与脂类和脂蛋白代谢(metabolism of lipids and lipoproteins)、脂类代谢的PPARα调控(regulation of lipid metabolism by pero-xisome proliferator activated receptor alpha)、白色脂肪细胞的转录调控(transcriptional regulation of white adipocyte differentiation)等与脂类代谢相关的通路调控。先前的一些研究也证实,NCOA3在调节小鼠脂肪蓄积中发挥关键作用[39-40];并且,敲除NCOA3基因后,小鼠模型的脂肪沉积显著减少[41-42];此外,NCOA3能与PPARγ相结合,减少PPARγ-S114磷酸化,促进PPARγ的转录活性,从而促进脂肪沉积[43]。在猪前脂肪细胞分化过程中,NCOA3可被miR-17-5p靶向作用[22]。这些研究表明,NCOA3是脂类代谢或沉积的一个重要的正向调控因子。本研究通过过表达试验和荧光素酶报告基因系统也证明,在鸡腹部前脂肪细胞分化过程中,NCOA3是miR-215-5p的一个直接靶基因。因此,miR-215-5p可通过靶作用于NCOA3而负调控鸡腹部脂肪形成。
生物体内,一个miRNA能够调控许多靶基因。在不同生物学背景中,miR-215的许多靶基因已经被确定。例如,在3T3-L1细胞中,miR-215-5p通过靶作用于III型纤维连接蛋白结构域3B(fibronectin type Ⅲ domain containing 3B,FNDC3B)和连环蛋白beta互作蛋白1(catenin, beta interactingprotein 1,CTNNBIP1)而负调控3T3-L1细胞早期脂肪形成[36]。在胃癌中,miR-215可直接靶作用于转录因子RUNX1(runt-related transcription factor 1)[44],而RUNX1在所有造血部位表达,有助于造血干细胞和祖细胞的形成[45]。然而,miR-215-5p在鸡这些基因上都没有结合位点。事实上,miRNA与基因mRNA的靶向互作关系因组织、细胞类型和生理状态而不同[46]。因此,我们推测,在鸡腹部前脂肪细胞增殖、分化过程中,miR-215-5p可能还存在许多未知的靶基因,它们形成一个复杂的调控网络,共同参与鸡腹脂沉积调控,下一步将聚焦于鸡腹脂形成相关靶基因的鉴定和互作调控机制研究。
