手工克隆生产猪胚胎关键技术的改进研究
2021-07-08陶瑞鑫贾超武恩在李娟
陶瑞鑫,贾超,武恩在,李娟*
(1.南京农业大学动物科技学院,江苏 南京 210095;2.淮安市南农大新农村发展研究有限公司,江苏 淮安 223005)
体细胞核移植技术(somatic cell nuclear transfer, SCNT)是生产克隆动物的一项核心技术。该技术将已分化的体细胞与去核卵母细胞胞质进行融合,经过一系列改变,供体染色质组织特异性的基因修饰信息将被擦除,并接受卵母细胞胞质内的信息表现出一种新的转录模式[1]。所得重构胚胎在体外完成激活和早期发育后移植入受体母畜子宫内,繁殖出具有相同基因型后代。早在2000年,科学家利用成年猪体细胞成功获得第一例SCNT克隆仔猪[2]。同样使用猪耳皮肤细胞作为供核体细胞,通过SCNT培育出莱芜猪克隆后代,为地方猪保种及育种提供了新途径[3]。近期为了应对非洲猪瘟疫情对地方猪遗传资源的威胁,利用SCNT已成功获得纯种青峪猪仔猪[4]。SCNT还可与CRSPR/Cas9技术结合,获得基因编辑克隆猪[5]。因此,SCNT技术在猪的种质资源保护、异种移植及疾病动物模型等领域具有较好的科学意义和应用前景。
虽然利用SCNT技术相继获得了羊、猪、猴等哺乳动物克隆后代[6-8],但受多种因素的影响,猪的克隆效率依旧相对较低[9]。影响克隆胚胎发育效率的因素较多,包括SCNT的技术方法、卵母细胞、供核细胞的质量等。其中,作为受体细胞质的去核卵母细胞则是影响重构胚胎发育能力的一个重要因素,因为卵母细胞细胞质中储存着大量mRNA、蛋白质、营养物质及发育相关因子等支持重构胚胎早期发育的主要物质[10-11]。另外,去核卵母细胞胞质为体细胞恢复多能性及重构胚胎的重编程提供了微环境[12],重构胚胎顺利完成重编程后才能获得正常发育的能力,一旦胚胎重编程失败或者重编程不完全均会阻碍克隆胚胎的发育[13-14]。研究报道,由于不完全去核导致的重组胚胎染色体的非整倍性或多倍体性,可直接导致早期克隆胚胎发育失败[15-16]。因此,如何高效去除卵母细胞的细胞核,并减少卵母细胞胞质的损失,从而获得较高质量的受体胞质与供核细胞完全融合,生产重构猪克隆胚胎,都是SCNT技术中的关键环节。虽然在不同物种中,已探索出几种常用的去核方法,包括借助显微操作仪的盲吸法、挤压法、点压法、Spindle-view系统去核法,以及使用切割刀完成去核的半卵法[17-20],但不同去核方法的去核效率及对卵母细胞的损伤均有所不同。另外,猪卵母细胞具有脂滴含量高[21]、胞质颜色较暗这一特性,因此应用Spindle-view系统观察猪卵母细胞内的纺锤体, 从而显示MII期染色体所处位置进行去核比较困难,该方法更多用于小鼠、人的卵母细胞去核[22-23]。
目前,2种SCNT技术被广泛用于生产克隆猪,即传统显微操作核移植技术(traditional cloning, TC)和手工克隆技术(handmade cloning, HMC)。HMC与TC在去核、融合及胚胎培养等操作过程采用的方法不同。HMC一定程度降低了操作难度和生产成本[24-25],且已成功利用该技术先后获得鼠、牛、猪等不同物种的克隆后代,并具有相对更高的生产率[26-29]。但值得注意的是,HMC是一种纯手工的技术,操作人员的操作准确性对克隆胚胎的生产效率至关重要[30]。本研究将详细阐述利用HMC生产猪克隆胚胎的核心技术路线和操作方法,同时对卵母细胞透明带消化时间、卵母细胞去核方法以及重构胚胎体外培养3个关键步骤展开研究,为手工克隆操作人员提供具有参考价值的实用建议,以更好地掌握HMC技术,提高生产克隆胚胎效率和质量。
1 材料与方法
1.1 卵母细胞的采集及体外成熟
从屠宰场采集卵巢,清洗干净后置于含生理盐水的37 ℃保温瓶中4 h内运送到实验室。用10 mL一次性注射器抽取2~6 mm卵泡内的卵泡液,并将卵泡液注入50 mL离心管中,置于38.5 ℃的热台上沉淀15~20 min。用一次性滴管吸弃上层卵泡液,向沉淀中加入适量洗卵液ASP(添加2%胎牛血清(FBS)的缓冲溶液)轻轻吹打混匀,取适量于35 mm培养皿中。在体视显微镜下观察,捡出胞质均匀并带有至少3层卵丘细胞的卵丘卵母细胞复合物(COCs)进行体外成熟培养。取400 μL体外成熟培养液IVM(0.8 mmol/L L-GlutaMAX,10%(V/V)猪卵泡液(PFF),10%(V/V)FBS,15 IU/mL PMSG,15 IU/mL HCG溶于TCM-199)于四孔板中,同时覆盖400 μL无菌石蜡油,每孔放入50~60枚COCs于38.5 ℃、5% CO2以及饱和湿度的培养箱中进行体外成熟培养。
1.2 供体细胞准备
HMC开始前1周解冻猪胎儿成纤维体细胞,于DMEM培养基(添加10% FBS)、37 ℃、5% CO2以及饱和湿度培养。每3~4 d更换1次培养基,直至细胞汇合并铺满整个培养孔。HMC操作开始后,于37 ℃用0.25%胰蛋白酶(Trypsin-EDTA)消化细胞约3 min后加入两倍体积培养基终止消化,并将细胞悬液移入1.5 mL离心管,572g离心3 min,弃上清后加入T2(添加2% FBS的TCM-199)使细胞重新悬浮,置于室温等待融合。
1.3 消化透明带
半卵法切割去核时,需消化卵母细胞透明带(zona pellucida, ZP)。首先使用1.0 mg/mL透明质酸酶(Hya)将体外成熟培养42~44 h的COCs外周卵丘细胞去除,置于操作液滴T2中洗净后挑选出胞质均匀且排出PB1卵母细胞(图1A)。随后将卵母细胞转移至3.3 mg/mL链蛋白酶(Pro)中消化ZP(图1B)。
1.4 卵母细胞切割去核
待卵母细胞透明消化后,迅速将卵母细胞依次放入T2滴、T20滴(添加20% FBS的TCM-199)中各漂洗2次后转移至切割液TPCB(2.5 μg/mL细胞松弛素CB的T2),用自制显微切割刀沿与极体垂直的方向将卵母细胞一分为二(图1C),一半为含PB1和约1/3(不超过1/2)胞质的半卵(图1D),另一半为无极体卵母细胞胞质作为无核半卵受体移入T2滴中待融合。
1.5 体细胞融合与电激活
猪的HMC采用2次电融合方法。第一次融合前,无极体半卵转移至1 mg/mL的植物凝集素(PHA)中平衡2~3 s,随后移入提前预平衡体细胞的T2滴中,以一对一的方式将卵母细胞和体细胞黏连在一起,移入融合液滴F0(含0.3 mol/L甘露醇,1 mg/mL聚乙烯醇)中平衡。在0.06 kV/cm的交流电(AC)下将半卵-体细胞垂直排列于电极间距为0.5 mm融合槽的电极金属丝上(图1E),用0.2 kV/cm,9 μs的直流电电击1次。完成第一次电融合的半卵-体细胞于T2液滴中静置约1 h。挑选体细胞完全融入的半卵,进行第二次电融合。随机取无核半卵与已融合的半卵-体细胞垂直排列于覆盖有F+激活液(含0.3 mol/L甘露醇,1 mg/mL聚乙烯醇,0.1 mmol/L MgSO4,0.05 mmol/L CaCl2)的融合槽的电极金属丝上(图1F),用0.86 kV/cm,80 μs的直流电电击1次完成第二次融合和电激活,半卵-体细胞-半卵移入T2滴中恒温孵育15 min,观察融为一个完整的球型重构胚后(图1G),进行随后的化学激活。
1.6 重构胚胎化学激活与体外培养
将重构胚胎转移至PCC(5 μg/mL细胞松弛素B(CB)和10 μg/mL放线菌酮(CHX)的PZM-3)化学激活液中,置于38.5 ℃、5% CO2以及饱和湿度的培养箱中4 h。完成化学激活后,对无透明带的HMC重构胚,采用微孔技术(well of wells,WOWs)于38.5 ℃、5% CO2、20% O2以及饱和湿度的培养箱内培养5~7 d至发育到桑葚胚或囊胚。
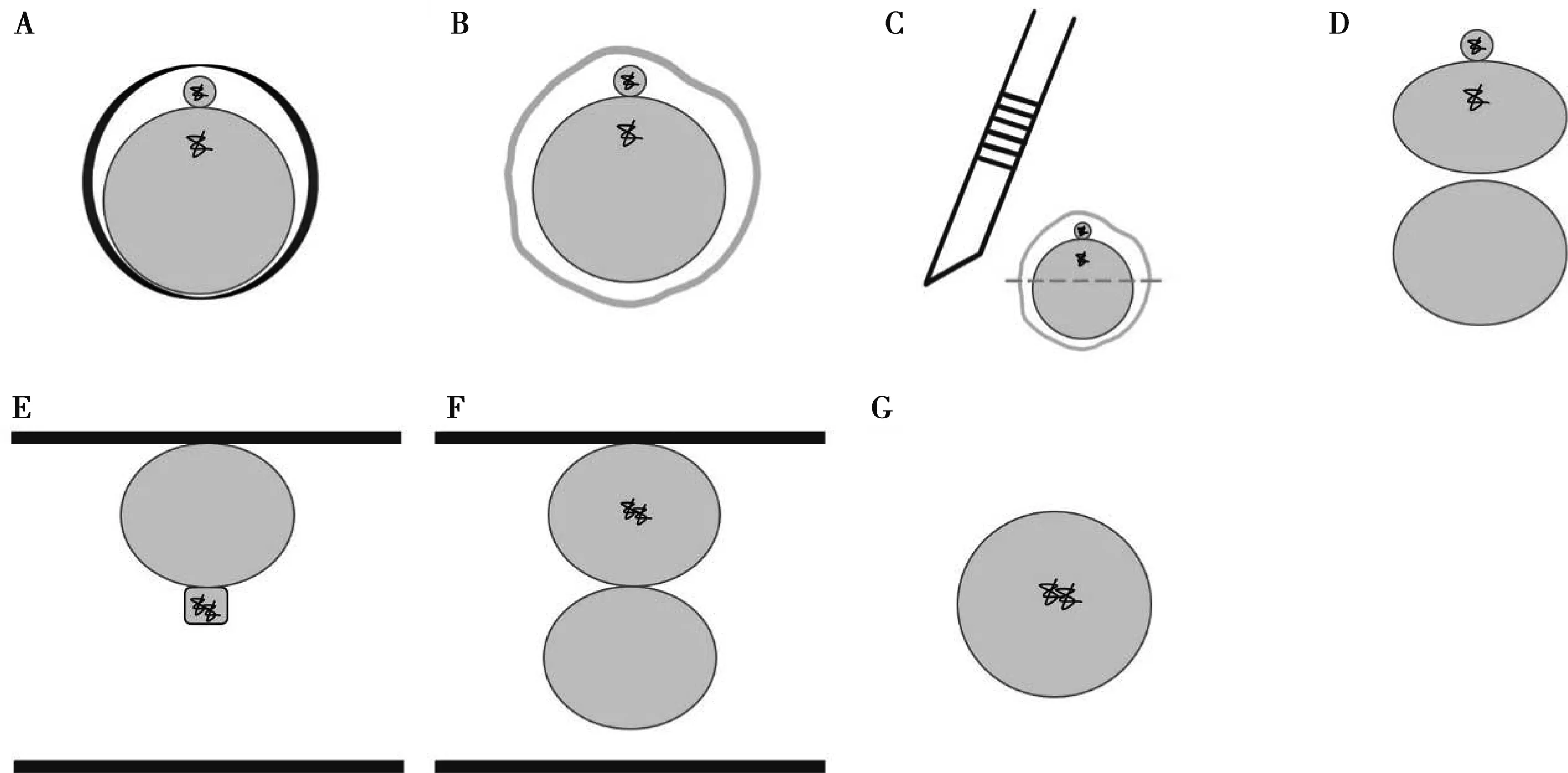
A.含PB1成熟卵母细胞;B. 消化卵母细胞透明带;C. 半卵法切割去核;D. 获得无核半卵; E.第一次电融合;F. 第二次电融合;G. 重构胚胎
2 结果与分析
利用HMC技术生产无透明带双半卵猪克隆胚胎的技术路线主要包括6个步骤(图1):消化卵母细胞透明带、半卵法去核、第一次电融合、第二次电融合同时完成重构胚胎电激活以及重构胚胎化学激活和无透明带HMC克隆胚胎体外培养。其中关键步骤包括:透明带消化程度、手工克隆刀切割去核、WOWs的制作及大小。
2.1 ZP消化时间对切割去核的影响
根据卵母细胞透明带消化时间分为3组,A组:少于10 s、B组:10~15 s以及C组:高于15 s。不同程度消化卵母细胞透明带。观察发现,消化时间少于10 s时,仍然可看到完整的ZP(图2A);当消化时间为10~15 s时,卵母细胞透明带被消化,卵母细胞开始变形(图2B);消化时间高于15 s时,大多数卵母细胞的ZP则被完全消化(图2C),卵母细胞容易黏附在皿底。
将不同消化时间的卵母细胞用于切割去核,统计透明带消化时间与消化程度对卵母细胞去核的影响。A组消化时间不足(少于10 s)会导致切割困难,卵母细胞难以被一分为二(图3A);B组消化时间适度(10~15 s),卵母细胞易于被切割(图3B);而C组消化过度(高于15 s)则会导致卵母细胞死亡不能继续用于去核,或在切割过程中胞质碎裂(图3C)。从表1可知,A组ZP轻度消化时,不能用于切割的卵母细胞比率极显著高于B组和C组(P<0.05),B组和C组无显著差异(P>0.05)。一旦过度消化,C组卵母细胞死亡率显著增加,明显高于A组和B组(P<0.05),A组和B组差异不显著(P>0.05)。因此,消化ZP的时间直接影响卵母细胞质量以及切割成功率。

A.轻度消化,消化时间小于10 s;B. 适度消化,消化时间10~15 s;C. 过度消化,消化时间高于10 s,箭头指示透明带

A.轻度消化,透明带完整,卵母细胞难以被切割 (如箭头所示) ;B. 适度消化,卵母细胞易于被切割;C.过度消化,卵母细胞死亡或胞质破碎(如箭头所示)
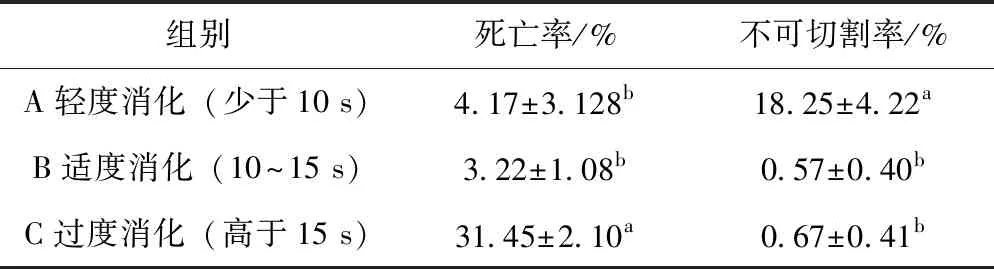
表1 透明带不同消化时间对切割去核效率的影响
2.3 手工克隆刀切割去核
卵母细胞完全去核是HMC能否成功的前提条件。操作人员在进行去核时,一方面要确保完全去核,另一方面需尽可能多的保留胞质来支持重构胚胎的发育。因此,熟练掌握切割刀的使用对保留足够多胞质的同时较减小对胞质的损伤十分重要。正常情况下,包含PB1的1/2或更少的细胞质在去核过程中被去除(图4A)。然而,因不熟练操作时或在ZP消化不当难以切割的情况下,一半或更多的细胞质容易随细胞核一起被切除且PB1位置与切割路径并不垂直,这不利于完全去核(图4B)。如图5所示,切割去核的操作细节如下:首先根据极体的位置将卵母细胞同方向排列,切割刀轻轻地放入切割滴中,将刀尖固定于距离目标卵母细胞左侧2/3刀刃直线位置(图5A),刀刃直线与极体垂直,以铡刀的方式压下刀刃(图5B),把卵母细胞一次切开,直至所有卵母细胞去核完成。而去核完成后,因无核卵母细胞都已无透明带保护,在液滴后续操作或等待融合时,尽可能避免多个半卵紧挨导致胞质黏连难以分开或分开时对胞质造成损伤。
2.4 WOW的制作及大小
由于HMC操作过程中卵母细胞透明带已被消化,在体外培养过程中为防止所得无透明带重构胚胎卵裂球脱落或多个无透明带胚胎黏连,需采用WOWs体外培养。而WOWs的类型及大小对胚胎发育有直接影响。本试验则采用400 μL PZM-3培养液且每孔覆盖400 μL无菌石蜡油的Nunc四孔板,板底垫透明板,借助专用打孔钉于四孔板底部垂直手工压制凹形微孔(图6A),每个微孔1个重构胚胎(图6B)。结果证实四孔板每孔制作25~30个微孔,孔深约为250 μm,孔径约为300 μm,更有利于胚胎发育。
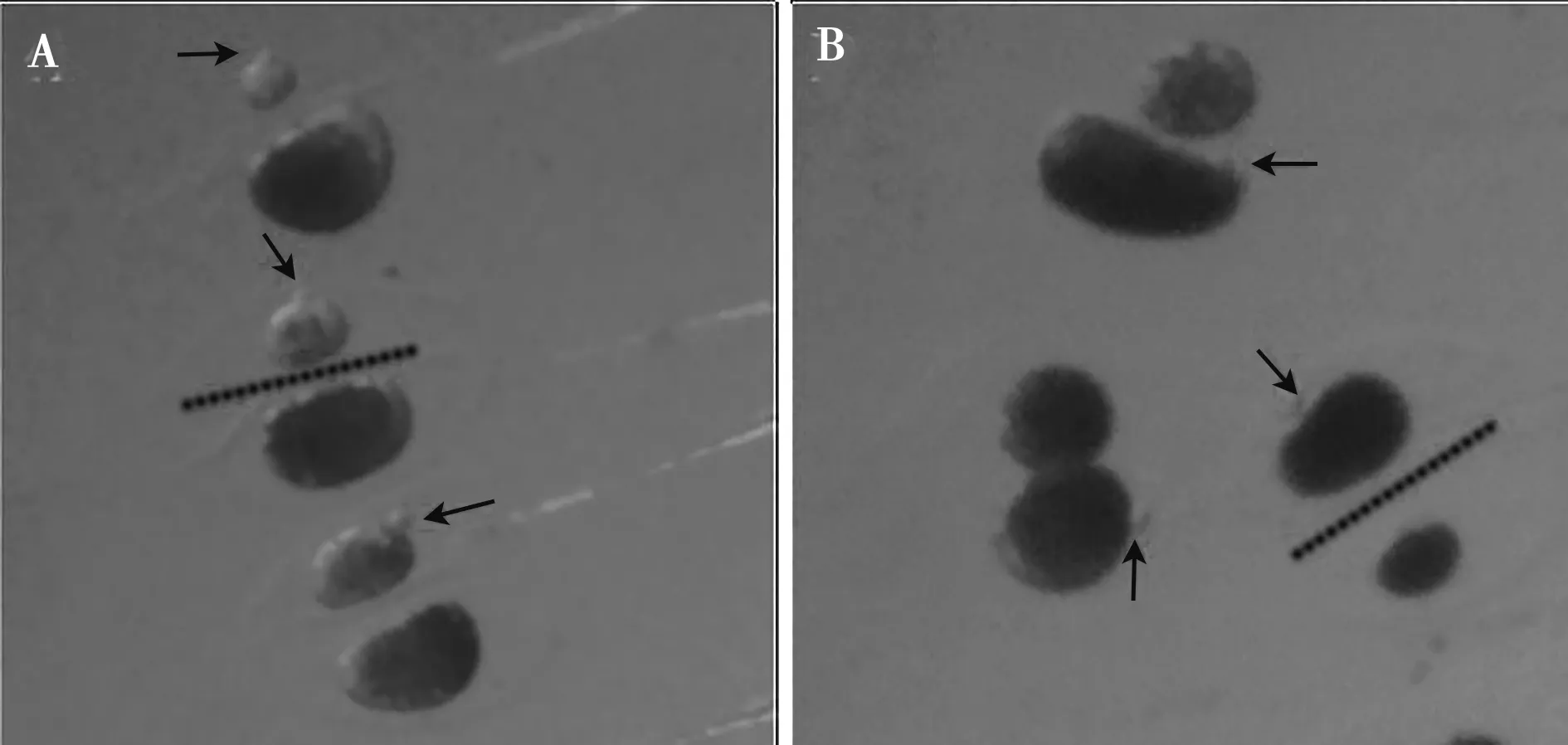
A.少于1/2含极体的胞质被去除;B.多于1/2含极体的胞质被去除。箭头指示PB1,虚线为切割路径

A.切割时,切割刀摆放示意图;B. 切割示意图,切割时以铡刀的方式向下压刀刃。箭头指示PB1;a指示卵母细胞;b点指示刀尖固定点;c点到固定点b的距离约为刀锋长度的2/3;虚线d指示切割路径垂直于极体所在位置且含极体胞质少于1/2处;e指示标准切割路径
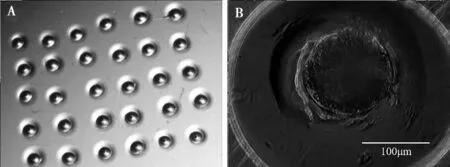
A.四孔板每孔内压制25~30个微孔;B. 每1个微孔内放一个重构胚胎
3 讨论
随着体细胞核移植技术的发展,与克隆技术相关的卵母细胞体外成熟培养、去核方法、体细胞融合技术、重构胚胎激活和培养技术等均得到优化以提高SCNT的成功率[31-34]。目前,多个实验室已成功利用HMC新技术完成体细胞核移植并成功繁育得到具有研究价值的克隆猪后代。但需要特别注意HMC是一项纯手工技术,操作人员在生产重构胚胎时熟练且精确的操作是生产重构胚胎和保障克隆胚胎质量的重要基础要求。因此,优质卵母细胞的挑选、卵母细胞透明带消化时间的掌握、去核方法的选择以及操作熟练度、重构胚胎的体外成熟培养等均是影响克隆效率的潜在因素,必须正确掌握和高效完成。
为了保证重构胚胎的正常发育,卵母细胞去核是最为关键的步骤之一。在去核过程中应尽可能去除细胞核并保留更多的胞质,从而提高体细胞重编程效率和胚胎发育能力。在SCNT技术发展中,新的去核方法不断提出以提高去核效率,但每种去核方法针对不同物种都有其优缺点。使用TC的点压法去核,虽除去PB1时带走的细胞质少,对卵母细胞质损伤也相对较小,一定程度地提高了去核效率,但该方法需昂贵的显微操作仪[35]。早期猪的HMC去核则采用活性荧光染料定位法,根据Hoechest33342对细胞核定位,以确定无核半卵。该方法虽可保证细胞核去除完全,但操作繁琐、耗时长,且染料对细胞质有一定损伤[36]。本研究HMC去核所采用半卵法,通过极体定向手工去核(oriented handmade enucleation, OHE)[37]。成熟卵母细胞内细胞核靠近极体排出的位置,根据第一极体的位置将卵母细胞切割为两部分,便于全部切除细胞核[38],从而获得无核半卵(远离极体的半卵)。该方法不需依靠昂贵的显微操作仪与化学试剂辅助,也不需荧光显微镜,整个去核过程操作简便,仅需一把切割刀便可完成,并且利用该方法去核所生产重构胚胎后续发育能力高于化学辅助手工去核法[37]。但该方法在去核时会带走相对较多的胞质,为弥补丢失的胞质,随后可通过双半卵融合技术使受体细胞质体积恢复到去核前的水平,足够的胞质能够提高重构胚胎发育[39]。另外,切割时,熟练掌握切割刀的使用方法对保留足够多胞质的同时减小对胞质的损伤十分重要。需要注意切割时刀片对无透明带保护的卵母细胞胞质具有直接的外力作用,需熟练掌握切割刀的使用方法,避免因操作不当对细胞造成不可逆的机械性损伤。
传统克隆胚胎是带有透明带的,而HCM操作时消化卵母细胞透明带是实施手工切割去核的前提条件。研究表明,去除透明带的胚胎仍然可在体外继续发育[40]。目前,不同物种卵母细胞透明带消化所采用的方法不同,主要使用酸性台式液消化小鼠卵母细胞透明带,大多数实验室采用链酶蛋白酶法消化猪卵母细胞透明带,但所使用的处理浓度和时间有所不同[3, 41]。本研究使用3.3 mg/mL链蛋白酶对体外成熟培养42~44 h的猪卵母细胞消化10~15 s为最适宜处理时间,卵母细胞不会发生过度变形而无法恢复球形也不影响卵母细胞质量和切割去核。在透明带得到适度消化的情况下,卵母细胞才更容易被切割,一旦透明带被完全去除会造成细胞死亡或在切割过程中胞质破碎。因此,在进行透明带消化时,需要特别注意根据链蛋白酶使用浓度确定适宜的消化时间。另外,因为去核前透明带已被消化,最终所得重构胚胎为无透明带胚胎。不同于有透明带保护的猪胚胎体外发育常采用的培养板法(四孔板中直接加入400 μL PZM-3培养液覆盖石蜡油进行培养),无透明带胚胎更多采用Vajta等[42-43]提出的微穴培养系统,一方面能够有效防止多个无透明带胚胎之间发生胞质黏连,另一方面一定程度防止胚胎的卵裂球脱落,该方法能够很好的保护无透明带胚胎并完成早期胚胎发育。
哺乳动物克隆技术缺陷以及效率不理想给体细胞核移植技术的发展带来障碍。未来进一步优化核移植各项技术操作方法、工具和参数,以及更加深入研究供体体细胞、受体卵母细胞胞质对重构胚胎发育能力的影响机制等,相信克隆效率将得到提高,并能够高效率高质量生产具有繁殖育种意义、生物医学研究价值的克隆动物。
4 结论
本文详细介绍了利用HMC生产猪重构胚胎的步骤并对操作过程中的3个关键环节进行了优化。首先,成熟卵母细胞透明带在3.3 mg/mL的链蛋白酶中消化的最适宜时间大约为10~15 s,该消化条件既能保证透明带已被软化利于切割,又能防止过度消化造成卵母细胞损伤或死亡。其次,掌握“铡刀式”切割方法沿与极体排出位置垂直的方向完成切割有利于去核完全且减小切割刀对卵母细胞的机械外力损伤。最后,使用四孔板制作孔深约为250 μm,孔径约为300 μm的微孔更有利于重构胚胎稳定发育。
