骨发育相关基因表达水平与鹿茸重量的相关性分析
2021-07-08赵佩王洪亮王磊邢秀梅胡鹏飞
赵佩,王洪亮,王磊,邢秀梅,胡鹏飞
(中国农业科学院特产研究所特种经济动物分子生物重点试验室,吉林 长春 130112)
鹿茸是自然界唯一能够周期性完全再生的哺乳动物骨质附属器官。除驯鹿雌、雄均生茸之外,只有雄鹿生茸,因此,鹿茸为鹿科动物的第二性征[1]。鹿茸是一种可以周期性再生的骨质器官,其成骨方式与典型的软骨内成骨类似,但又有所不同。鹿茸软骨是非常独特的软骨组织,它不仅在自然条件下能够修复,而且每年以一种惊人的速度生长(可达2 cm/d)[2]。鹿茸生长顶端从远端到基部分为真皮组织、间充质组织、前成软骨组织、过渡组织和软骨组织[3]。鹿茸生长的本质就是在软骨骨架上的成骨过程,因此,鹿茸的生长与骨发育相关基因的表达密切相关。
MMP14是基质金属蛋白酶(MMPs)家族中的成员。MMPs是指一系列在生理情况下可降解细胞外基质及基底膜的锌离子依赖性内肽酶的家族总称[4]。MMPs可分为胶原酶、明胶酶、基质酶、膜型基质金属蛋白酶(MT-MMP)和其他5种亚型, MMP14属于MT-MMP[5]。有研究表明MMPs在软骨生长及成熟中发挥着重要的作用,MMPs通过对ECM降解和重塑,促进血管间充质浸润,保证了软骨内成骨的有序演进,同时某些MMPs在骨的发育中还发挥着将胶原前体转变为成熟胶原的作用[6-7]。MMPs尤其MMP14作为软骨骨化的重要影响因子,受到了很大关注。Ⅰ型胶原α2基因(COL1A2)是编码I型胶原蛋白的主要基因[8]。Ⅰ型胶原是骨基质中含量最多的蛋白,占骨基质有机物的80%~90%,构成骨组织的蛋白框架,是钙盐沉着以及细胞附着的支架,其合成分泌是骨组织形成的先决条件,是成骨细胞分化最早的标志[9]。COL11A1基因编码Ⅺ型胶原α1链,Ⅺ型胶原蛋白是是软骨特异性细胞外基质蛋白,在细胞外基质中起重要的作用,Ⅺ型胶原参与其他软骨特异性胶原(Ⅱ型和Ⅸ胶原)的纤维形成,并参与调节软骨胶原纤维的直径[10]。SPARC(secreted protein, acidic and rich in cysteine),又称作骨连接蛋白(osteonecfin)、基底膜40 蛋白(BM40),是一种富含半胱氨酸(Cys)的酸性分泌蛋白,最早是从骨中分离出来的[11]。研究表明 SPARC 是一种成骨相关蛋白,与钙离子有高度亲和力,可以使得骨基质进一步钙化,对于骨组织维持和重建是必需的[12]。PHOSPHO1(phospho ethanol amine/磷酸胆碱磷酸酶) 是磷酸脱氢酶家族的成员,参与无机磷酸盐的生成,最初是从鸡肥大生长板软骨细胞中克隆出来的,在骨矿化中起到核心作用,PHOSPHO1通过其底物磷胆碱(PCHO)和磷乙醇胺(PEA)的水解释放无机磷(PI),用于骨骼矿化[13]。RHOA蛋白是一种23 kDa 的单体小G蛋白,由193个氨基酸组成,具有N端与C端2个结构域[14-15],属于小G蛋白超家族的亚家族成员,为GTP家族中重要成员,是GTP酶之一,参与细胞有丝分裂、细胞骨架调节等多种生物体内的生理过程[16]。CTNNB1基因全长23.2 kb,有16个外显子,编码β-catenin蛋白,其编码的β-catenin蛋白含781个氨基酸[17-18]。Wnt/β-catenin信号通路被称为Wnt信号通路的经典途径[19],在调控骨的形成与改建过程中发挥了重要作用,调控骨组织中包括成骨细胞、软骨细胞及破骨细胞的分化、增殖,控制间充质细胞凝聚、软骨内骨化作用启动等过程的调控[20-22]。
目前国内外关于鹿茸生长的调节研究很多,鹿茸的快速生长受到一系列相关分子的严格调控,在鹿茸生长发育过程,胰岛素样生长因子-1(IGF-1),甲状旁腺素相关肽(PTHrp)、视黄酸(RA)、成纤维细胞生长因子(FGF)、表皮生长因子(EGF)、转化生长因子(TGF)、神经生长因子(NGF)和骨形成蛋白(BMP)等起重要的调节作用。但目前关于鹿茸中与骨发育相关基因表达的研究鲜有报道。因此,本试验用荧光定量PCR方法检测不同重量鹿茸中与骨发育相关基因的表达情况,为鹿茸生长发育相关基因研究提供参考。
1 材料与方法
1.1 试验动物及采样
试验所需梅花鹿鹿茸为二杠茸,均采自中国农业科学院特产研究所中心鹿场,依据同一锯别、相同生长天数、鹿茸重量不同,分为低重量和高重量两组,每组3个。参照 Li等[23]对赤鹿生长顶端的分层方法,分别切取前软骨层和软骨层组织,液氮研磨为细粉,迅速转移至液氮中冻存。
1.2 主要试剂及仪器
RNA Extraction Kit、PrimeScriptTM1st strand cDNA Synthesis Kit、SYBR®PremixExTaqTMKit均购自TaKaRa公司。 LightCycler®480荧光定量PCR仪。
1.3 总RNA的提取
按照TRIzol试剂的说明提取组织总RNA,使用Nanodrop2000微量分光光度计测定RNA样品的OD值(260 nm吸光度值与280 nm吸光度值之比,反映核酸的纯度)和浓度(ng/μL),用1.5%的琼脂糖凝胶电泳,利用凝胶成像系统检测RNA的完整性。
1.4 cDNA合成
反转录体系20 μL:RNA模板1 μL,OligodT1 μL,RNase Free ddH2O 11 μL,65 ℃加热10 min后立即置于冰上冷却,冰浴后离心数秒,向反应管中继续添加以下试剂:5×RT Buffer 4 μL, Inhibitor 0.5 μL, 10 × dNTP Mixture 2 μL,反转录酶0.5 μL,在反应管中将试剂小心混匀并轻度离心;反转录PCR反应程序:55 ℃ 30 min,85 ℃ 5 min,置于冰上终止反应。全程操作在冰上进行。将反转录产物,用持家基因GAPDH进行PCR检测。将符合标准的cDNA产物于-20 ℃保存,以用于检测目的基因的表达。
1.5 引物设计与合成
以管家基因GAPDH为内参[24],用Primer Premier 5引物设计软件设计引物,引物序列见表1。引物由上海生物工程股份有限公司合成。将引物用灭菌超纯水溶解,稀释为10 μmol/L,-20 ℃保存。

表1 荧光定量RT-PCR 目的基因引物的相关信息
1.6 实时荧光定量PCR扩增
分别扩增MMP14、COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC、CTNNB1基因,检测引物特异性。PCR反应体系:总体积25 μL,其中cDNA模板1 μL,10×Buffer 2.5 μL,dNTP 2.5 μL,0.5 U/μLTaqDNA聚合酶,上、下游引物各0.5 μL,灭菌去离子H2O 17.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸5 min;4 ℃保存。采用SYBR Green I荧光染料法对组织中MMP14、COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC、CTNNB1基因mRNA进行相对定量分析,PCR反应体系:cDNA模板2 μL,FastStar Essential DNA Green Master 10 μL, 上、下游引物各1 μL,RNase Free ddH2O 6 μL。PCR反应程序:95 ℃预变性10 min;95 ℃ 变性10 s, 60 ℃退火10 s,72 ℃延伸20 s;循环40次后进行溶解曲线分析:95 ℃ 10 s,65 ℃ 60 s,然后以每10 s上升1 ℃的速率从65 ℃升高到95 ℃。每个样品重复3次。采用2-ΔΔCt方法进行相对定量分析,计算目的基因与看家基因的相对表达量。
1.7 生物信息学分析
利用STRING软件对骨发育相关基因表达互作进行分析,同时应用Cytoscape软件制作骨发育相关基因参与生物学过程模式图。
1.8 统计分析
采用独立样本t检验对不同重量鹿茸尖端组织骨发育相关基因表达进行显著性检验,采用Pearson相关法分析骨发育相关基因表达水平与鹿茸重量之间的相关性,所有数据用SPSS 13.0软件进行统计分析。
2 结果与分析
2.1 不同组别鹿茸重量比较
不同组别鹿茸重量比较结果发现,低重量组和高重量组鹿茸重量分别为(1.49±0.12)kg和(3.32±0.21)kg,存在极显著差异(P<0.01)。
2.2 提取的样品总RNA检测
提取出的样品总RNA在质量分数1%琼脂糖凝胶上的电泳结果见图1。

1~3. 高产组个体;4~6. 低产组个体
由图1可以看到28S、18S RNA条带明亮,且2条带的亮度比值接近2∶1,表明所提取的总RNA完整性较好,浓度和纯度可以满足后续试验要求。
2.3 普通PCR扩增结果分析
以逆转录后的cDNA为模板,通过普通PCR扩增目的基因和内参基因片段,2%琼脂糖凝胶电泳检测。结果见图2,GAPDH、MMP14、COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC和CTNNB1基因的PCR产物电泳条带显示,引物扩增目的条带单一,大小与预期结果一致,说明引物设计合理,同时cDNA未受到基因组DNA的污染,可以作为后续试验模板使用。

M. DL500 Marker;1.GAPDH;2.MMP14;3.COL11A1;4.PHOSPHO1;5.RHOA;6.COL1A2;7.SPARC;8.CTNNB1
2.4 不同鹿茸重量组尖端组织生长发育相关基因表达量比较
通过实时荧光定量PCR技术对MMP14、COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC、CTNNB1基因进行了表达量的测定,结果如图3。高重量组MMP14、COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC和CTNNB1基因的mRNA相对表达量都显著高于低重量组(P<0.01或P<0.05)。
2.5 骨发育相关基因表达量与鹿茸重量的相关分析
骨发育基因表达水平与鹿茸重量的相关系数研究结果显示,MMP14基因表达水平与鹿茸重量相关系数为0.947,呈极显著正相关(P<0.01);COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC、CTNNB1基因表达水平与鹿茸重量相关系数依次为0.846、0.904、0.849、0.819、0.859、0.902,呈显著正相关(P<0.05)。
2.6 鹿骨发育相关基因生物信息学分析
利用STRING工具查询分析,结果如图4所示,在动物机体中MMP14、COL11A1、RHOA、COL1A2、SPARC、CTNNB1基因之间可能存在相互作用关系。
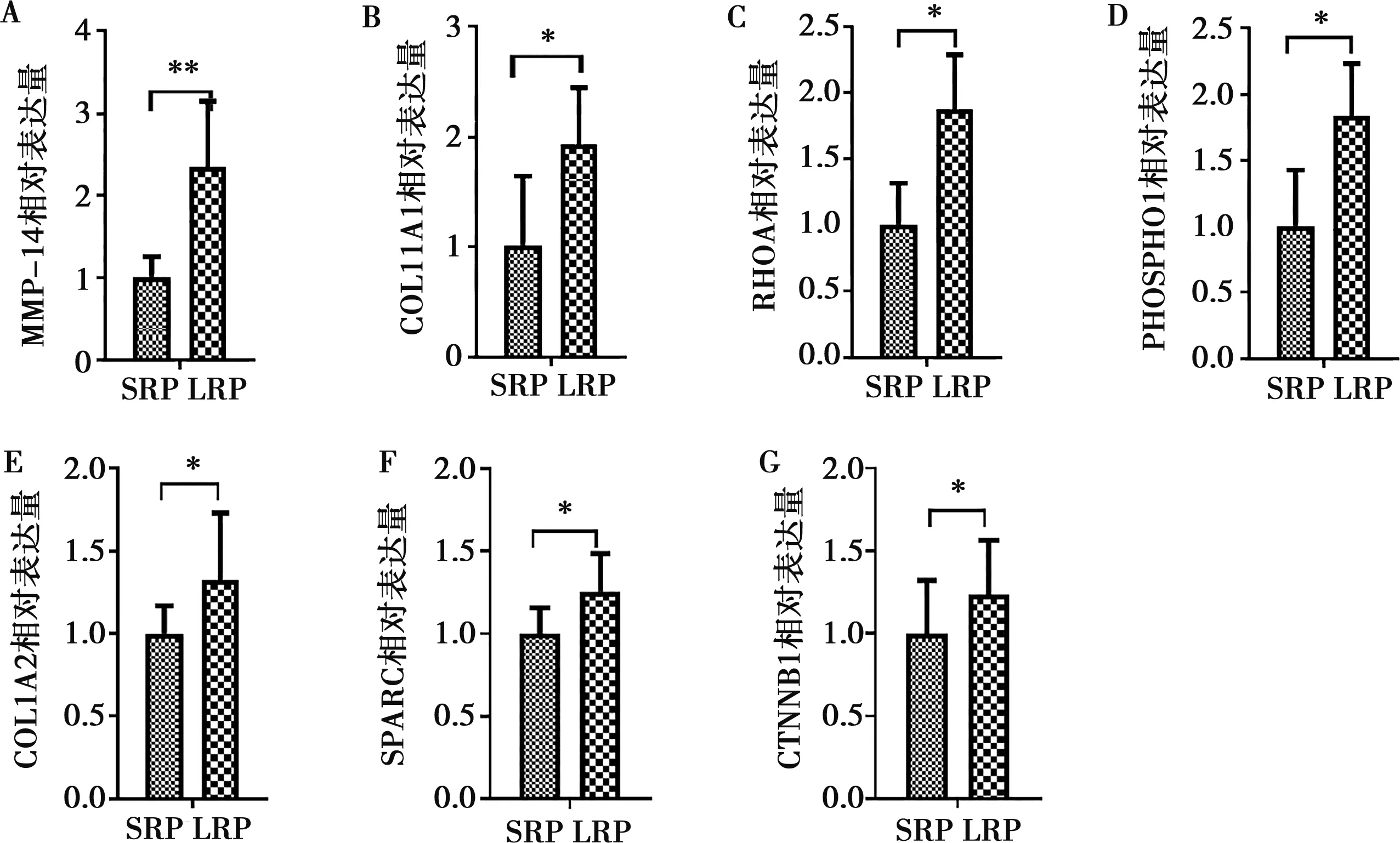
注:SRP表示低重量组的间充质层和前成软骨层;LRP表示高重量组的间充质层和前成软骨层。*P<0.05,**P<0.01A. MMP14;B. COL11A1;C. RHOA;D. PHOSPHO1;E. COL1A2;F. SPARC;G. CTNNB1
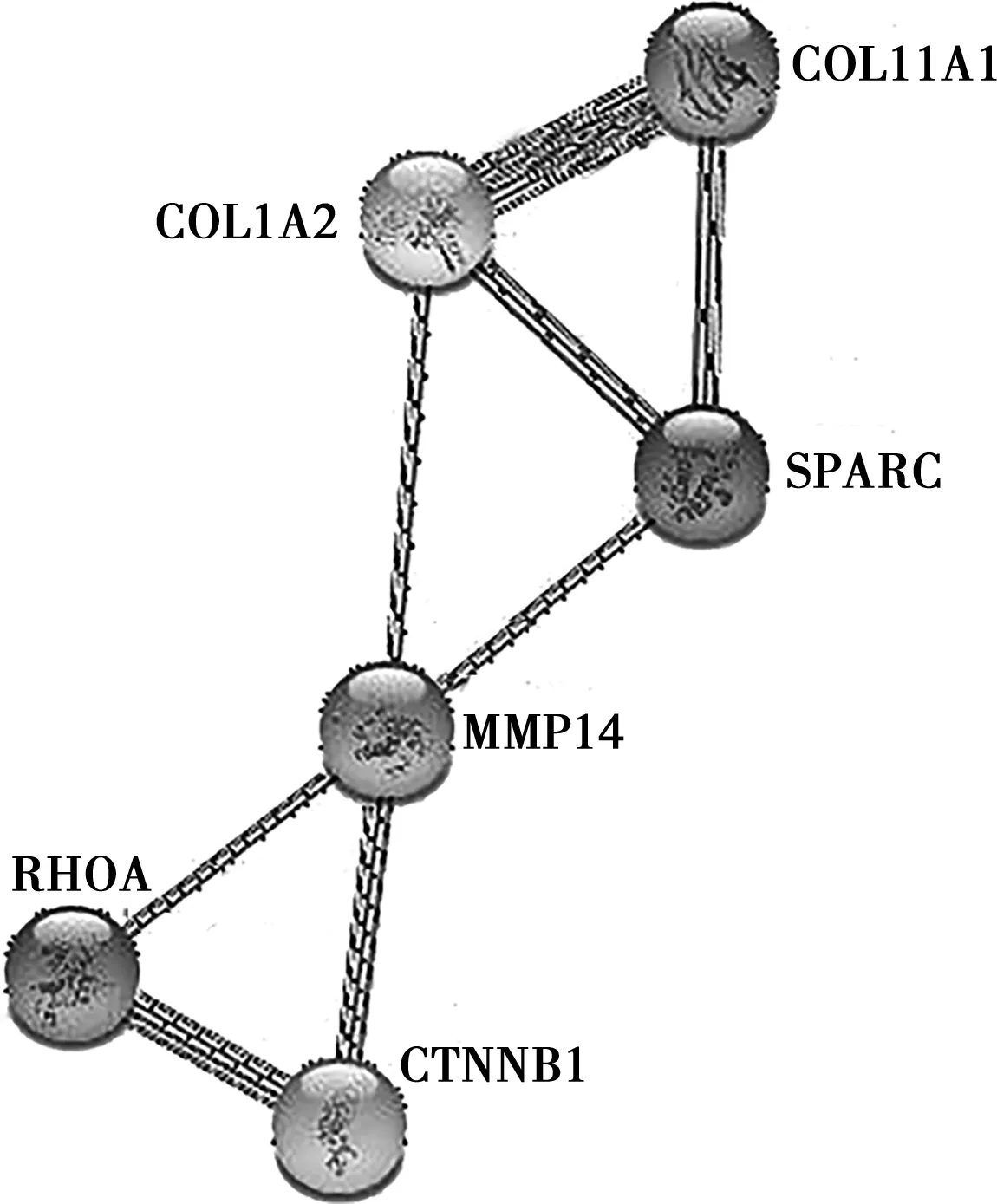
图4 骨发育相关基因表达互作模式
利用生物信息学,初步研究COL11A1、COL1A2、MMP14、SPARC、RHOA、CTNNB1基因主要参与的生物学过程。图5表明:COL11A1主要参与胚胎骨骼发育、组织发育和软骨内骨化等生物学过程;COL1A2主要参与胚胎骨骼发育等生物学过程;MMP14主要参与胚胎骨骼发育、骨骼发育、组织发育和软骨内骨化等生物学过程;SPARC主要参与胚胎骨骼发育、骨骼发育和软骨内骨化等生物学过程等生物学过程;RHOA主要参与胚胎骨骼发育、骨骼发育、组织发育和软骨内骨化等生物学过程。CTNNB1主要参与胚胎骨骼发育。综上,COL11A1、COL1A2、MMP14、SPARC、RHOA和CTNNB1共同参与生物机体的骨骼发育及软骨内骨化。
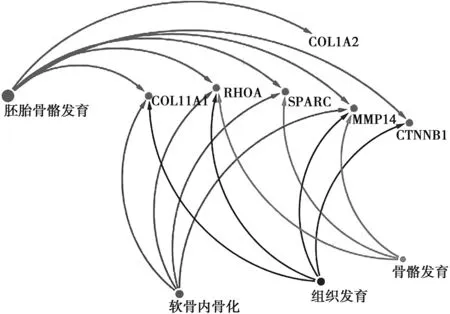
图5 骨发育相关基因参与生物学过程模式图
3 讨论
本试验用实时荧光定量PCR法对不同重量鹿茸尖端组织中与骨发育相关基因的mRNA相对表达量进行分析。李剑[7]研究表明MMP14缺乏,可使成骨细胞无法参与软骨骨化。另有证据表明MMP14缺失的鼠体中次级骨化中心的出现延迟[25]。这些研究表MMP14的低表达可能会造成软骨细胞增殖受限,延迟软骨骨化。本试验对比不同重量鹿茸中MMP14的表达量,发现其表达量与鹿茸重量呈极显著正相关,表明鹿茸中MMP14基因的高表达可能促进软骨细胞成熟骨化,进而有利于鹿茸骨化,增加鹿茸的重量。
研究表明Ⅰ型胶原的表达与骨骼生长发育密切相关。Hikita等[26]研究发现Ⅰ型胶原可以抑制成骨细胞增殖,促进成骨。王艳双等[27]对梅花鹿鹿茸Ⅰ型胶原对大鼠成骨细胞的影响及其分子机制的研究,发现Ⅰ型胶原过表达可以抑制成骨细胞增殖,促进成骨细胞的分化、成熟。有研究表明加速Ⅰ型胶原合成分泌可以起到促进骨组织矿化的作用[28-29]。这些研究表明Ⅰ型胶原高表达可以抑制成骨细胞增殖,促进成骨细胞的成熟分化。本试验对比不同重量鹿茸中COL1A2的表达量,发现在高重量鹿茸中表达量要显著高于低重量组,且表达量与鹿茸重量呈显著正相关,表明鹿茸中COL1A2基因的高表达可能促进成骨细胞的成熟骨化,进而促进鹿茸骨化,增加鹿茸的重量。
Emma等[30]研究报道COL11A1基因 mRNA 的合成和稳定性降低可能会引发骨软骨疾病。Ⅺ型胶原蛋白的低表达会抑制软骨细胞的分化、成熟,造成软骨发育不健全。本试验对比不同重量鹿茸中COL11A1的表达量,发现在高重量鹿茸中表达量要显著高于低重量,且表达量与鹿茸重量呈显著正相关,表明鹿茸中CO11A1基因的高表达可能促进软骨细胞成熟骨化,进而增大生长期鹿茸的重量。
研究表明,RHOA/ROCK 信号通路通过改变细胞骨架,进一步影响成骨分[31]。Takeshita等[32]在鼠的关节炎模型中发现 RHOA/ROCK 信号通路可以改变关节软骨细胞骨架,从而导致关节软骨细胞退变。本试验对比不同重量鹿茸中RHOA的表达量,发现高重量鹿茸中表达量要显著高于低重量,且表达量与鹿茸重量呈显著正相关,表明鹿茸中RHOA基因的高表达可能会改变软骨细胞骨架,利于成骨细胞成熟骨化,增加鹿茸重量。
有证据表明PHOSPHO1特异性表达于骨和软骨的矿化部位,在成骨细胞系中高度表达,其产生矿化基质,有助于骨骼的矿化[13]。Macrae等[33]研究发现非PHOSPHO1小鸡的骨骼矿化受到显著抑制,不利于长骨的形成,说明PHOSPHO1的低表达抑制成骨细胞的成熟、骨化。本试验对比不同重量鹿茸中PHOSPHO1的表达量,发现在高重量鹿茸中表达量要显著高于低重量,且表达量与鹿茸重量呈显著正相关,表明鹿茸中PHOSPHO1基因的高表达可能促进成骨细胞成熟骨化,以促进鹿茸骨化,增加鹿茸的重量。
有研究表明,SPARC会使骨生成增加,脂肪生成减少[34]。Sharma等[35]研究发现非SPARC小鼠成骨能力显著下降主要表现为成骨细胞数目减少,进而骨软化,提示SPARC在维持成骨细胞增殖过程中起重要作用。张然然等[36]研究发现SPARC在鹿茸的快速生长与快速骨化过程中起着重要的作用。这些研究表明SPARC低表达会抑制成骨细胞的增殖,导致成骨作用减弱,进而出现骨软化。本试验对比不同重量鹿茸中SPARC的表达量,发现在高重量鹿茸中表达量要显著高于低重量,且表达量与鹿茸重量呈显著正相关,表明鹿茸中SPARC基因的高表达可能会促进成骨细胞增殖,进而加速鹿茸骨化,增加鹿茸的重量。
WNT信号通路调控着成骨细胞分化并且在已分化的成骨细胞中调控着骨形成。Glass等[37]研究表明,在已分化成骨细胞中稳定表达的beta-catenin信号,引起骨量的增加,而其表达信号的降低导致骨量减少。Mount等[38]对经典的Wnt信号通路在鹿茸生长过程进行研究,β-catenin通过Wnt信号通路在调节鹿角祖原细胞存活及凋亡中发挥重要的调节作用,并且对骨形成具有一定调节作用。这些研究表明高表达的CTNNB1会促进成骨作用。本试验对比不同重量鹿茸中CTNNB1的表达量,发现在高重量鹿茸中表达量要显著高于低重量,且表达量与鹿茸重量呈显著正相关,表明鹿茸中CTNNB1基因的高表达可能会促进成骨细胞分化,加强鹿茸成骨作用,增加鹿茸的重量。
4 结论
本研究通过比较高低重量组鹿茸尖端骨发育相关基因的表达,发现MMP14、COL11A1、PHOSPHO1、RHOA、COL1A2、SPARC、CTNNB1基因的表达存在显著差异,且骨发育相关基因表达与鹿茸重量呈显著正相关。据此推测,骨发育相关基因的高表达可能会促进软骨细胞分化、成熟,加速鹿茸骨化,以形成结实的密质骨,从而使鹿茸角重量增加。
