谷胱甘肽硫转移酶mu1基因启动子区异常甲基化与卵巢子宫内膜异位症的关系研究
2021-07-08王礼贤李琰康山
王礼贤,李琰,康山
子宫内膜异位症(endometriosis,EMT)是一种常见的妇科疾病,育龄期女性中10%~15%患有此病,且其发病率呈逐年上升趋势[1]。尽管多种学说和理论阐述了EMT的病因,但其确切机制仍不明确。近年来,许多证据表明与正常内膜相比,EMT患者的在位内膜和异位内膜中存在许多差异甲基化基因,例如:HOXA10、E-钙黏蛋白和白介素12b等,可能在EMT的发展中发挥着重要作用[2-4]。
笔者在前期研究中采用高通量DNA甲基化芯片(Illumina Human Methylation 450K BeadChips)技术分析卵巢EMT患者的在位、异位内膜和对照女性子宫内膜的全基因组甲基化水平,筛选出包含谷胱甘肽硫转移酶mu1(GSTM1)基因在内的多个差异甲基化基因[5]。GSTM1是一种重要的Ⅱ相代谢酶,具有较强的解毒作用;此外,其mRNA高表达可负向调节丝裂原激活蛋白激酶(MAPK)信号通路,具有抑制细胞凋亡的作用[6]。本研究试图分析卵巢EMT患者的在位内膜和异位内膜以及对照女性的子宫内膜中GSTM1基因启动子区的甲基化水平、mRNA表达水平以及二者的相关性,以探讨其异常甲基化与卵巢EMT发生和发展的关系。
1 资料与方法
1.1 一般资料 选取2013年9月—2015年12月于河北医科大学第四医院妇科行腹腔镜手术治疗并经病理检查证实为卵巢EMT的患者65例(病例组),年龄26~45岁,平均年龄(35.7±6.4)岁,取其在位内膜及异位内膜(巧囊壁);另选取同期在该院因宫颈上皮内瘤变(CIN)Ⅲ级行全子宫切除术的患者53例(对照组),年龄28~51岁,平均年龄(37.6±7.6)岁,取其子宫内膜为对照内膜,术后经病理检查证实为正常的内膜组织。所有入选者既往月经规律,近3个月内未接受过激素治疗,所取内膜组织为分泌期内膜,且排除子宫内膜单纯性或复杂性增生、息肉等子宫内膜病变。本研究经河北医科大学第四医院伦理委员会批准,研究对象均知情同意。
1.2 标本采集 术中无菌采集卵巢EMT患者的在位内膜和异位内膜以及对照妇女的子宫内膜,放入RNAlater溶液(Carlsbad,美国)中,-20 ℃保存。
1.3 DNA提取和焦磷酸测序技术 采用DNA提取试剂盒(TIANGEN,北京)提取在位内膜、异位内膜和对照内膜中DNA,并采用NanoDrop 1000分光光度计(Thermo Fisher Scientific,美国)检测提取DNA的浓度。按要求分装DNA,送至北京昂立信生物科技有限公司进行焦磷酸测序。PCR引物由PyroMark Assay Design 2.0设计及合成,在GSTM1基因启动子区选择两个片段,片段一包含-116、-111、-104、-98 CpG位点;片段二包含-40、-23、-16 CpG位点,详见图1和表1。具体反应体系及反应条件参照焦磷酸测序PCR说明书逐步完成。
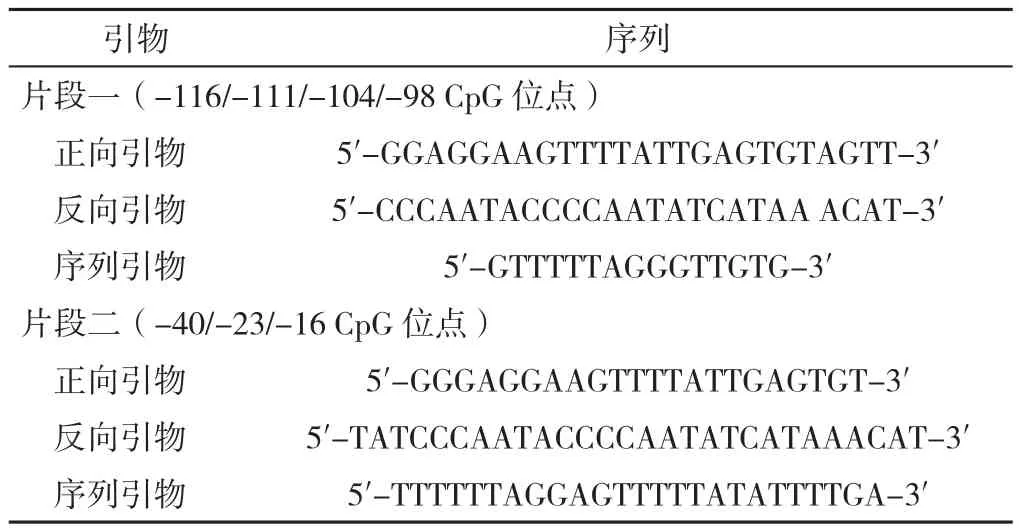
表1 焦磷酸测序的引物序列Table 1 Primer sequences used for pyrosequencing
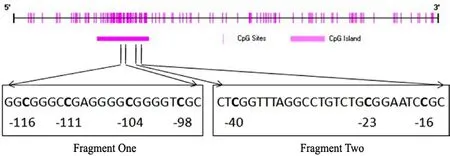
图1 GSTM1基因启动子区中的片段一和片段二Figure 1 The first and second fragments in the GSTM1 promoter region
1.4 RNA提取和实时荧光定量聚合酶链式反应(RT-qPCR) 采用Trizol试剂盒(Invitrogen,美国)提取在位内膜、异位内膜和对照内膜中RNA。cDNA合成采用PCR反转录试剂盒(Thermo,美国)。具体反应体系及反应条件参照RT-qPCR说明书。引物序列详见表2。
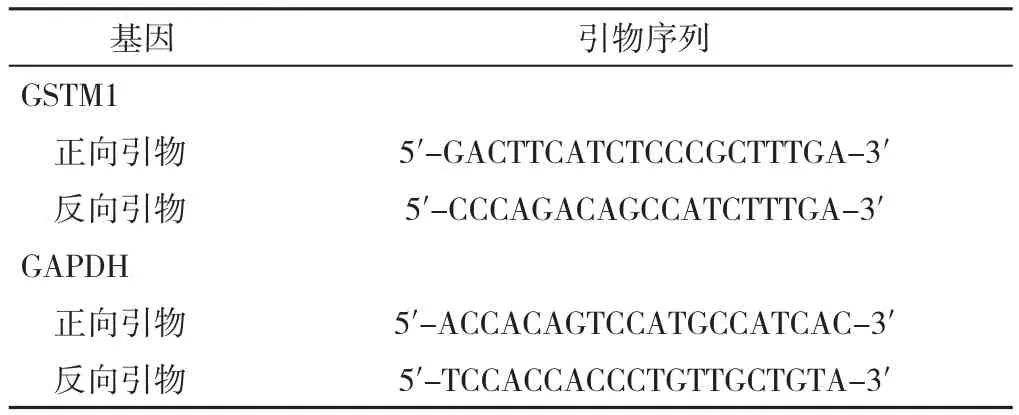
表2 RT-qPCR的引物序列Table 2 Primer sequences used for RT-qPCR
1.5 统计学方法 采用SPSS 21.0软件进行统计学分析,符合正态分布的计量资料以(±s)表示,组间比较采用成组t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis H检验;相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般资料比较 对照组和病例组年龄、初潮年龄、月经周期、胎产次比较,差异均无统计学意义(P>0.05),见表3。
表3 对照组与病例组一般资料比较(±s)Table 3 Comparison of the general information of the case group and control group
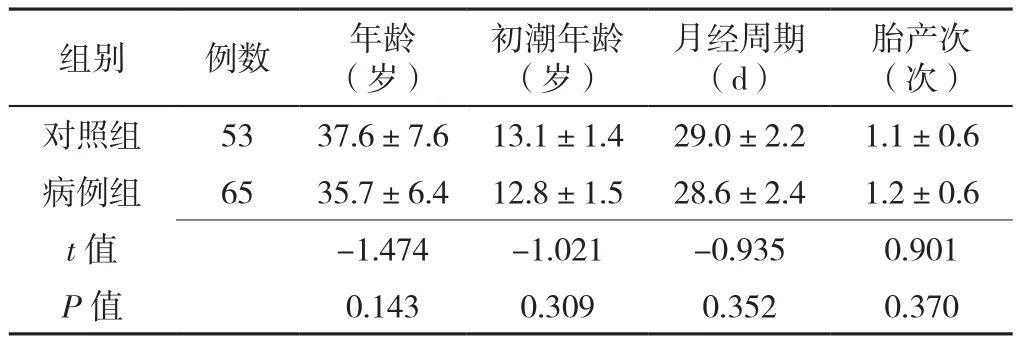
表3 对照组与病例组一般资料比较(±s)Table 3 Comparison of the general information of the case group and control group
胎产次(次)对照组 53 37.6±7.6 13.1±1.4 29.0±2.2 1.1±0.6病例组 65 35.7±6.4 12.8±1.5 28.6±2.4 1.2±0.6 t值 -1.474 -1.021 -0.935 0.901 P值 0.143 0.309 0.352 0.370组别 例数 年龄(岁)初潮年龄(岁)月经周期(d)
2.2 三组内膜GSTM1基因启动子区片段一平均甲基化水平比较
2.2.1 三组内膜GSTM1基因启动子区片段一(-116、-111、-104、-98 CpG位点)平均甲基化水平比较对照内膜、在位内膜和异位内膜片段一平均甲基化水平分别为8.90(5.61,13.07)、6.91(3.75,11.04)、4.21(2.96,6.01)。三组内膜片段一平均甲基化水平比较,差异有统计学意义(H=39.325,P<0.001);其中在位内膜和异位内膜片段一平均甲基化水平低于对照内膜(H=2.588,P=0.046;H=6.496,P<0.001),异位内膜片段一平均甲基化水平低于在位内膜(H=4.213,P<0.001),见图2A。
2.2.2 三组内膜GSTM1基因启动子区片段二(-40、-23、-16 CpG位点)平均甲基化水平比较 对照内膜、在位内膜和异位内膜片段二(-40、-23、-16 CpG位点)平均甲基化水平分别为11.69(8.21,15.09)、11.38(7.75,14.36)、8.21(4.15,13.42)。三组内膜片段二平均甲基化水平比较,差异有统计学意义(H=11.233,P=0.004);其中异位内膜片段二平均甲基化水平低于在位内膜和对照内膜(H=7.693,P<0.001;H=8.257,P<0.001),在位内膜与对照内膜片段二平均甲基化水平比较,差异无统计学意义(H=0.682,P=0.504),见图2B。
2.3 三组内膜GSTM1 mRNA表达水平比较 对照内膜、在位内膜和异位内膜mRNA表达水平分别为0.002(0.001,0.006)、0.006(0.002,0.020)、0.047(0.015,0.389)。三组内膜mRNA表达水平比较,差异有统计学意义(H=48.965,P<0.001);其中在位内膜和异位内膜mRNA表达水平高于对照内膜(H=6.994,P=0.011;H=3.414,P<0.001),异位内膜mRNA表达水平高于在位内膜(H=3.846,P<0.001),见图2C。
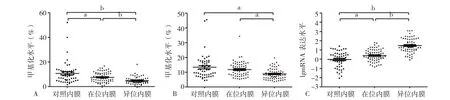
图2 三组内膜GSTM1基因启动子区片段一、二平均甲基化水平和mRNA表达水平比较Figure 2 The average methylation level in the first and second fragment and the mRNA expression level in GSTM1 promoter region in eutopic and ectopic endometriotic tissues in case group and that in endometrial tissues in control group
2.4 GSTM1 基因启动子区甲基化水平与其mRNA表达水平的相关性分析 Spearman相关性分析结果显示:GSTM1 mRNA表达水平与其启动子区片段一(-116、-111、-104、-98 CpG位点)、片段二(-40、-23、-16 CpG位点)平均甲基化水平均呈负相关(rs=-0.61,P<0.001;rs=-0.52,P<0.001)。
近年来,许多研究表明EMT是一种表观遗传性疾病,而与正常子宫内膜相比,EMT患者的在位内膜和异位内膜的甲基化表达谱中存在显著差异[7-8]。笔者前期研究采用Illumina Human Methylation 450K BeadChips技术分析卵巢EMT患者的在位、异位内膜和对照女性子宫内膜的全基因组甲基化水平,发现与对照内膜相比,卵巢EMT患者的在位内膜和异位内膜GSTM1基因启动子区呈现低甲基化水平。为了验证该芯片技术分析结果,本研究通过扩大样本量分析了三组内膜GSTM1基因启动子区甲基化水平、mRNA表达水平以及二者的关系,发现与对照内膜相比,卵巢EMT患者的在位内膜和异位内膜GSTM1基因启动子区低甲基化和mRNA高表达,并且二者之间呈负相关。在此结果的基础上,笔者通过
3 讨论
生信分析发现:GSTM1基因的转录因子AP-2α在启动子区的结合区域是(GGCCGAGGGGCG),此区域恰好覆盖片段一中的-111和-104两个CpG位点,由此推测-111和-104两个CpG位点可能是AP-2α的转录结合位点。通过上述结果可以推测GSTM1基因通过启动子区域的异常低甲基化使其mRNA表达升高,可能在卵巢EMT的发生和发展中起作用。
GSTM1是一种Ⅱ相解毒酶,可以催化包括还原型谷胱甘肽、毒物和致癌物在内的许多亲电子化合物之间的反应,具有较强的解毒作用[9]。迄今为止,许多学者认为GSTM1基因的多态性与EMT的发生有关,并认为GSTM1 null基因型导致解毒酶活性的缺失,从而增加EMT的易感性[10-11]。然而,上述研究对象是血液标本,而本研究选取的是组织标本。本研究结果显示,与对照内膜相比,卵巢EMT患者的在位内膜和异位内膜GSTM1 mRNA高表达。GSTM1除了经典的解毒酶活性之外,还可与一些大分子相互作用,参与细胞增殖和凋亡的调节。KALININA等[12]和DORION等[6]认为GSTM1是凋亡信号激酶1(ASK1)的内源性抑制剂,GSTM1 mRNA高表达可与ASK1结合产生蛋白质复合物,抑制ASK1的活性,能够维持下游靶分子p38的基础磷酸化水平,从而抑制p38MAPK信号通路的传导。HAN等[13]在小鼠EMT模型中证明抑制ASK1活性可显著抑制子宫内膜细胞凋亡。HUI等[14]在大肠癌细胞株中发现p38MAPK信号通路的部分负调节因子过表达,其中包括GSTM1。此外,RYOO等[15]认为GSTM1 mRNA高表达还可以抑制丝裂原活化蛋白激酶/细胞外信号调节激酶激酶1(MEKK1)的活性,从而抑制JNK/SAPK信号通路的促凋亡作用。p38MAPK和JNK/SAPK均是MAPK信号传导通路中的主要通路,而此通路贯穿于EMT整个发生和发展过程,在内膜细胞的凋亡、侵袭和血管生长等方面发挥着重要作用[16]。笔者未来会进一步研究GSTM1 mRNA高表达能否通过抑制MAPK信号传导通路达到抑制子宫内膜细胞凋亡的作用。
本研究提示卵巢EMT患者的在位内膜和异位内膜GSTM1基因启动子区异常低甲基化所致mRNA高表达可能在卵巢EMT的发生和发展中起重要作用,这不仅为其发病机制的研究提供了重要的理论依据,还可能为临床治疗提供新思路。
作者贡献:李琰、康山进行文章的构思与设计;王礼贤、李琰、康山进行研究的实施与可行性分析,论文的修订;王礼贤、李琰进行数据收集及整理,统计学处理,结果的分析与解释,撰写论文;康山负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
