老年肥胖患者肌少症发生情况及其危险因素研究
2021-07-08郭宇枢薛倩魏雅楠刘杰王晶桐
郭宇枢,薛倩,魏雅楠,刘杰,王晶桐
本研究背景:
随着社会经济发展及生活方式改变,近年来我国肥胖患病率逐年升高。部分老年人肥胖与肌少症共存并相互作用,易导致多种不良临床结局,但目前关于老年肥胖患者肌少症的危险因素研究较少见。
本研究创新性:
由于采用体质指数(BMI)评估老年人肥胖情况易掩盖身体成分变化,因此本研究采用操作简单、便捷并可评估肌肉质量的生物电阻抗法测定体脂率,进而探究老年肥胖患者肌少症发生情况及其危险因素,结果发现其肌少症发生率较高(17.9%),年龄及内脏脂肪面积增大、BMI及白蛋白降低是老年肥胖患者发生肌少症的独立危险因素,这对老年少肌性肥胖的早期筛查及干预等具有一定参考价值。
人口老龄化是全球面临的重大公共健康问题之一,随着老年人口比例大幅度增加,近年来我国肥胖、肌少症、骨质疏松、衰弱、失能等慢性病患者数量相继增多。肥胖是指体内脂肪比例增高,可导致健康和身体状况受损[1]。肌少症指与增龄相关的进行性全身肌量减少和/或肌强度下降或肌肉生理功能减退[2-3]。研究表明,由于脂肪量随着衰老逐渐增多而肌量随着衰老逐渐减少、脂肪组织趋于在腹部聚集[4-5],因此老年人常存在肥胖与肌少症共存的状态,即少肌性肥胖。既往研究表明,与单纯肥胖或肌少症相比,少肌性肥胖不仅会增加老年人失能、代谢紊乱、心血管疾病发生风险,还与认知功能减退、抑郁等相关[6-9],但目前关于老年肥胖患者肌少症危险因素的研究较少见。本研究为横断面研究,旨在分析老年肥胖患者肌少症发生情况及其危险因素,现报道如下。
1 对象与方法
1.1 研究对象 连续选取2018年8月—2019年8月在北京大学人民医院老年科及北京市西城区展览路社区卫生服务中心就诊的老年患者226例。纳入标准:(1)年龄≥60岁;(2)能配合完成本研究所涉及的量表评估及肌少症、肥胖的诊断测试。排除标准:(1)伴有严重骨性关节炎或神经肌肉疾病等影响活动功能的疾病;(2)伴有急性疾病或严重心、肺、肾、脑疾病;(3)因安装心脏起搏器等而不能进行生物阻抗测定。本研究经北京大学人民医院伦理审查委员会审查批准(批件号:2019PHB224-01),所有患者对本研究知情同意并签署知情同意书。
1.2 肌少症、肥胖、少肌性肥胖的诊断标准 肌少症的诊断参照2014年亚洲肌少症工作组(Asian Working Group for Sarcopenia,AWGS)制定的肌少症诊断标准[10]:(1)经生物电阻抗法(bioelectrical impedance analysis,BIA)测定男性四肢骨骼肌质量指数(appendicular skeletal mass index,ASMI)<7.0 kg/m2, 女 性 ASMI<5.7 kg/m2。(2)握力:男性 <26 kg,女性 <18 kg;握力的测量采用美国Jamar Plus+数字握力计,测量时患者取坐位、肘部弯曲90°,测量优势手3次取最大值。(3)身体活动能力:6 m步行速度<0.8 m/s;6 m步行速度的测量采用简易机体功能评估法(short physical performance battery,SPPB)中的步态速度测试,即正常步伐行走6 m的速度,平时需使用拐杖或其他行走辅助工具者测试时继续使用。符合(1)且满足(2)和/或(3)项者即可诊断为肌少症。本研究主要依据体脂率诊断肥胖,即男性体脂率≥25%、女性体脂率≥35%诊断为肥胖[11-12]。同时存在肌少症和肥胖者定义为少肌性肥胖。
1.3 观察指标
1.3.1 一般资料 收集所有患者一般资料,包括性别、年龄、身高、体质量、血压及高血压、冠心病、糖尿病、脂肪肝等慢性病发生情况,并计算体质指数(BMI)。
1.3.2 生化及代谢指标 分析所有患者生化及代谢指标,包括血红蛋白(Hb)、总蛋白(Tb)、白蛋白(Alb)、C反应蛋白(CRP)、血尿素氮(BUN)、血肌酐(Scr)、尿酸(UA)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)、糖化血红蛋白(HbA1c)、空腹胰岛素(FINS)、血钙、25-羟维生素D,并计算估算肾小球滤过率(eGRF)。
1.3.3 老年综合评估结果 由专人指导所有患者完成老年综合评估,包括广泛焦虑量表(GAD-7,用于筛查焦虑)、抑郁症筛查量表(PHQ-9,用于筛查抑郁)、亚洲骨质疏松自我筛查工具(OSTA,用于筛查骨质疏松)、FRAIL 量表(用于筛查衰弱)、蒙特利尔认知评估量表(MoCA,用于筛查认知障碍)、日常生活活动能力量表(ADL,用于筛查失能)。
1.3.4 身体成分 采用韩国In Body 770人体成分分析仪、BIA测定所有患者体脂率、肌肉含量、蛋白质含量、无机盐含量及内脏脂肪面积(visceral fat area,VFA)。
1.4 统计学方法 采用SPSS 25.0统计学软件进行数据分析。本研究计量资料均符合正态分布,以(±s)表示,组间比较采用两独立样本t检验;计数资料以相对数表示,采用χ2检验;老年肥胖患者肌少症的危险因素分析采用多因素Logistic 回归分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象筛选流程及结果 226例老年患者中140例诊断为肥胖,其中男84例,女56例;年龄60~93岁,平均年龄(75.7±9.2)岁;单纯肥胖者115例(单纯肥胖组)、肌少症合并肥胖者25例(少肌性肥胖组)。本研究中老年肥胖患者肌少症发生率为17.9%(25/140),其中男性、女性肌少症发生率分别为21.4%(18/84)、12.5%(7/56)。研究对象筛选流程见图1。
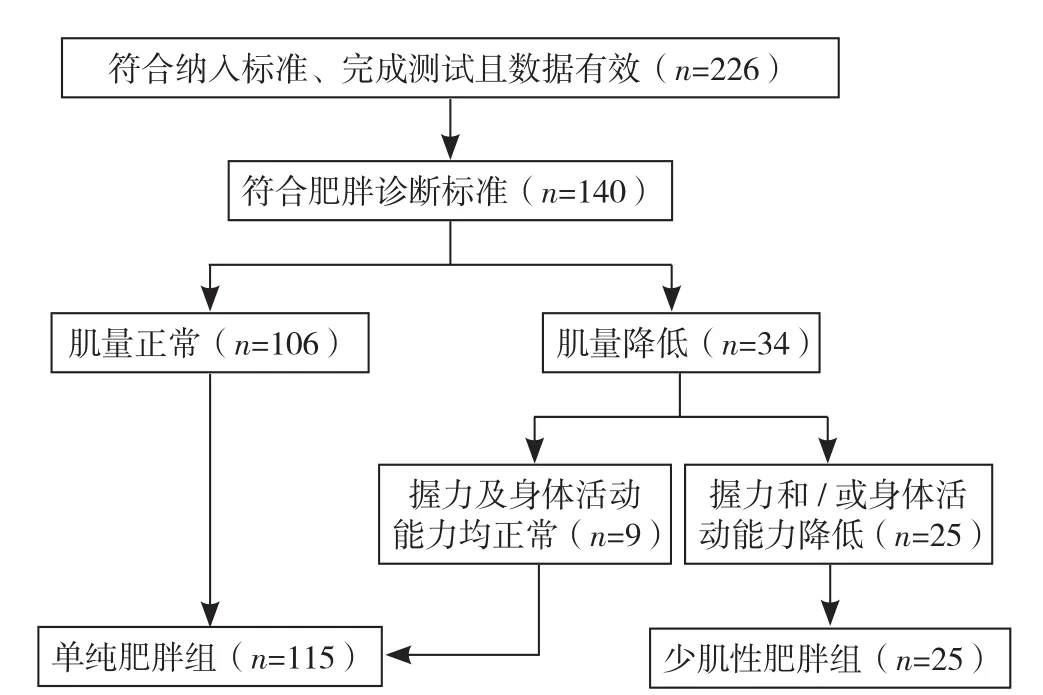
图1 研究对象筛选流程Figure 1 Flow chart for participants enrollment
2.2 一般资料 少肌性肥胖组患者年龄、收缩压大于单纯肥胖组,BMI小于单纯肥胖组,脂肪肝发生率高于单纯肥胖组,差异有统计学意义(P<0.05);两组患者女性比例、舒张压及高血压、冠心病、糖尿病发生率比较,差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较Table 1 Comparison of general information between the two groups
2.3 生化及代谢指标 少肌性肥胖组患者Hb、Alb、TG、FINS、血钙、25-羟维生素D、eGFR低于单纯肥胖组,Scr高于单纯肥胖组,差异有统计学意义(P<0.05);两 组 患 者 TP、CRP、BUN、UA、HDL-C、LDL-C、FPG、HbA1c比较,差异无统计学意义(P>0.05),见表2。
表2 两组患者生化及代谢指标比较(±s)Table 2 Comparison of biochemical and metabolic indicators between the two groups

表2 两组患者生化及代谢指标比较(±s)Table 2 Comparison of biochemical and metabolic indicators between the two groups
注:Hb=血红蛋白,TP=总蛋白,Alb=白蛋白,CRP=C反应蛋白,BUN=血尿素氮,Scr=血肌酐,UA=尿酸,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇,FPG=空腹血糖,HbA1c=糖化血红蛋白,FINS=空腹胰岛素,eGRF=估算肾小球滤过率
组别 例数 Hb(g/L) TP(g/L) Alb(g/L) CRP(mg/L) BUN(mmol/L)Scr(μmol/L) UA(μmol/L) TG(mmol/L)单纯肥胖组 115 132.9±14.2 67.0±8.1 41.9±3.9 14.4±6.2 5.9±3.6 79.1±30.5 349.9±89.3 1.6±0.8少肌性肥胖组 25 125.1±13.4 63.7±4.4 34.1±8.3 14.9±7.6 6.3±1.5 105.2±27.6 335.8±98.3 1.2±0.5 t值 2.513 1.971 7.135 0.351 0.544 3.940 0.703 2.396 P 值 0.013 0.051 <0.001 0.727 0.587 <0.001 0.483 0.018 eGFR〔ml·min-1·(1.73 m2)-1〕单纯肥胖组 1.4±1.3 2.6±0.7 5.9±2.0 7.2±2.7 10.1±4.9 2.3±0.2 33.6±16.6 76.4±19.8少肌性肥胖组 1.5±1.4 2.3±0.9 5.6±1.3 6.7±2.2 7.2±3.5 2.2±0.2 26.7±10.2 62.3±18.1 t值 0.344 1.840 0.717 0.865 2.804 2.266 1.995 3.274 P值 0.732 0.068 0.475 0.389 0.006 0.025 0.048 0.001组别 HDL-C(mmol/L)LDL-C(mmol/L)FPG(mmol/L)HbA1c(%)FINS(mU/L)血钙(mmol/L)25-羟维生素D(nmol/L)
2.4 老年综合评估结果 少肌性肥胖组患者抑郁发生率低于单纯肥胖组,差异有统计学意义(P<0.05);两组患者焦虑、骨质疏松、衰弱、认知障碍、失能发生率比较,差异无统计学意义(P>0.05),见表3。

表3 两组患者老年综合评估结果比较〔n(%)〕Table 3 Comparison of comprehensive geriatric assessment results between the two groups
2.5 身体成分 少肌性肥胖组患者肌肉含量、蛋白质含量、无机盐含量低于单纯肥胖组,VFA大于单纯肥胖组,差异有统计学意义(P<0.05)。两组患者体脂率比较,差异无统计学意义(P>0.05),见表4。
表4 两组患者身体成分比较(±s)Table 4 Comparison of body composition between the two groups

表4 两组患者身体成分比较(±s)Table 4 Comparison of body composition between the two groups
注:VFA=内脏脂肪面积
VFA(cm2)单纯肥胖组 115 34.6±5.6 25.6±4.7 9.1±1.5 3.3±0.5 107.9±23.6少肌性肥胖组 25 34.9±5.4 21.0±3.2 7.6±1.0 2.9±0.4 123.2±39.8 t值 -0.244 4.658 4.768 3.744 2.556 P 值 0.807 <0.001 <0.001 <0.001 0.012组别 例数 体脂率(%)肌肉含量(kg)蛋白质含量(kg)无机盐含量(kg)
2.6 老年肥胖患者肌少症的危险因素分析 以单因素分析中差异有统计学意义的指标为自变量(赋值见表5),以肌少症为因变量(赋值:否=0,是=1)进行多因素Logistic回归分析,结果显示,年龄及VFA增大、BMI及Alb降低是老年肥胖患者发生肌少症的独立危险因素(P<0.05),见表6。

表5 老年肥胖患者发生肌少症影响因素多因素Logistic回归分析的变量赋值Table 5 Assignment for potential factors associated with sarcopenia in obese elderly patients explored using multivariate Logistic regression

表6 老年肥胖患者发生肌少症影响因素的多因素Logistic回归分析Table 6 Multivariate Logistic regression analysis of associated factors of sarcopenia in obese elderly patients
3 讨论
少肌性肥胖的概念最早由ROUBENOFF提出,虽被定义为肥胖与肌少症共存的状态,但其并非肥胖与肌少症的简单组合,而是包括年龄相关身体成分改变、生活方式(饮食、体力活动)、胰岛素抵抗、慢性炎症、激素(皮质类固醇激素、生长激素、胰岛素样生长因子、肌肉生长抑素、睾酮)等在内的多种因素相互作用的结果[13-14]。
目前,全球范围内尚缺乏统一的少肌性肥胖诊断标准;DONINI等[15]进行的荟萃分析结果显示,目前共有19种不同的肌少症测量方法和10种肥胖测量方法来诊断少肌性肥胖,其中ASMI、BMI或体脂率是近年来临床使用较多的肌少症、肥胖的测量指标。部分老年人由于肌量减低而导致脂肪含量相对增多,因此尽管其体质量相对稳定,但以BMI作为测量指标易造成肥胖的漏诊[16],本研究以体脂率作为肥胖的主要诊断依据。
由于测量方法、判定标准及研究人群不同,因此全球范围内少肌性肥胖患病率波动范围较大,有研究表明少肌性肥胖患病率为2.1%~42.9%[17]。根据欧洲老年人肌肉衰减症工作小组(European Working Group on Sarcopenia in Older People,EWGSOP)制定的肌少症诊断标准和BMI定义的肥胖,MENG等[18]首次报道≥80岁的中国肥胖男性少肌性肥胖患病率为40%。根据2014年AWGS制定的肌少症诊断标准(BIA)结合体脂率(男性≥25%,女性≥30%)诊断少肌性肥胖,陈敏等[19]发现老年男性少肌性肥胖患病率为23.1%,女性为18.3%。本研究结果显示,老年肥胖患者肌少症发生率为17.9%(25/140),其中男性、女性肌少症发生率分别为21.4%(18/84)、12.5%(7/56),与陈敏等[19]研究结果接近,提示相当一部分老年肥胖患者存在少肌性肥胖,而筛查少肌症对老年肥胖患者具有重要意义。
肌少症、肥胖既是独立的疾病,也是多种慢性疾病及其严重程度的危险因素。有研究表明,肌少症与骨质疏松相关[20],握力减低伴腹型肥胖患者失能、长期住院风险及死亡率升高[21]。因此,应对老年人进行综合评估以筛查出肌少症、肥胖及少肌性肥胖患者,进而制定相应的干预措施、减少不良临床结局的发生。本研究结果显示,两组患者骨质疏松、衰弱、失能发生率间无统计学差异,分析其原因可能与本研究样本量较小有关。
既往研究表明,个体营养物质摄入与少肌性肥胖存在潜在联系[22];与单纯腹型肥胖患者相比,腹型肥胖合并肌少症患者营养不良比例更高[23];长期营养不良可能通过诱导高糖血症、低蛋白质合成而促进少肌性肥胖的发展,因此,均衡饮食对老年人有重要意义,而通过增加膳食纤维、减少高糖食物摄入及保持一定蛋白质摄入量可能有助于预防少肌性肥胖[24]。本研究结果显示,少肌性肥胖组患者Hb、Alb、肌肉含量、蛋白质含量、无机盐含量低于单纯肥胖组,且Alb降低是老年肥胖患者肌少症的独立危险因素之一,表明老年少肌性肥胖患者营养不良风险更大,而营养状况尤其是Alb减少与老年患者少肌性肥胖的发生密切相关。
内脏脂肪主要积聚于大网膜和肠系膜[25],经门静脉代谢时大量代谢产物直达肝脏并迫使肝脏暴露于内脏脂肪组织释放的游离脂肪酸及脂肪细胞因子,进而促进胰岛素抵抗的发生,导致机体代谢紊乱发生风险升高。目前,临床研究常采用VFA评估内脏脂肪组织堆积程度,而VFA也可作为肥胖类型分型指标,如日本肥胖学会将VFA≥100 cm2定义为腹型肥胖[26]。此外,脂肪组织尤其是内脏脂肪组织还能产生炎性因子并加速肌肉分解代谢,从而导致肌少症和肥胖的恶性循环:KIM等[27]研究发现,VFA增大与骨骼肌质量下降密切相关;MURAI等[28]研究发现,内脏脂肪增加的2型糖尿病患者肌肉质量明显减低;张恬等[29]研究发现,腹型肥胖与BMI正常的老年人肌少症发生风险升高相关。CHOI[30]研究表明,VFA增大和肌少症均与骨质疏松、代谢性疾病相关,且二者相互作用可造成致残率、致死率升高,其中涉及的机制包括体力活动减少、慢性炎性反应、胰岛素抵抗、激素水平变化等[31]。本研究结果显示,少肌性肥胖组患者VFA大于单纯肥胖组,且VFA增大是老年肥胖患者肌少症的独立危险因素之一,因此临床应注意VFA增大与肌少症之间的相互作用、进行综合管理。
综上所述,老年肥胖患者肌少症发生率较高(17.9%),年龄及VFA增大、BMI及Alb降低是老年肥胖患者肌少症的独立危险因素,但本研究为横断面研究且样本量较小,选用了适合本研究的BIA测量VFA而非临床应用较广泛的CT法,因此所得结果、结论仍需大样本量、前瞻性研究进一步证实。
作者贡献:郭宇枢、魏雅楠、刘杰进行文章的构思、研究的设计与可行性分析;郭宇枢进行资料收集、整理并撰写论文;薛倩进行论文及英文的修订;王晶桐负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
