新型抗菌肽KR-1的设计、筛选及抗菌活性评价
2021-07-08何佳宁梁东生梁悦娥左诗雅赵望泓
何佳宁,梁东生,梁悦娥,左诗雅,赵望泓
1南方医科大学南方医院口腔科,广东 广州 510515;2中山大学附属中山市人民医院口腔科,广东 中山 528400
世界卫生组织将口腔疾病与心脑血管疾病、癌症、糖尿病等并列为五大重点防治慢性病。口腔疾病中龋病的患病率高居所有慢性疾病首位,影响全球10%以上的人口[1]。第四次全国口腔健康流行病学调查结果显示[2],5、12岁儿童的患龋率分别为70.9%、34.5%,儿童患龋情况已呈现上升态势。龋病的危害不仅仅局限于影响牙齿本身的功能与美观,还体现在由其带来的一系列继发病症,并且与全身系统性疾病如心血管疾病等具有一定的相关性[3]。老年患者的认知能力下降与牙齿缺失数或龋齿数的增加有关[4]。虽然采取了预防措施,但龋病控制的效果仍不理想,因此龋病防治仍旧面临较大的挑战。以细菌为主的牙菌斑生物膜是龋病发生的始动因子。其中,与人类龋病发生最密切相关的是变异链球菌(S.mutans)。因此,抑制变异链球菌的生长对于防治龋病具有重要意义。
近年来,临床广泛使用抗菌剂作为口腔辅助用药,但长期使用抗生素会引起一定的毒性和副作用,导致菌群失衡和抗生素耐药性的发生[5]。抗菌肽是广泛存在于生物体天然免疫防御系统的一类小分子多肽类物质,具有较强的生物活性,不仅可杀灭革兰氏阳性/阴性细菌、真菌、病毒,而且对传统抗生素耐药菌亦有较好的抑制作用[6]。与传统抗生素不同,抗菌肽通过物理正负电性相互吸引的作用,正电性的抗菌肽与表面带负电的细菌细胞膜结合,破坏其完整性,使胞内容物泄漏,导致细胞死亡[7-8]。抗菌肽独特的抗菌机制使其不易产生耐药性,对某些耐药性较强的病原微生物也可发挥一定的杀菌或抑菌作用。
Histatins5是存在于人和一些高级灵长类动物唾液中的一类天然抗菌肽,可对白色念珠菌发挥有效的杀灭作用[9]。1997 年,Helmerhorst 等[10]根据抗真菌肽Histatin5的活性结构区域,设计并合成了多种类似物,Dhvar4是Histatin5最具代表性的类似物之一。在结构和功能方面,Dhvar4拥有更优的两亲性和抗菌活性以及较低的溶血活性和细胞毒性[11-12]。研究表明,与天然抗菌肽(AMP)相比,合成抗菌肽可具有更有效和更广谱的抗菌活性,不易产生耐药性限制,且细胞毒性较低[13]。
目前许多学者成功设计并合成了具有良好抗菌活性的抗菌肽,如ZXR-2[14],DPS-PI[15]等,对龋病病原菌变异链球菌显示出明显的抗菌作用。许多天然和合成的抗菌肽已被证实对细菌及相关致病毒力因子有抑制作用,越来越多的具有各种性质的新型抗菌肽正在被发现或合成,例如GH12不仅可抑制口腔链球菌的活性,还可抑制细菌致龋性以及改变多种生物膜组成[16];TVH19抗菌肽不仅有抗菌的作用,还兼具有促进再矿化的能力[17];虽然诸多研究显示抗菌肽在临床应用中的巨大潜力[18],但基于此开发的新型药物仍然很有限,这是因为大多数抗菌肽仍具有一定的局限性,比如肽链较长,空间结构复杂,导致生产成本高,合成难度大[19]。
本研究参考α-螺旋抗菌肽的结构特点,对Dhvar4进行进一步优化设计,保证其较短肽链的同时提高两亲性和疏水性。短链抗菌肽可以更高效迅速的合成和修饰,其结构和功能也更易于设计及预测;提高两亲性和疏水性则对抗菌肽与细胞膜结合的能力及抗菌活性进一步提升。因此,本研究立足于设计并筛选出高活性、低毒性的新型短链抗菌肽,探究其对S.mutans及其生物膜,以及其他口腔常见链球菌的作用效果,评估其开发为新型口腔抗菌药物的潜在应用价值。
1 材料和方法
1.1 材料
1.1.1 菌株和细胞株 S.mutans ATCC 25175、粪肠球菌(E.faecalis)ATCC29212、远缘链球菌(S.sobrinus)ATCC33478、戈登链球菌(S.gordonii)ATCC10558、血链球菌(S.sanguinis)JCM5708购自广东省菌种保藏中心(GDMCC)。原代人牙龈成纤维细胞(HGFs)取自南方医科大学南方医院口腔科正畸拔牙患者(经知情同意,伦理号:NFEC-2017-017)。
1.1.2 实验药物 Dhvar4及其衍生肽KR-1、KR-2由上海淘普生物科技有限公司使用标准的Fmoc固相肽合成方案合成。利用反相HPLC 纯化目的产物,纯度达95%以上。
1.1.3 主要试剂 脑心浸液(BHI)肉汤、琼脂(青岛海博);DMEM培养基(Gibco);胎牛血清(Gibco);磷酸盐缓冲液(Gibco);CCK-8试剂盒(Dojindo);醋酸氯己定(上海源叶);LIVE/DEAD BacLightTM细菌生存力试剂盒(Molecular Probes);1%Triton-X 100溶液(北京雷根);4%兔红细胞(广州鸿泉)。
1.2 方法
1.2.1 抗菌肽的设计 通过Prabi 网站(https://prabi.ibcp.fr/htm/site/web/home)以Dhvar4 序列作为模版。通过Heliquest网站(http://heliquest.ipmc.cnrs.fr/)获得Dhvar4的极性面和非极性面上氨基酸的信息,根据两亲性正电性α-螺旋型抗菌肽的设计理念,使用疏水性氨基酸替代亲水性氨基酸,由此合成了Dhvar4(序列:KRLFKKLLFSLRKY-NH2,相对分子质量:1839.35)及2 个 衍 生 肽 序 列KR-1 及KR-2(KR-1 序 列:KRLFKKLLFWLRKY-NH2,相对分子质量:1938.49;KR-2序列:KRLFKKLLFWLRKW-NH2,相对分子质量:1961.52)。
1.2.2 抗菌肽的筛选
1.2.2.1 细菌培养及细胞培养 将S.mutansATCC 25175、E.faecalis ATCC29212、S.sobrinus ATCC33478、S.gordonii ATCC10558、S.sanguinis JCM5708 接种培养于脑心浸液(BHI)肉汤,于37 ℃、厌氧环境(80%N2、10%CO2和10%H2)中孵育过夜。HGFs培养于含10%FBS 的DMEM培养基,于37 ℃、含5%CO2的恒温细胞培养箱中培养。
1.2.2.2 抗菌活性评价 遵循临床和实验室标准协会推荐[20],使用二倍稀释法在96 孔微量滴定板中分别对KR-1、KR-2进行抗菌活性测定[21],分别检测其最小抑菌浓度(MICs)和最小杀菌浓度(MBCs)。在96孔板上用BHI肉汤将抗菌肽KR-1及KR-2二倍稀释后加入等体积生长对数期的S.mutans ATCC 25175,各抗菌肽终浓度为3.2~25.6 μmol/L,细菌终浓度为1×106CFU/mL,每孔溶液终体积为200 μL。37 ℃厌氧环境中培育16~24 h,最低浓度的无浑浊孔为MIC,并从所有澄清实验孔中取50 μL等分试样至BHI平板上,37 ℃厌氧环境孵育48 h,无细菌生长的最低浓度为MBC。
1.2.2.3 生物相容性评价 生物相容性评价包括溶血活性和细胞毒性两部分。
用PBS缓冲液将新鲜兔血红细胞轻轻洗涤3遍,1000 g,4℃离心10min后重悬于PBS缓冲液中。使用PBS对抗菌肽KR-1、KR-2二倍稀释后加入等体积兔血红细胞重悬液,各抗菌肽终浓度为3.2~51.2 μmol/L,每孔溶液终体积为200 μL。在37 ℃、含5%CO2的细胞培养箱孵育1 h后离心,取上清测定波长为405 nm时各实验孔A值,每组设立3个副孔。
将生长状况良好的第3 代人牙龈成纤维细胞(HGFs)接种至96微孔板中,接种浓度为5×103细胞/孔,37 ℃、含5%CO2的恒温细胞培养箱中培养24 h至细胞贴壁。移除上清后分别加入经二倍稀释的KR-1、KR-2抗菌肽溶液,浓度范围为3.2~51.2 μmol/L,培养24 h后去除上清。加入10%CCK-8溶液孵育2 h。使用酶标仪检测各孔A值,检测波长450 nm。每组设立3个副孔。
1.2.3 目标抗菌肽对S.mutans生物膜的作用 抗生物膜效果评价包括对生物膜形成的影响和清除成熟生物膜的效果两部分。
参考O'Toole等[22]的结晶紫染色实验,探讨目标抗菌肽对变异链球菌生物膜形成的影响。设置实验组KR-1和阳性对照组CHX,用含1.00%(w/v)蔗糖的BHI肉汤将其稀释至0.6×、0.8×、1×、2×MICs浓度,细菌终浓度为1.0×106CFU/mL。37 ℃下厌氧孵育24 h,去除上清后用PBS 轻洗3 次,清除未黏附细菌,甲醇固定15 min后使用0.1%(w/v)结晶紫溶液染色5 min,PBS洗去多余染料,风干。向每孔中添加200 μL的95.00%乙醇,室温下避光震荡30 min,使用酶标仪测定波长为595 nm时每孔的A值。每组设立3个副孔。
使用LIVE/DEAD BacLightTM细菌生存力试剂盒染色并在共聚焦显微镜下观察,评估目标抗菌肽作用于成熟生物膜后死/活菌分布以及形态学改变。设置实验组KR-1,阳性对照组CHX和空白对照组BHI。将无菌细胞爬片置于6孔板中,并用含1.00%(w/v)蔗糖的BHI肉汤将生长对数期的S.mutans ATCC 25175调整至终浓度为1.0×106CFU/mL加入其中,37 ℃、厌氧环境中孵育24 h。去除未黏附的浮游细菌,各处理组加入终浓度为各自对应S.mutans ATCC 25175的10×MICs 浓度的药物,空白对照组仅加入BHI溶液。37 ℃、厌氧环境中孵育24 h。去上清并用PBS缓缓清洗3次。将等比例的SYTO®9和碘化丙啶混合加至细胞爬片,室温下于黑暗中放置15 min。将细胞爬片置于载玻片上,使用激光共聚焦显微镜×63油镜观察,随机选择3个视野进行拍照。
1.2.4 目标抗菌肽对其他口腔链球菌的作用
1.2.4.1 抗菌活性评价 仍通过二倍稀释法在96孔板中检测目标抗菌肽的最小抑菌浓度(MICs)和最小杀菌浓度(MBCs)进行抗菌活性评价[20-21]。配置KR-1二倍稀释液,用BHI肉汤调节生长对数期的细菌悬浮液并1∶1加入抗菌肽稀释液中,每孔液体终体积为200.0 μL,细菌终浓度为1.0×106CFU/mL,抗菌肽终浓度为3.2~102.4 μmol/L。使用BHI 肉汤作为空白对照组。37 ℃,厌氧孵育16~24 h,肉眼观察96孔板各实验孔的浑浊程度,无浑浊的最低浓度作为MIC。从所有澄清实验孔中取50.0 μL等分试样至BHI平板上,37 ℃下厌氧孵育48 h,完全抑制细菌生长的最低浓度为MBC。对所有菌株进行3次MICs和MBCs测定。
1.2.4.2 杀菌-时效评价 使用杀菌-时效实验评估抗菌肽对口腔中细菌的短效杀菌作用[23]。使用无菌BHI肉汤将目标抗菌肽分别稀释至S.mutans 所对应的1×MBCs和2×MBCs,即6.4 μmol/L和12.8 μmol/L,其中加入生长对数期,终浓度为1×106CFU/mL的细菌,终体积为200 μL。37℃孵育0、1、3、5、10、20、30 min后取出等分试样(10.0 μL)至PBS 中稀释后在BHI 琼脂上涂板,37 ℃厌氧孵育48 h计数存活菌落数,构建了抗菌肽的杀菌时效曲线。
1.2.5 统计学方法 本研究数据分析采用SPSS 23.0软件,通过t检验或单因素方差分析进行统计学分析,P<0.05代表差异具有统计学意义。所有实验都独立重复3次。
2 结果
2.1 抗菌肽的设计
本实验根据Histatin5来源的Dhvar4序列进一步进行修饰和加工得到新型抗菌肽KR-1、KR-2。分析获得Dhvar4的极性面和非极性面上氨基酸的信息后,使用色氨酸替代丝氨酸以及使用色氨酸替代丝氨酸和碳端的酪氨酸,分别构建Dhvar4的2个衍生肽序列(表1,图1)。

图1 Dhvar4及其衍生肽的螺旋示意图Fig.1 Helical wheel of Dhvar4 and its derivatives.A:Dhvar4.B:KR-1.C:KR-2.The hydrophilic residues are highlighted in blue and the hydrophobic residues in yellow.
2.2 目标抗菌肽的筛选
2.2.1 KR-1具有比KR-2相对较强的抗菌活性 改造后的多肽疏水性提高,但对S.mutans ATCC25175的抗菌活性却分别升高和降低(表1)。KR-1 对于S.mutans ATCC25175的MIC为3.2 μmol/L,MBC为6.4 μmol/L,低于Dhvar4和KR-2,抗菌活性相对较强。

表1 Dhvar4及其衍生肽的理化性质及抗菌活性Tab.1 Physicochemical properties and antibacterial activity of Dhvar4 and its derivative peptides
2.2.2 KR-1具有比KR-2相对较好的生物相容性 相同作用浓度时,KR-1比KR-2对新鲜兔红细胞的溶血性更低(图2);MIC浓度下,KR-1作用于兔血红细胞的溶血率仅约为0.35%;但当浓度进一步提高时,抗菌肽的溶血活性呈剂量依赖性增加。

图2 Dhvar4衍生肽对新鲜兔红细胞的溶血活性Fig.2 Hemolytic activity of Dhvar4-derived peptides in fresh rabbit red blood cells.*P<0.05,**P<0.01.
当使用浓度不高于6.4 μmol/L的抗菌肽处理时,KR-1、KR-2对HGFs的毒性均低于阳性对照药物阿霉素(图3A)。当使用KR-1有效抑菌浓度(3.2 μmol/L)处理时,HGFs 存活率高达72.96%;使用有效杀菌浓度(6.4 μmol/L)处理时,HGFs存活率也达到70.11%。当分别对比KR-1和KR-2有效作用浓度时,KR-1毒性显著低于KR-2(图3B)。
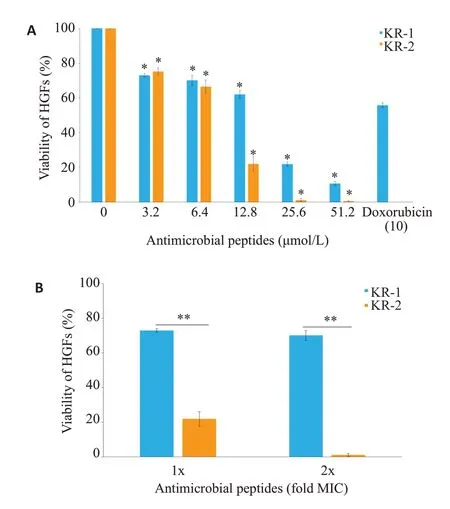
图3 Dhvar4衍生肽对人牙龈成纤维细胞(HGFs)产生的细胞毒性Fig.3 Cytotoxicity of Dhvar4-derived peptides in human gingival fibroblasts(HGFs).A:Toxicity of the antimicrobial peptides at different concentrations.B:Toxicity of the antimicrobial peptides at their effective concentrations.*P<0.05,**P<0.01.
2.3 KR-1对S.mutans生物膜具有较好的抑制与清除作用
KR-1可有效抑制S.mutans 生物膜形成,抑制效果呈浓度依赖性(图4)。当KR-1的作用浓度为0.6×MIC时,S.mutans生物膜形成率仅约为11%,KR-1的50%生物膜最小抑制浓度(MBIC50)低于1.92 μmol/L,与阳性对照药物CHX作用效果相当。而当作用浓度增大至0.8×MIC,KR-1对S.mutans生物膜的抑制效果优于CHX。

图4 KR-1对S.mutans生物膜抑制效果Fig.4 Inhibitory effect of KR-1 on S.mutans biofilm.**P<0.01.
共聚焦显微镜(CLSM)观察结果示,染料SYTO®9和PI的混合物分别对带有完整细胞膜的活细菌染色为荧光绿色,对带有损坏细胞膜的死细菌染色荧光红色。阴性对照组中,S.mutans ATCC 25175 能形成较致密而厚的生物膜,红色荧光信号较弱。当在已形成的S.mutans 生物膜中加入KR-1和CHX后,细菌生物膜活性明显降低,红色荧光信号增多,而且生物膜较疏松(图5)。

图5 KR-1对S.mutans成熟生物膜的影响Fig.5 Effect of KR-1 on mature S.mutans biofilm.
2.4 KR-1对其他口腔链球菌也具有抗菌活性
KR-1对其他较常见的口腔链球菌也具有一定的作用(表2),但对不同细菌作用效果均有所差异,其对于S.mutans ATCC 25175的抗菌活性最好,MIC为3.2 μmol/L,MBC为6.4 μmol/L;对于S.sobrinus的作用效果较差,51.2 μmol/L的KR-1才能抑制其生长,而杀菌浓度则要大于102.4 μmol/L。然而粪肠球菌对于KR-1的敏感性很低,KR-1无法杀灭粪肠球菌,并且对其生长也没有明显抑制作用。
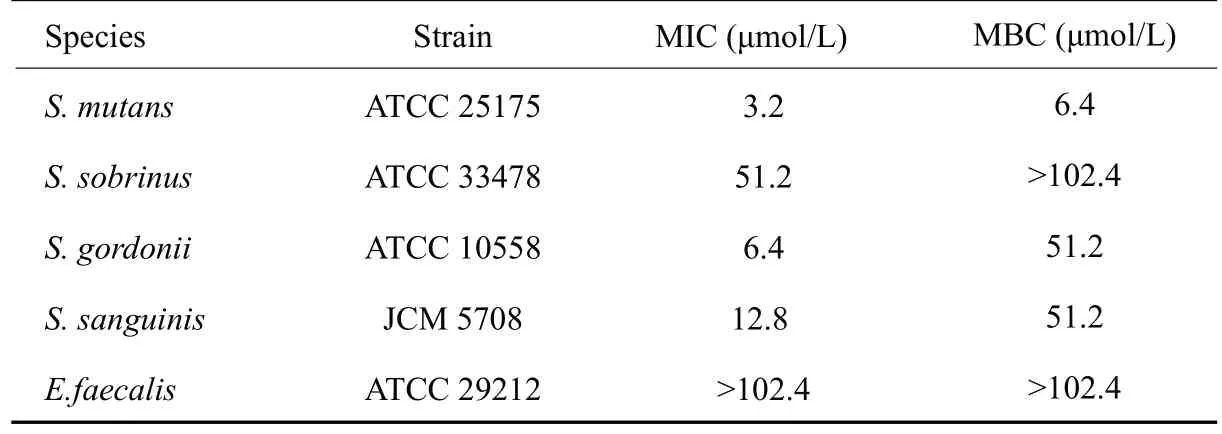
表2 KR-1对其他口腔链球菌的抗菌活性Tab.2 Antibacterial activity of KR-1 against other oral Streptococci species
通过杀菌时效实验,进一步对抗菌肽的抗菌活性进行验证,MBC(6.4 μmol/L)浓度的KR-1作用下,5 min内可降低约95%的S.mutans ATCC 25175,对于其他口腔链球菌的作用也是在5 min 内即可杀灭90%以上(图6A);2MBC(12.8 μmol/L)浓度的KR-1作用下趋势类似(图6B),其对于S.mutans ATCC 25175的作用更加迅速,1 min内即可下降约98%,对于其他口腔链球菌的杀灭效果也更加迅速。

图6 KR-1对口腔链球菌的杀菌时效曲线Fig.6 Time-killing curve of KR-1 at 6.4 μmol/L(A)and 12.8 μmol/L(B)against oral streptococcus.
3 讨论
目前抗菌肽在细菌性疾病防治中的研究已经较为广泛,但仍有部分局限性例如杀菌效率较低、生产成本昂贵、合成具有不稳定性等。本研究以天然抗菌肽的类似物Dhvar4为模板,运用两亲性正电性α-螺旋抗菌肽的设计理念,采用残基替换的方式,对其结构进行改造,设计出新型抗菌肽测定其抗菌活性,筛选出了高活性低毒性且杀菌较为迅速的短链抗菌肽KR-1。目前自然界存在的抗菌肽相对分子质量一般在2000~7000左右,由20~60个氨基酸残基组成。本研究合成并筛选出的目标抗菌肽KR-1分子量为1938.49,且仅含14个氨基酸,结构为线性短肽,合成简单且成本低,肽链稳定性较高,不易发生空间结构变化。
KR-1的结构符合两亲性正电性α-螺旋抗菌肽的设计原则。由于色氨酸具有疏水性,本研究中使用色氨酸替换非极性面上带电性氨基酸和弱疏水性氨基酸。Liang等[24]研究表明,多肽疏水性与抗菌活性之间具有明显的正比相关,疏水性决定了抗菌肽破裂菌膜的能力,疏水性越高,抗菌活性越强。然而本研究发现,经改造设计后,KR-1、KR-2的疏水性均大于Dhvar4,但疏水性最强的KR-2,MIC反而最高,也就是说,当抗菌肽的疏水性超过某个特定的阈值时,随着疏水性的增加,可能抗菌活性反而降低,所以成功设计高活性抗菌肽需要恰当提高其疏水性。有研究发现[25],超过6个净正电荷时抗菌肽抗菌活性提升不明显,甚至可能会因为同名电荷之间相互排斥而活性降低,带有4~6个正电荷的抗菌肽往往具有较好的抗菌活性。因此,本研究构建的KR-1、KR-2抗菌肽带有6个净正电荷,结合适当的疏水性设计,成功合成具有理论可行性的新型抗菌肽,后续的抗菌活性实验结果也进一步证明了此结论。
生物相容性的对比也是筛选目标抗菌肽中的重要环节。本研究中的KR-1、KR-2 是对Histatin5 衍生肽Dhvar4再次设计优化。Histatin5作为人源性抗菌肽具有人类唾液的正常成分优势,对宿主组织没有明显的不良影响[26]。但经活性改造后毒性往往会增加,随着结构上疏水性的增加,细胞毒性往往也随之增加[27],实验证明,高浓度的抗菌肽确实对HGFs产生了一定的细胞毒性,但在药物有效浓度内,即MIC浓度下,KR-1作用于兔血红细胞的溶血率仅约为0.35%,作用于HGFs存活率高达92.43%,这反映KR-1仍然具有较好的生物相容性,因此若严格控制处理时间,可能难以产生明显的毒副作用。
牙菌斑生物膜是导致龋病发生的始动因子,因此在药物防龋方面,抑制S.mutans 生物膜的形成和清除成熟生物膜具有重要意义[28]。KR-1能够明显减少形成的生物膜量,使用0.6×MIC的KR-1时,在抑制生物膜形成方面的效果与阳性对照药物CHX相当。随着作用浓度增大,KR-1对S.mutans生物膜的抑制效果优于CHX。这表明其具有良好的体外抑制S.mutans生物膜的效果;共聚焦显微镜定性结果示,KR-1也比CHX能更高效地清除成熟的S.mutans 生物膜;经抗菌肽处理后的S.mutans 生物膜变得不完整和疏松,这可能使后续的机械清除变得更加高效。因此,KR-1或许能够成为一种有效的抗生物膜药物,尤其是抗S.mutans生物膜。
KR-1不仅能够有效抑制口腔致龋菌S.mutans 的活性,还可以抑制其他口腔致病菌的活性,比如其他龋病相关的病原菌S.sobrinus 和S.gordonii。因此KR-1或许可用于口腔细菌感染性疾病的预防和治疗。KR-1具有较为快速的杀菌能力,在特定时间内,S.mutans ATCC 25175 对KR-1 的敏感性较其他实验组细菌更高。值得注意的是,在一定时间内相对于其他口腔致病菌,KR-1表现出对S.sanguinis较低的敏感性。口腔常驻菌S.sanguinis目前被认为是口腔有益菌,研究表明[29]S.sanguinis可显着减弱S.mutans在口腔和牙面定植,降低高度致龋的条件下光滑面龋的严重程度。KR-1更有选择性地抑制高致龋性链球菌的生长和代谢,在较少影响口腔有益菌的情况下对致病菌表现出较强烈的作用,而不会强烈影响低致龋性链球菌,对维护口腔常驻的“健康”微生物群落的稳定具有重要意义。
时效实验测量了抗菌肽杀灭细菌的速度,结果表明,KR-1对被测菌株作用迅速,随着肽浓度增加,杀灭时间降低。KR-1对口腔常见致病菌的最佳体外处理时间为1~3 min,此时间可杀灭约93%的S.mutans。一般来说,口腔冲洗用药及含漱液在口腔内停留时间较短,日常刷牙时间也在3 min左右,该作用效果符合口腔科用药规律,KR-1的快速杀菌性能增加了其临床应用的潜力。
然而,本研究也具有一定局限性,人类牙齿表面和口腔软组织上存在着700多种细菌,牙菌斑也是由多种细菌构成的生物膜[30],可导致多种口腔疾病包括龋齿、牙髓炎、牙龈炎和牙周炎等疾病[31-32]。本篇研究的范围仅涉及KR-1对变异链球菌及部分口腔链球菌的作用效果,今后还需要观察KR-1对含有多种细菌的复杂菌斑生物膜的影响,并使用动物模型模拟更真实的口腔微生物环境,进一步研究KR-1对龋病以及其他口腔细菌性疾病的防治效果。
本研究设计、构建并筛选出了具有高活性且低毒性的新型抗菌肽KR-1,对多种口腔致病菌具有快速、高效的抑制及杀灭作用;结果表明,其在有效浓度内具有较好的生物相容性,短时间内具有一定的杀菌选择性,还具有良好的抗生物膜特性,有望成为防治口腔细菌性疾病的新型药物,尤其在龋病防治领域可提供新的思路。
