miR-483-5p通过靶向FKBP4加重顺铂诱导的小鼠卵巢损伤
2021-07-08赵茴茴古文清潘文斌张汉彬刁瑞英汪丽萍
赵茴茴,古文清,潘文斌,张汉彬,帅 领,刁瑞英,汪丽萍,
1南方医科大学南方医院妇产科,广东 广州 510515;2中山大学孙逸仙纪念医院,广东 广州 510515;3南方医科大学基础医学院,广东 广州 510515;4深圳市第二人民医院,广东 深圳 518035
早发性卵巢功能不全(POI)是导致女性不孕的主要原因之一。其诊断标准是:≤40岁,闭经(原发性或继发性)至少4月,卵泡刺激素(FSH)水平两次(相隔1个月以上)升高>25 U/L[1]。据统计,POI患者40岁前的发病率约1%,30岁前的发病率约0.1%,20岁前的发病率约0.01%[2]。POI的病因复杂,90%的POI是由遗传、酶、自身免疫、感染或医源性因素(如化疗)导致,也可能是多因素共同作用的结果[3]。顺铂是一种常用化疗药物,用于治疗多种类型的肿瘤,包括膀胱癌、头颈部癌、肺癌、卵巢癌和睾丸癌等[4]。然而,化疗的应用提高了年轻癌症患者的长期存活率,但患者POI的发病率亦随之增加[5]。虽然针对顺铂引起的POI,国内外学者开展了一系列研究[5-7],但是,顺铂诱导卵巢损伤的机制尚不明确且缺乏有效的预测及治疗手段。因此,研究顺铂损伤机制及诊断顺铂化疗中卵巢损伤的程度显得尤为重要。
FK506结合蛋白4(FKBP4,又称FKBP52)是免疫亲和素家族FK506结合蛋白的成员。它是类固醇激素核受体的分子伴侣,参与调节靶组织的内分泌功能[8]。FKBP4的主要作用是调节类固醇激素受体的结合和转运,也与各种类型的癌症、某些生殖及神经疾病有关[9]。最新的研究指出,FKBP4的缺乏可以导致妊娠阶段子宫对黄体酮的抵抗,增加流产的风险[10-11]。但是,FKBP4在卵巢中的作用机制与功能未见报道。
MicroRNAs(miRNAs)是一类内源性的非编码RNA(ncRNAs)。成熟的miRNA与靶基因mRNAs的3'非翻译区(3'UTRs)结合,可以介导基因翻译后沉默。目前大量研究表明,microRNAs(miRNAs)具有调节POI发展进程的作用[12-13]。研究表明,miR-483-5p可能通过一种新的线粒体分裂通路增加舌鳞状细胞癌(TSCC)细胞对顺铂的敏感性[14]。然而,miR-483-5p对于顺铂诱导的卵巢功能损伤亟待阐明。
1 材料和方法
1.1 主要试剂
TRIzolLS试剂(Invitrogen),脂质体lipofectamine 3000(1∶130000,Invitrogen),The Realstar power SYBR kit(GeneStar),miR-483-5p mimics、miR-483-5p hairpinit real-time PCR kit(Gene Pharma),U6 snRNAreal-time PCR normali-zation kit(Gene Pharma),qPCR 引 物(Sangon),FKBP4 过表达质粒(Gene Chem),辣根过氧化物酶偶联的山羊抗鼠 IgG(Jackson Immunoresearch),辣根过氧化物酶偶联的山羊抗兔IgG(Jackson Immuno-research),AlexaFluor®488 偶联的 驴抗兔IGG(H+L)(Jackson Immunoresearch),AlexaFluor®594 偶联的驴抗兔IGG(H+L)(Jackson Immunoresearch),双荧光素酶报告分析系统(Promega),DeadendTM荧光TUNEL试剂盒(Promega),XhoⅠ和NotⅠ限制性内切酶(Thermo Fisher),小鼠AMH(抗苗勒氏管激素)ELISA试剂盒(Elabscience),小鼠FSH(卵泡刺激素)ELISA试剂盒(Elabscience),人类/猴/小鼠E2(雌二醇)ELISA 试剂盒(Elabscience),DMEM(Gibco),DMEM/F12(Gibco)胎牛血清购自(Gibco),所有其他试剂均购自SigmaAldrich。
1.2 POI患者血清采集
本实验共招募了6 名无血缘关系的汉族POI 妇女,6例正常对照组。排除已知染色体异常、既往妇科手术、自身免疫性疾病、躯体异常(尤其是任何与POI综合征相关的病例)或既往放/化疗史的病例。正常及POI的血清样本均来自深圳市第二人民医院生殖医学中心就诊的患者。涉及该研究的患者均经深圳市第二人民医院伦理委员会(45575561-0)批准,所有参与者均签署知情同意书。
1.3 顺铂诱导的POI模型建立
实验用野生型雌性C57BL/6J小鼠(4 周龄)均购自南方医科大学动物中心。小鼠饲养在南方医科大学SPF等级动物实验部(SYXK(粤)2016-0167)。雌性小鼠于5周龄进行顺铂诱导的POI模型建立。POI组与对照组模型建立方法为:腹腔注射顺铂/生理盐水2.5 mg·kg-1·d-1,连续注射7 d[7]。造模方法见图1。
图1 顺铂诱导的小鼠POI模型构建方法示意图Fig.1 Treatments for establishing mouse models of CDDP-induced POI.Upper:CDDP-induced POI;Lower:Normal saline-treated.
1.4 胰蛋白酶消化与iTRAQ标记
根据试剂盒的操作流程进行iTRAQ标记(Applied Biosystems,Sciex)[15]。操作流程简述:每200 μg蛋白质样品在60 ℃下用TCEP还原剂还原1 h,然后用MMTS半胱氨酸封闭剂在室温下烷基化30 min,随后在37 ℃下使用胰蛋白酶(1∶50,Promega)过夜消化蛋白样品。每组样本分别标有2个可用标签(对照:标签114和标签116;顺铂:标签117和标签119)。最后将所有标记的多肽混合在一起。
1.5 卵母细胞过表达miR-483-5p转基因小鼠的构建
miR-483-5p-floxed小鼠(赛业生物科技),Gdf9-Cre小鼠(JacksonLaboratory)。Gdf9-Cre 小鼠与miR-483-5p-floxed小鼠交配后产生的雌性miR-483-5p转基因小鼠(miR-483-5p TG)中,Gdf9-Cre+的子代为卵细胞特异性过表达小鼠(miR-483-5p TG),同窝Gdf9-Cre-的子代为对照小鼠。小鼠的基因型用裂解的鼠尾组织经PCR方法进行鉴定。
1.6 实时荧光定量PCR(qRT-PCR)
总RNA和miRNA分别使用RNAiso Plus试剂和TRIzol LS试剂提取。使用逆转录试剂盒将总RNA反转录为cDNA,使用RealStar Power SYBR 试剂盒在StepOne Plus Real-time PCR系统中进行qRT-PCR。使用Hairpin-it Real-Time PCR 试剂盒对逆转录的miR-483-5p进行qRT-PCR。最后计算ΔΔCt[16]获得FKBP4/Gapdh、miR-483-5p/U6(组织和细胞)和miR-483-5p/miR-39-3p(血清)的比值,以确定POI和对照组之间的表达变化。qRT-PCR所用引物如下所示:
has-miR-483-5p-F:5'-AGAGCACAAGACGGGA GGAA-3',has-miR-483-5p-R:5'-TATGGTTGTTCAC GACTCCTTCAC-3',mmu-miR-483-5p-F:5'-CCACC TAAGACGGGAGAAGA-3',mmu-miR-483-5p-R:5'-TATGGTTGTTGTGCTCTCTGACTC-3',U6snRNA-F:5'-CGCTTCGGCAGCACATATAC-3',U6snRNA-R:5'-TTCACGAATTTGCGTGTCATC-3',Cel-miR-39-3p-F:5'-CGTCGATCACCGGGTGTAAA-3',Cel-miR-39-3p-R:5'-TATGGTTGTTCTGCTCTCTGTCTC-3',FKBP4-F:5'-CCTCTCGAAGGAGTGGACATC-3',FKBP4-R:5'-TCCCCGATCATGGGTGTCT-3',Gapdh-F:5'-TGT GTCCGTCGTGGATCTGA-3',Gapdh-R:5'-TTGCTG TTGAAGTCGCAGGAG-3'。
1.7 原代颗粒细胞的培养
选取4周龄的C57BL6/J小鼠依次腹腔注射PMSG(5 IU,Sigma),48 h后注射hCG(5 IU,Sigma),14 h后麻醉并处死小鼠,取出小鼠卵巢。刺破卵巢组织收集颗粒细胞,使用胰蛋白酶37 ℃消化3 min,随后离心收集细胞沉淀,用含10%胎牛血清的DMEM/F12培养基重悬细胞,随后置于恒温细胞培养箱中培养。将提取的原代颗粒细胞随机分为4组:对照组、miR-483-5p组、miR-483-5p+CDDP组和miR-483-5p+FKBP4+CDDP组。
1.8 细胞培养条件、DNA转染和miRNA干扰
使用含10%胎牛血清的DMEM培养人源宫颈癌细胞系(HeLa),使用10%胎牛血清的DMEM/F12培养人颗粒细胞系(KGN)。使用脂质体Lipofectamine 3000转染miR-483-5p mimics和FKBP4过表达质粒。
1.9 聚丙烯酰胺凝胶电泳
使用8%~12.5%的SDS-PAGE进行聚丙烯酰胺凝胶电泳,然后电转移至硝酸纤维素膜上(GE Healthcare),使用5%的脱脂牛奶室温封闭1 h,与对应一抗4 ℃孵育过夜,TBST清洗3次,每次5 min,与相应二抗25 ℃孵育1 h,TBST 清洗3 次,每次5 min,使用Enhanced Chemiluminescence试剂盒(Bio-Rad)显示免疫反应蛋白。β-Actin作为内参标化目的蛋白。使用Image J软件1.8.0对目的蛋白的表达进行定量分析。所用一抗为:抗FKBP4兔多克隆抗体(1∶1000,ABclonal)、抗PARP兔多克隆抗体(1∶500,CST,9542S)、抗β-Actin(MG3)小鼠多克隆抗体(1∶3000,锐抗,RM2001)。
1.10 原位杂交
mmu-miR-483-5p的探针序列(Exiqon)含有固定的核酸和地高辛修饰的碱基(/5DigN/CTCCCTTC TCTTCTCCCGTCTT/3Dig_N/)。使用碱性磷酸酶偶联的抗地高辛配基多克隆抗体和NBT/BCIP反应液检测miR-483-5p的表达。使用ImageJ软件1.8.0对原位杂交图像进行密度计量学分析[17]。
1.11 荧光素酶测定
从小鼠cDNA中扩增出FKBP4 mRNA 3'非翻译区(GenBank:NM_010219.4),并用突变引物扩增出结合突变区。PCR产物和空载的psiCHECK-2用XhoⅠ和NotⅠ限制性内切酶以及T4连接酶进行酶切和酶连。所用引物序列如下:
FKBP4 mRNA 3'UTR-F:5'-CCGCTCGAGGGGT GGAGACAGAAGCGTAG-3',FKBP4 mRNA 3'UTRR:5'-ATTTGCGGCCGCTGACACCATCTAAAACTA CCCCC-3',FKBP4结合突变区-F:5'-CCGCTCGAGCT CGGGTGGGTGGAGACAGA-3',FKBP4结合突变区-R:5'-ATTTGCGGCCGCAAGAAAAGTAGGGTTGA GAGG-3'。使用miR-483-5p mimics和/或FKBP4质粒通过脂质体lipofectamine3000进行细胞转染。
将FKBP4 mRNA 3'UTR表达质粒或FKBP4结合突变区质粒与miR-483-5p或阴性对照(NC)mimics分别共转染HeLa细胞。按产品说明书,使用双荧光素酶报告分析系统对四组转染细胞进行分析。使用光度计(Glomax,Promega)[18]量化荧光信号。
1.12 石蜡切片与形态学分析
将分离的卵巢组织放置在4%多聚甲醛溶液中室温固定24 h,石蜡包埋后制备成4µm厚的切片。切片脱蜡复水后行苏木精-伊红(H&E)染色,每组卵巢至少取5张(相隔100µmol/L)切片进行卵泡计数与评级。根据卵泡的发育情况及发育阶段,分别对正常卵泡(原始卵泡、初级卵泡、次级卵泡、窦卵泡)及闭锁卵泡分别进行计数[19]。
1.13 TUNEL实验
脱蜡复水后的组织切片使用蛋白酶K(20 μg/mL)透化组织,按产品说明书,予TUNEL试剂孵育。使用DAPI对细胞核进行复染后封片。每组卵巢取5张切片(相隔100µm),每张切片随机选择3个包含窦卵泡颗粒细胞的区域进行TUNEL阳性信号量化,即对卵泡中凋亡的颗粒细胞进行量化。图像采集软件为FluoView FV1000共聚焦显微镜(Olympus)。
1.14 免疫荧光
脱蜡复水后的组织切片于枸橼酸钠缓冲液高压修复5 min,待冷却后使用正常山羊血清37 ℃封闭1 h,与对应一抗4 ℃孵育过夜,PBS清洗3次,每次5 min,再与相应荧光二抗37 ℃孵育1 h,PBS清洗3次,每次5 min,DAPI 25 ℃复染15 min,50%甘油封片。图像采集软件为FluoView FV1000共聚焦显微镜(Olympus)。所用一抗为:抗连接蛋白43 兔多克隆抗体(1∶100,Immunoway)、抗连接蛋白37 兔多克隆抗体(1∶100,ABclonal)、抗ki67兔多克隆抗体(1∶300,ABclonal)、抗FKBP4兔多克隆抗体(1∶100,ABclonal)。
1.15 酶联免疫吸附测定(ELISA)
将新鲜血清样本3000 r/min 离心10 min,分离血清。按产品说明书,使用针对AMH、FSH、E2的ELISA试剂盒检测血清激素水平。最后用多功能酶标仪(biotek)检测吸光度,并使用origin2019计算标准曲线并进行浓度换算。
1.16 统计学分析
统计分析使用IBM SPSS 25.0版,数据以均数±标准差描述。Student's t检验用于比较两组之间的差异。单因素方差分析(ANOVA)、posthoc Tukey检验用于比较三组之间的差异。P<0.05认为差异具有统计学意义。
2 结果
2.1 顺铂诱导的POI小鼠卵巢中,FKBP4的mRNA和蛋白水平表达均降低
iTRAQ分析结果显示(图2A),较生理盐水组,顺铂诱导组的卵巢中FKBP4蛋白的表达显著下调(差异倍数:-0.6503)。此外,qRT-PCR及Western blot结果显示顺铂诱导组的卵巢中FKBP4的mRNA(P=0.0057,图2B)及FKBP4蛋白水平均显著降低(P=0.015,图2C、D)。
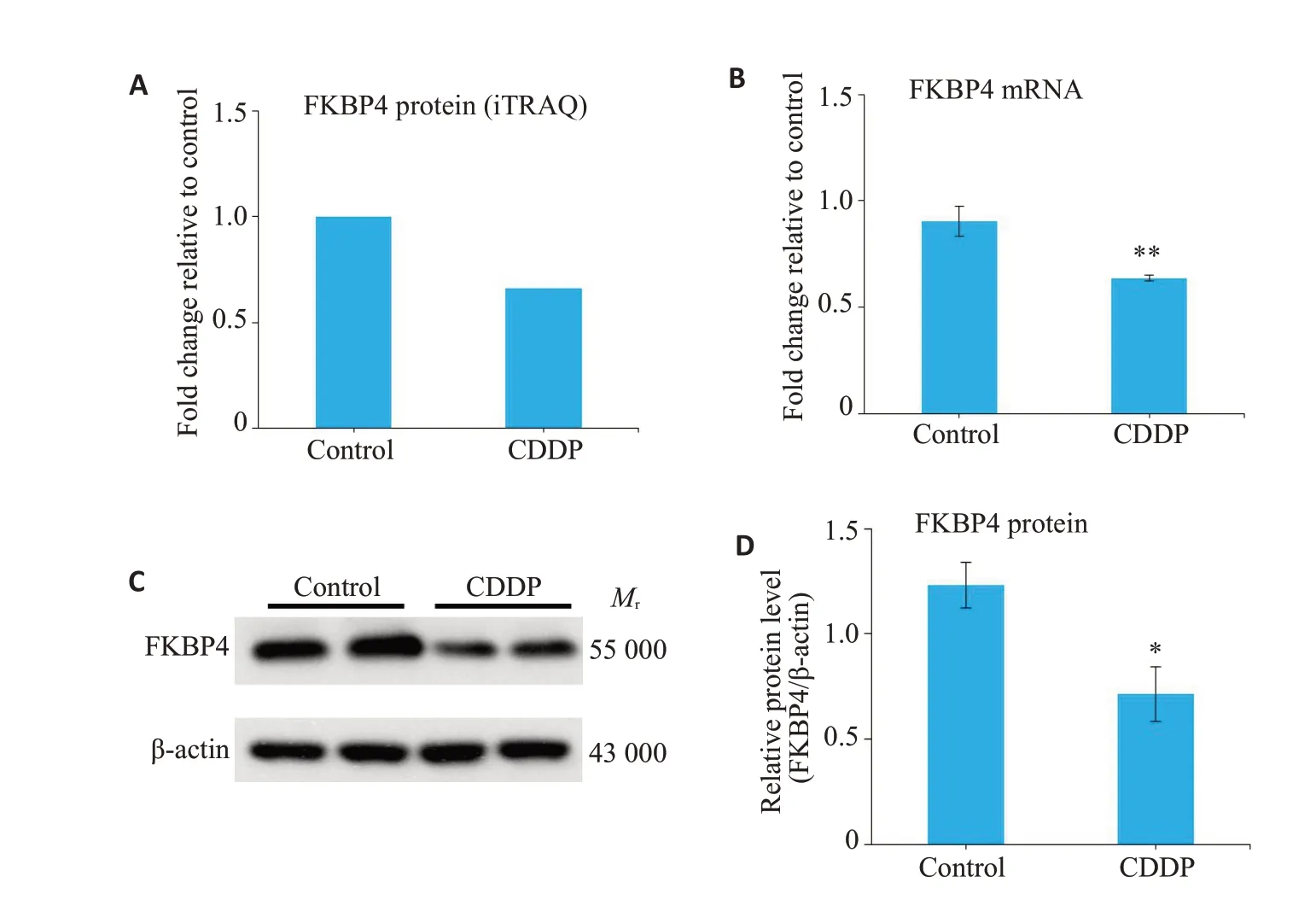
图2 顺铂诱导的POI小鼠模型中,FKBP4的表达下调Fig.2 FKBP4 expression is down-regulated in mice with CDDP-induced POI.A:Ovarian FKBP4 expression detected using iTRAQ analysis.B:Ovarian FKBP4 mRNA level detected using qRT-PCR.C:FKBP4 protein expression in the ovaries determined using Western blotting.D:Quantification of the results of Western blotting.*P<0.05,**P<0.01 vs control.
2.2 miR-483-5p可能是FKBP4的上游调节因子,其在顺铂诱导的POI小鼠模型及POI患者血清中均高表达
利用TargetScan软件确定了可能的上游调控因子miR-483-5p,它可以与FKBP4mRNA的3'UTR上1771-1765序列特异性结合(图3A)。对顺铂诱导组小鼠模型的卵巢和血清中miR-483-5p进行分析。qRT-PCR结果显示,较对照组,顺铂诱导组miR-483-5p表达水平在卵巢(P=0.0092,图3B)和血清(P=0.001,图3C)中均显著升高。原位杂交实验结果显示,较对照组,miR-483-5p在顺铂诱导组的卵母细胞和颗粒细胞中高表达(P<0.001,图3D、E)。此外,对POI患者血清样本进行qRTPCR检测,与正常患者相比,POI患者miR-483-5p的表达量显著升高(P<0.001,图3F),这与顺铂诱导的POI小鼠模型结果一致。
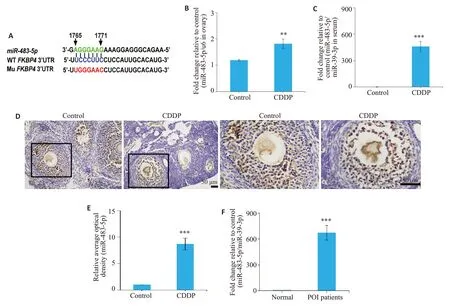
图3 在顺铂诱导的POI小鼠模型和POI患者血清中,miR-483-5p高表达Fig.3 miR-483-5p is highly expressed in the serum of POI mouse models and POI patients.A:Interaction between miR-483-5p and FKBP4 3'UTR region from human.Green represents the sequences from 1765 to 1771 of miR-483-5p,blue represents wild-type sequences in the 3'UTR from human FKBP4;red represents mutant sequences in the 3'UTR from human FKBP4.The expression of miR-483-5p was determined by qRT-PCR.B,C:miR-483-5p expressions in the ovaries and serum of mouse models of POI.D:In situ hybridization(Original magnification,upper panel:×200;lower panel:×200.Scale bar=50µm).E:Semi-quantification analysis.Images at the bottom show enlarged views of the inserted frame.F:Serum levels of miR-483-5p in POI patients determined using qRT-PCR.mRNA levels were normalized against miR-39-3p.**P<0.01,***P<0.001 vs control.
2.3 FKBP4是miR-483-5p的功能靶点,FKBP4可缓解顺铂联合miR-483-5p过表达导致的颗粒细胞凋亡
转染miR-483-5p mimics的HeLa细胞miR-483-5p表达上调(P<0.001,图4A)。双荧光素酶实验结果显示,miR-483-5p mimic过表达可导致FKBP4 3'UTR报告质粒的荧光素酶活性降低(P=0.009,图4B),而对FKBP4 3'UTR结合突变区报告质粒的荧光素酶活性没有影响(P=0.787,图4B)。此外,Western blot试验证明转染miR-483-5p mimics的HeLa细胞FKBP4蛋白水平显著降低(P<0.001,图4C、D)。
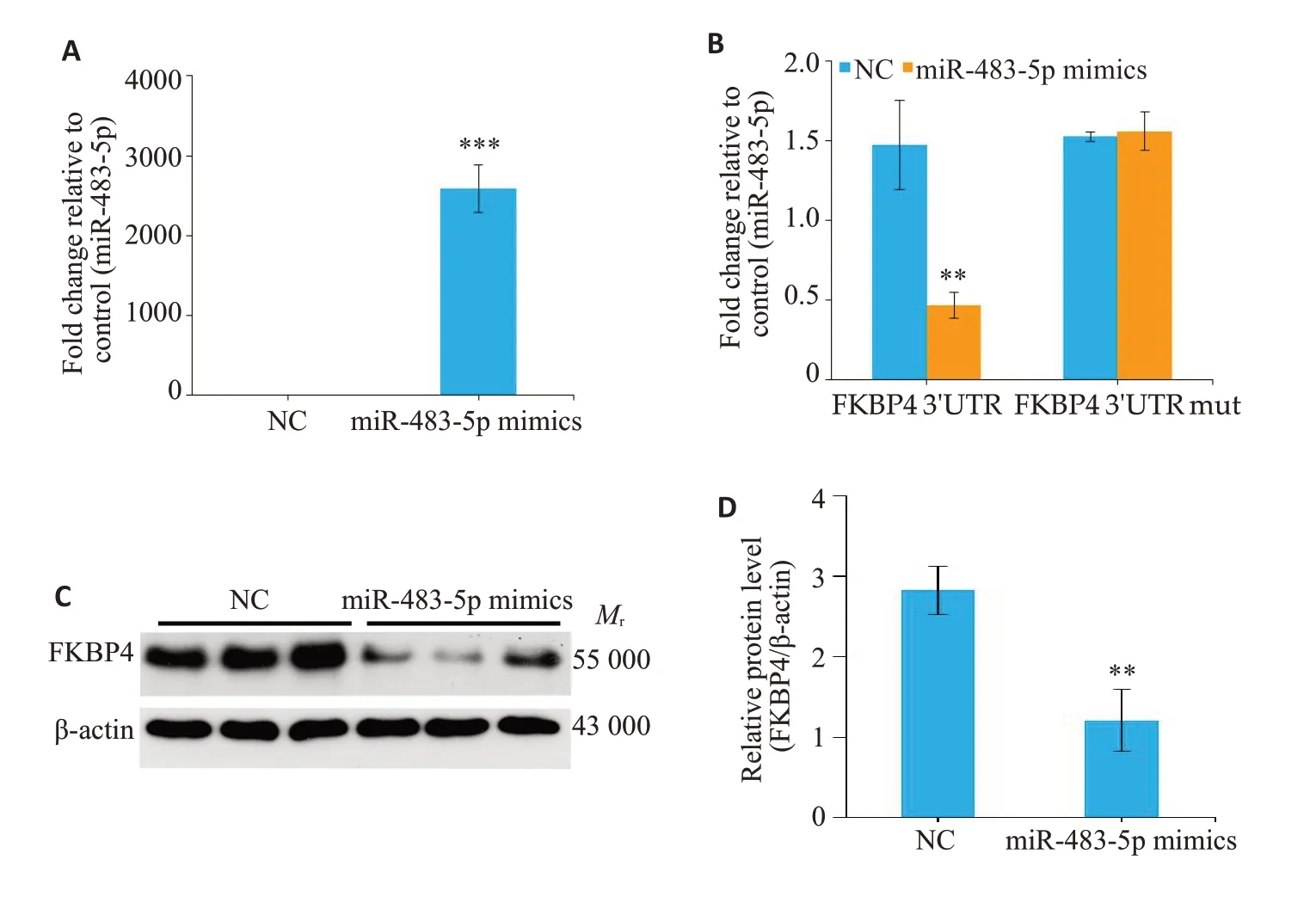
图4 体外实验中,FKBP4是miR-483-5p的功能靶点Fig.4 FKBP4 is a functional target of miR-483-5p.A:qRT-RCR analysis was used to test the transfection efficiency of miR-483-5p mimics in HeLa cells.B:The specific regulation of FKBP4 by miR-483-5p was demonstrated using luciferase analysis.C:The expression of FKBP4 protein was determined by Western blotting in HeLa cells transfected with miR-483-5p mimics.D:Quantitative analysis of the results of Western blotting.NC:Negative control.**P<0.01,***P<0.001 vs control.
我们在KGN 细胞和原代颗粒细胞中单独/同时过表达miR-483-5p 或/和FKBP4。无论有无顺铂诱导,在miR-483-5p过表达后,KGN细胞和原代颗粒细胞FKBP4蛋白水平均下调(P=0.004,P=0.003,图5A、B,P=0.015,P=0.001,图5D、E),PARP 表达均上调(P=0.0051,P=0.0012,图5A、C,P=0.024,P=0.023,图5D、F)。此外,KGN细胞和原代颗粒中FKBP4过表达可缓解顺铂诱导和miR-483-5p过表达引起的PARP 表达上调(P=0.909,图5A、C,P=0.486,图5D、F)。
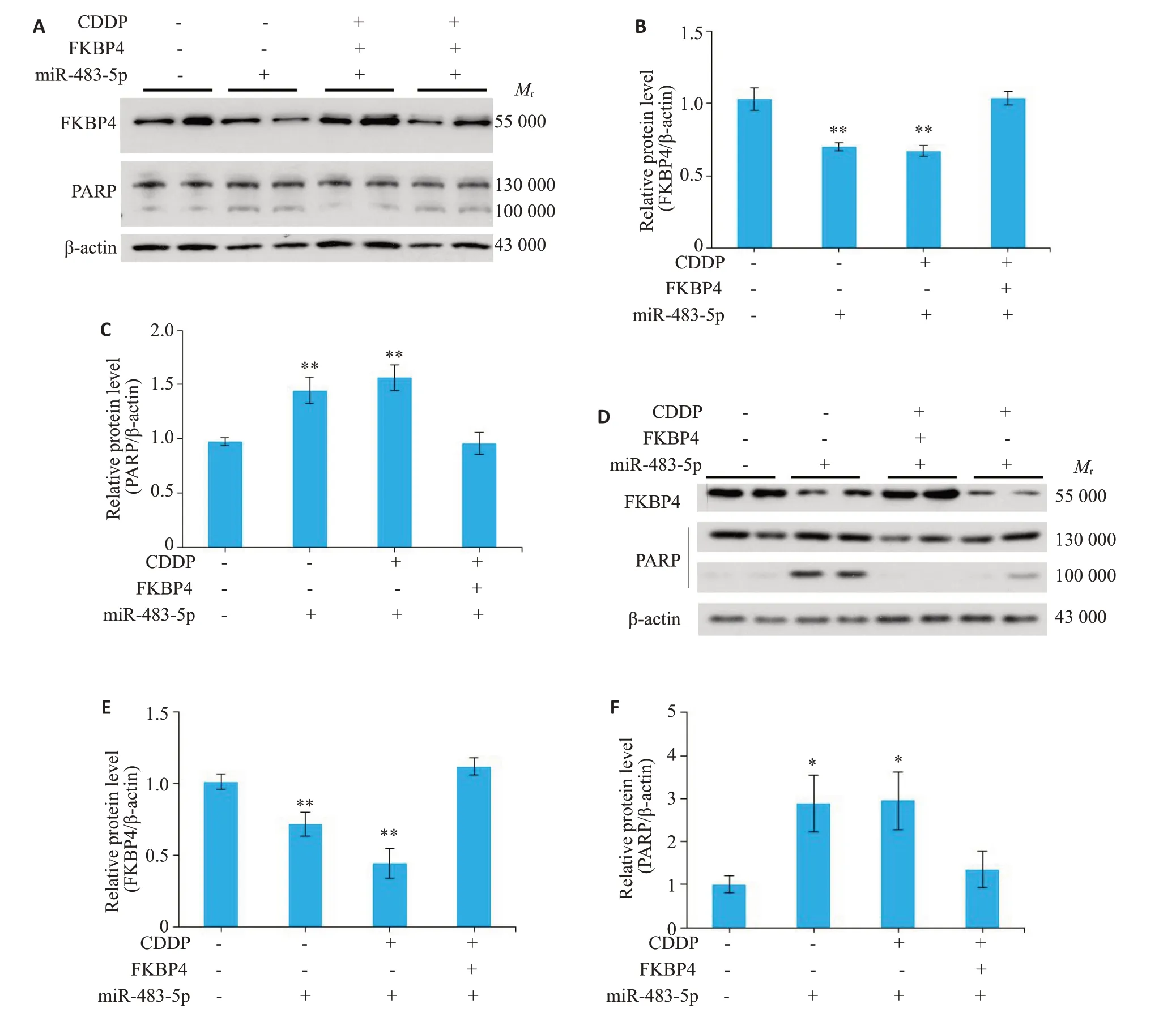
图5 在KGN和原代颗粒细胞中,过表达FKBP4可减轻顺铂联合miR-483-5p过表达引起的细胞凋亡Fig.5 Overexpression of FKBP4 in KGN and primary GCs alleviates apoptosis caused by CDDP and miR-483-5p overexpression.A-C:Expression levels of FKBP4 and PARP determined in KGN cells treated by CDDP plus miR-483-5p or/and FKBP4 plasmid transfection using Western blotting.D-F:Expression levels of FKBP4 and PARP determined in primary GCs treated with CDDP plus miR-483-5p or/and FKBP4 plasmid transfection using Western blotting.*P<0.05,**P<0.01 vs control.
2.4 卵母细胞过表达miR-483-5p加重了顺铂诱导的卵巢损伤
PCR 和qPCR 结果显示miR-483-5p TG 小鼠中,在基因和mRNA 水平均特异性过表达miR-483-5p(P=0.0054,图6A、B)。原位杂交及其半定量分析结果显示miR-483-5p在miR-483-5p TG小鼠的卵母细胞和颗粒细胞中表达升高(P=0.005,图6C、D)。然而,FKBP4在miR-483-5p TG小鼠的卵母细胞和颗粒细胞中表达显著降低(P=0.019,图6E、F)。并且,经顺铂处理后,miR-483-5p TG小鼠的FKBP4蛋白水平进一步降低(P<0.001,P=0.003,图6E、F)。
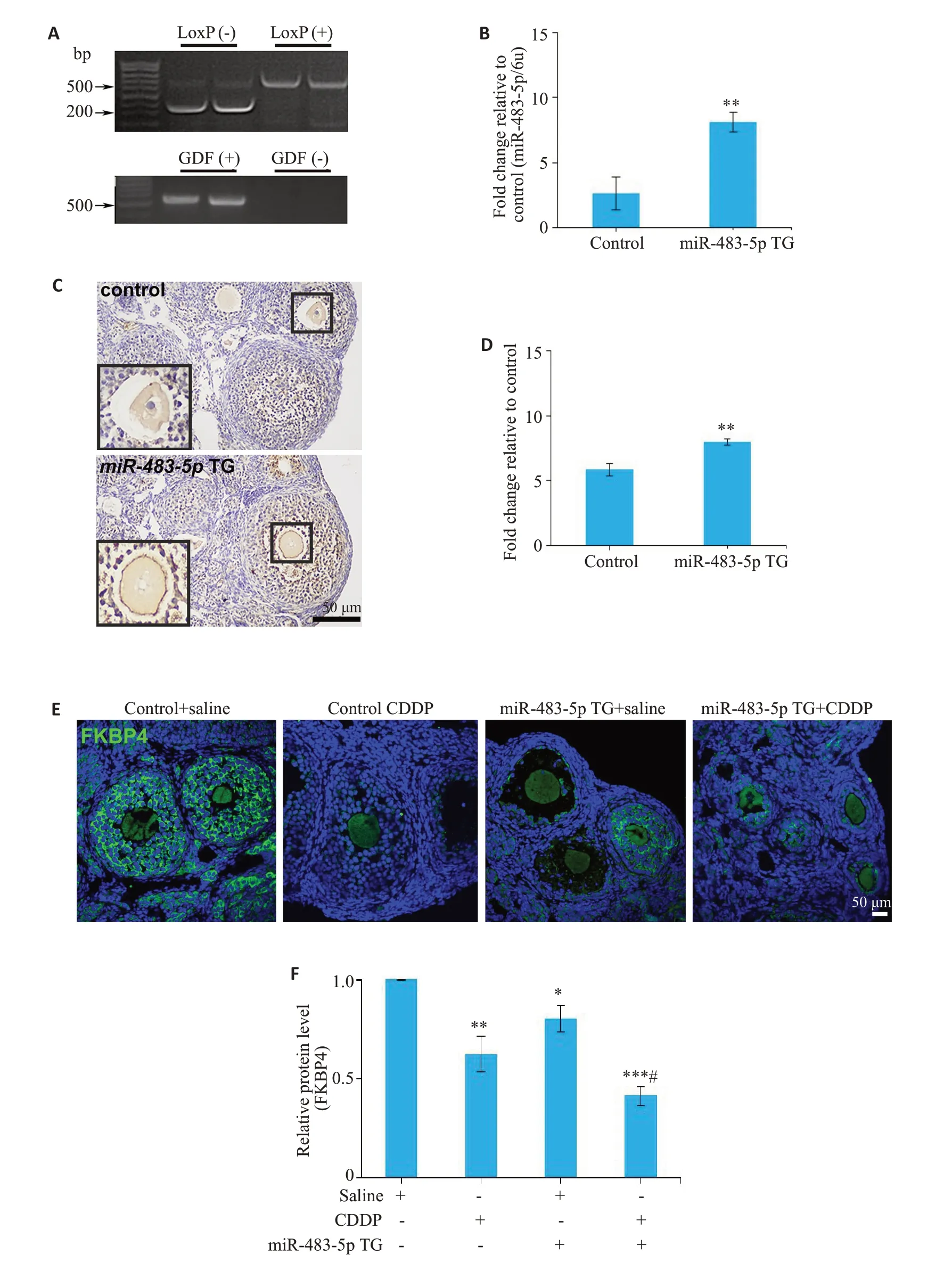
图6 用Cre/loxP系统建立miR-483-5p TG小鼠Fig.6 miR-483-5p TG mice established using the Cre/LoxP system.F1 offspring mice were genotyped using PCR(A)and qRT-PCR(B).The 200 bp bands corresponds to the miR-483-5p LoxP(-),while the 500 bp band corresponds to miR-483-5p LoxP(+),and the band below the 500 bp band corresponds to Gdf9-Cre.C,D:Location and expression of miR-483-5p were tested in the ovaries from miR-483-5p TG mice using in situ hybridization(Huge image:×100,upper right image:×200).The insert on the lower left shows an enlarged view of the inserted frame.E,F:Location and expression of FKBP4 were tested in the ovaries from miR-483-5p TG mice using immunofluorescence (×200).The mouse model was divided into four groups,including control plus saline,control plus CDDP,miR-483-5p TG plus saline,and miR-483-5p TG plus CDDP.*P<0.05,**P<0.01,***P<0.001 vs control,#P<0.01 vs CDDP.
miR-483-5p TG小鼠的卵巢质量略微减轻,但无统计学差异(图7A、B)。对照组与过表达组小鼠经过顺铂诱导卵巢质量均会显著减轻。但miR-483-5p TG小鼠对顺铂造成的卵巢重量减轻影响更显著(P=0.001,图7A、B)。HE 结果(图7C)表明,与顺铂诱导组相比,miR-483-5p TG小鼠在顺铂诱导下的原始卵泡、窦卵泡显著减少(P=0.003,P=0.003,图7D),而闭锁卵泡的数量显著上升(P<0.001,图7E)。此外,与顺铂诱导组相比,miR-483-5p TG小鼠在顺铂诱导下的AMH和E2显著降低(P<0.001,图7F、G),而FSH水平显著升高(P=0.027,图7H)。免疫荧光结果显示,与顺铂诱导组相比,miR-483-5p TG小鼠在顺铂诱导下颗粒细胞的凋亡水平显著升高,增殖水平显著下调(P<0.001,图7I,J、M,N)。并且,与顺铂诱导组相比,连接蛋白37 和连接蛋白43 的水平均显著降低(P=0.032,P<0.001,图7K,L、O,P)。
3 讨论
POI是导致不孕的主要原因之一,但目前仍无公认有效的治疗方法。因此寻找病因,确定病程对治疗至关重要[20]。POI发生的原因之一是化疗药物产生的生殖毒性。近几十年来,年轻女性癌症患者的5年生存率呈上升趋势,但患者成年后的不孕率也显著增加[21]。顺铂通过PTEN/AKT/FOXO3a通路过度激活休眠的原始卵泡,进而导致POI[6-7]。由于,伊马替尼通过抑制c-Abl-TAp63通路保护小鼠卵母细胞免受化疗的损害,从而缓解顺铂造成的卵巢损伤仍存在争议[22]。因此,确定POI患者的预防性诊断标记物和有效的治疗方法仍亟待解决。miR-483-5p可能通过一种新的线粒体分裂通路增加舌鳞状细胞癌(TSCC)细胞对顺铂的敏感性[14]。同时,miR-483-5p通过抑制MAPK通路参与软骨细胞基质的丢失[23]。也有研究发现多囊卵巢综合征患者卵丘细胞miR-483-5p水平显著降低;miR-483-5p可能通过激活PI3K/AKT 通路促进卵丘细胞增殖;以及miR-483-5p可能在降低胰岛素抵抗中发挥重要作用[24-26]。并且,microRNAs(miRNAs)在POI的发病机制中发挥重要作用[12]。因此,本研究旨在探讨顺铂诱导POI的机制,发现POI的发生和发展的新方法。
通过C57BL/6小鼠构建顺铂诱导的POI模型,探讨POI的潜在机制。蛋白质组和iTRAQ分析发现,在顺铂诱导的POI 模型中,卵巢中FKBP4 蛋白显著下调。FKBP4作为FK506结合蛋白(FKBPs)家族的一员,能够与HSP90复合物结合,且是雄激素、糖皮质激素和孕激素受体信号通路的重要正向调节因子[26]。此外,FKBP4也与各种类型的癌症以及部分生殖和神经疾病有关[9]。雄性和雌性FKBP4缺陷小鼠均表现出雄激素、糖皮质激素及孕酮的不敏感[27]。我们的研究表明,在顺铂诱导的POI模型中,FKBP4 mRNA和蛋白的表达水平均降低。因此,FKBP4在卵巢中的表达下调可能在顺铂诱导POI的损伤过程中起作用。
为了进一步阐明FKBP4在顺铂诱导的POI中下调的原因,我们利用TargetScan软件确定了FKBP4的上游内源性调节因子,miR-483-5p。并且,miR-483-5p能与FKBP4 mRNA的3'UTR 1771-1765位点特异性结合。通过qRT-PCR,发现顺铂诱导卵巢中miR-483-5p高表达。与正常患者相比,POI患者miR-483-5p水平也上调。miR-483-5p的上调与肾上腺皮质癌的疾病特异性生存期缩短显著相关[28]。且miR-483-5p还被证实通过刺激肥大软骨细胞和血管形成影响骨关节炎的发生和发展[29]。通过原代和KGN细胞系进一步证明,FKBP4过表达可以降低顺铂联合miR-483-5p过表达而导致的PARP 的升高。因此,本研究发现,FKBP4 是miR-483-5p确认的功能靶点;过表达FKBP4可以缓解顺铂和miR-483-5p过表达引起的细胞凋亡。
为了探究miR-483-5p在POI发生发展中的作用,我们建立了卵母细胞特异性过表达miR-483-5p的转基因小鼠。与对照组相比,miR-483-5p TG小鼠无明显的POI 病理特征。这表明单独的过表达卵母细胞miR-483-5p并不能引起POI的病理特征。且有研究表明,过表达miR-483-5p的小鼠在肝脏形态方面没有表现出任何异常的结构变化[30]。然而,miR-483-5p TG小鼠,经顺铂处理,会明显加重POI的损伤并扰乱性激素水平。这表明miR-483-5p TG小鼠可能对顺铂更敏感,尤其是在卵巢损伤方面。
综上所述,我们的研究揭示了一个新的通路miR-483-5p/FKBP4,在顺铂诱导的POI 中发挥作用。POI的损伤过程可能与上调的miR-483-5p导致FKBP4蛋白表达下降有关。miR-483-5p上调可能增加卵巢对顺铂药物的敏感性,使卵巢功能降低。检测血清miR-483-5p可以用来预测POI的发生和发展。
