基于偏最小二乘回归法分析药用紫草抗肿瘤谱效关系
2021-07-07廖梅
廖梅
药用紫草是我国传统中药,研究应用广泛,主要指新疆紫草Arnebia euchroma
(Royle)Johnst(AE)、内蒙古紫草Arnebia guttata
Bunge(AG)及紫草Lithospermumerythrorhizon
Sieb.et Zucc(LE)的干燥根。实践证明,紫草及其复方制剂可用于治疗子宫绒毛膜上皮癌、胃癌、食道癌等疾病。作为紫草的主要有效成分,紫草素及其衍生物对人非小细胞肺癌细胞系(A549)显示较好体内和体外抑制活性,其抗肿瘤作用机制可能与抑制细胞增殖、侵袭、迁移、上调p53基因(p53)、B淋巴细胞瘤-2基因相关X蛋白(Bax)、裂解半胱天冬酶-9(cleaved-caspase-9)、裂 解 半 胱 天 冬 酶-9(cleaved-caspase-3)和下调B淋巴细胞瘤-2基因(Bcl-2)的表达,激活细胞线粒体凋亡途径,诱使受体相互作用蛋白激酶1(RIP1)和受体相互作用蛋白激酶3(RIP3)的增高导致细胞程序性坏死等途径有关。本研究前期采用MTT法评价,结果显示紫草甲醇提取物对A549表现出优异的细胞增殖抑制活性,其抑制作用呈现剂量依赖性,某些产地样品的半数抑制浓度(IC值)与阳性药紫杉醇相当。近年来,LC-MS/MS将液相色谱特别是超高效液相色谱与高灵敏度的质谱技术相结合,能够获得丰富的结构信息,从而建立快速、高效的分析方法。UHPLC-QTRAP-MS/MS(MRM)特征轮廓谱是在LC-MS/MS技术基础上建立的能全面、特异性识别、表征和定量某一类结构性质相关化学成分的特殊指纹图谱。由于MRM功能的高选择性和灵敏性,根据样品中每个MRM离子对表征的色谱峰面积可用于相对定量,在获得单体化合物的标准品后可进行绝对定量。基于UHPLC-QTRAP-MS/MS(MRM)技术的紫草素类成分特征轮廓谱在定量的同时能实现化合物的定性需要,有效解决了大量谱效关系研究只筛选活性色谱峰而对其结构不明的问题。紫草素成分复杂,结构多样,主要成分和微量成分的含量悬殊、分离纯化困难,致使紫草素类成分与其抗肿瘤药效关系仍不明确,影响其内在质量评价体系的建立。因此,笔者首先采用UHPLCQTRAP-MS/MS(MRM)特征轮廓谱技术建立不同产地紫草提取物的指纹图谱,采用MTT法测定紫草甲醇提取物对A549细胞的抑制率作为药效指标,然后通过偏最小二乘回归法(PLSR)分析辨识与抗肿瘤活性具有重要影响的特征峰,最后对部分化合物进行活性验证,为阐明药用紫草的抗肿瘤药效物质基础提供科学依据。
1 仪器与材料
1.1 仪器
QTRAP4000质谱仪配备ESI离子源及Analyst 1.6.3,Peak View1.2数据处理系统(美国AB SCIEX公司),配备LC20ADXR高效液相色谱仪(日本Shimadzu公司);MS103DU电子分析天平(瑞士Mettler Toledo公司);Rt2100C型酶标检测仪(深圳Rayto公司)。1.2 试药
色谱纯甲醇、乙腈(美国Fisher公司);分析纯98%甲酸和甲酸铵(国药集团化学试剂有限公司);双氯芬酸钾(中国食品药品检定研究院,批号100880);紫杉醇(Sigma公司,批号T1912);改良型RPMI-1640培养基(Hyclone,批号SH30809.01B);胎牛血清(杭州四季青生物工程材料有限公司,批号141215);胰酶(AMRESCO Inc,批号0457);MTT(AMRESCOInc,批号0793);DMSO(AMRESCOInc,批号0231)。药用紫草饮片购买自安徽省亳州市百姓平价药业有限责任公司,由嘉应学院张声源副教授鉴定,样品信息见表1。
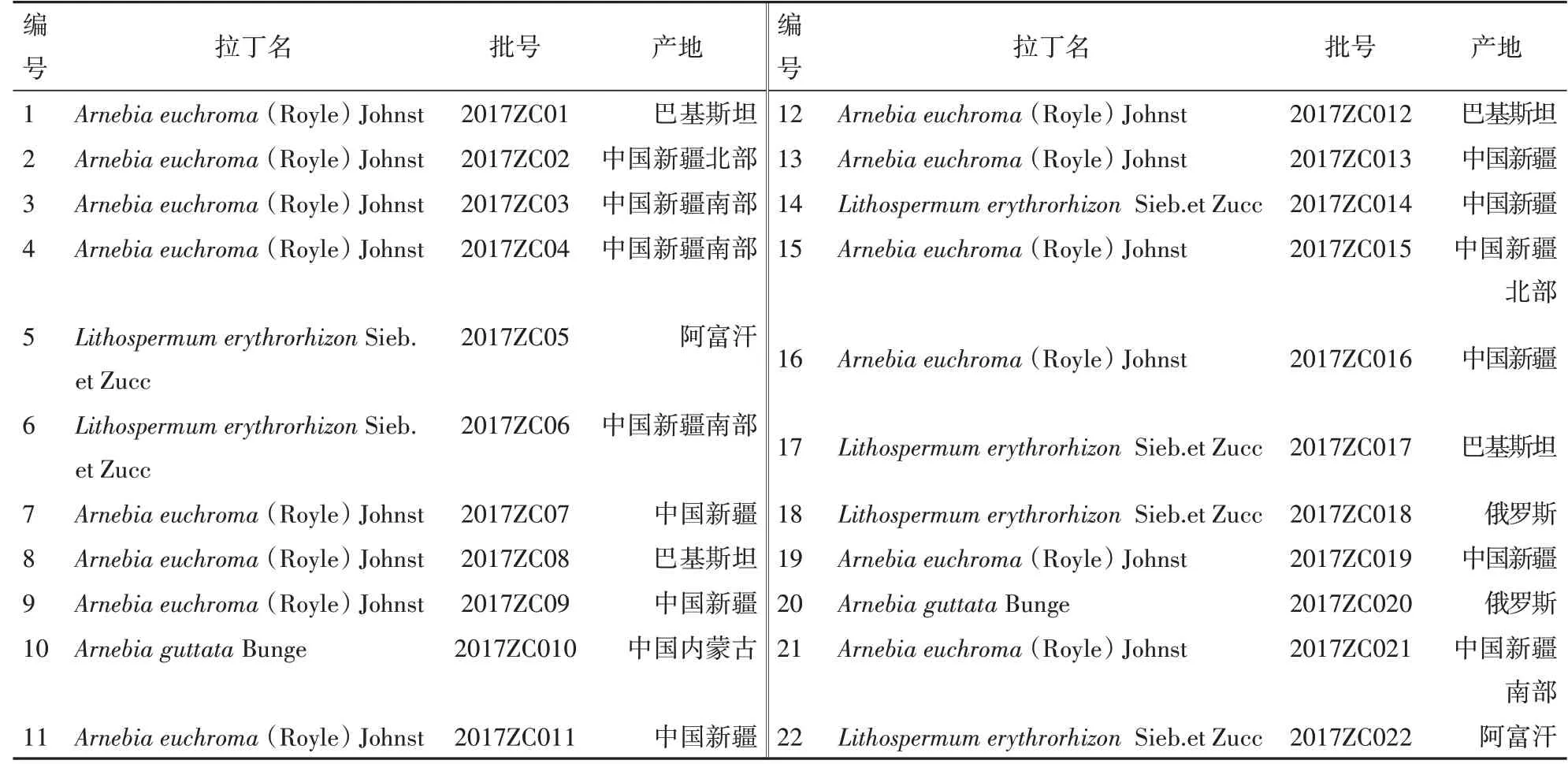
表1 紫草样品信息
2 方法与结果
2.1 药用紫草UHPLC-QTRAP-MS/MS(MRM)特征轮廓谱的建立
2.1.1 内标物溶液的制备
精密称取双氯芬酸钾10 mg,加甲醇配成1 mg/mL的储备液,吸取该溶液适量,甲醇稀释至1μg/mL,作为内标物溶液,4°C下密封保存备用。2.1.2 供试品溶液的制备
各紫草样品经适当粉碎后过40目筛,称取1 g粉末,每个样品重复制备3份。加20 mL甲醇摇匀,室温超声提取30 min,放冷至室温,过滤要滤液;滤渣加10 mL甲醇重复提取2次,合并3次提取液。吸取提取液1 mL,10 000 r/min离心10 min,取上清液0.5 mL适量,甲醇稀释10倍,即为供试品溶液。分别取各供试品溶液1 mL,涡旋混合2 min,即为质控样品(QC)溶液。进样前,精密吸取供试品溶液200μL,内标物溶液20μL,小心吹打混匀,进样分析。2.1.3 分析条件
色谱柱为Welch Ultimate XB-C(100 mm×2.1 mm,1.8μm);5 mmol/L甲酸铵水溶液(含0.01%甲酸)为A相,乙腈为B相;洗脱条件为:0~0.1 min,20%B;0.1~10.0 min,20%~50%B;10.0~30.0 min,50%~60%B;30.0~35.0 min,60%~95%B;35.0~40.0 min,95%B;40.0~40.1 min,95%~20%B;40.1~45.0 min,20%B;柱温40℃;进样器温度4℃;流速0.3 mL/min;进样量10μL。ESI离子源,负离子电离模式。质谱参数为:CUR:30 psi,GS1:50 psi,GS2:50 psi,ISVF:-4.5 kV,TEM:500℃,DP:-60 V,CE:-30 eV,CES:15 v,MRM模式。
2.1.4 特征轮廓谱的建立
将22批紫草饮片按“2.1.2”项制得供试品溶液,按照“2.1.3”项下的测定条件进样测定,并记录各批次样品色谱数据。为了考察仪器系统的稳定性和色谱峰的重现性,参考文献方法设置QC进样顺序,采用MarkerView1.2.1软件提取色谱峰数据。以双氯芬酸钾内标峰为参照执行保留时间(RT)校正和峰面积归一化命令,最终相对定量57个特征峰(表2)。结果显示各QC样品中各特征峰的相对峰面积和RT值的RSD值分别在3.1%~8.6%和0.1%~2.5%。说明系统重现性良好,测定变量的差异是由样品本身的差异引起。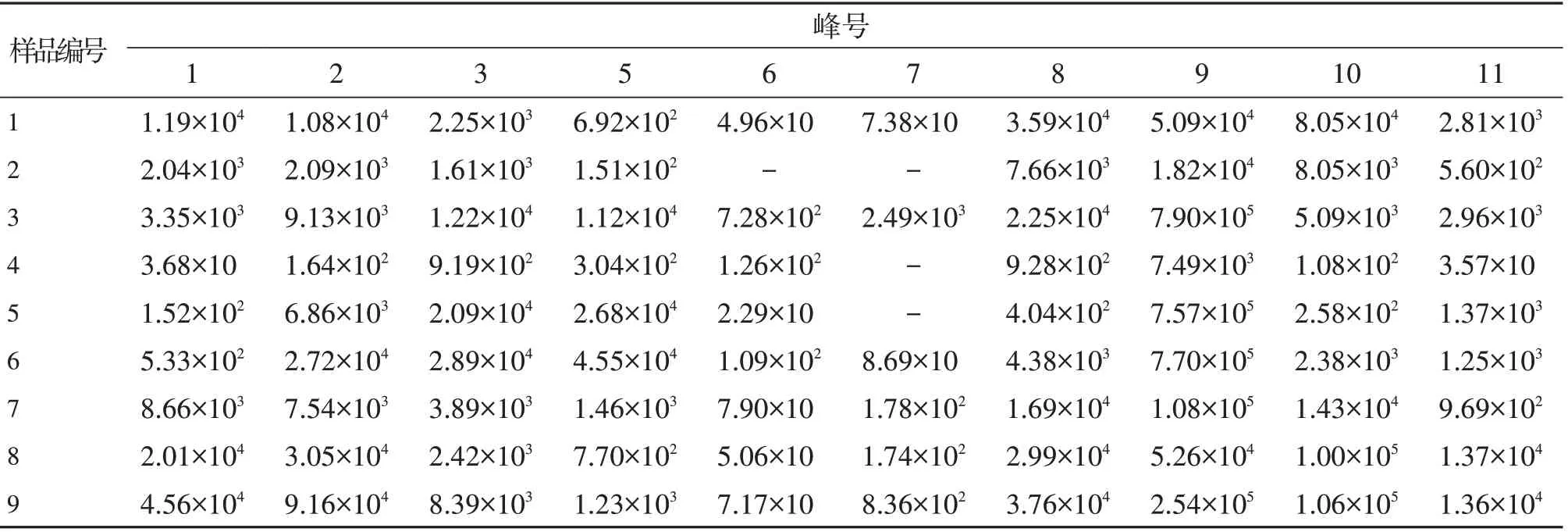
表2 22批紫草提取物中特征峰的相对峰面积

续表2 22批紫草提取物中特征峰的相对峰面积

续表2 22批紫草提取物中特征峰的相对峰面积

续表2 22批紫草提取物中特征峰的相对峰面积
2.2 紫草体外抗肿瘤药效学实验
2.2.1 样品溶液的制备
分别取“2.1.2”项下的供试品溶液适量,10 000 r/min离心10 min,精密吸取上清液4 mL,氮气吹干甲醇,加0.5 mL DMSO溶解配成工作储备液,培养基稀释1 000倍后配成生药浓度为0.2 mg/mL的含药培养基即为样品溶液。最后取100μL含药培养基加入100μL细胞液中,每个样品设6个复孔。2.2.2 抗肿瘤活性的测定
取对数生长期A549细胞用RPMI 1640培养液调整细胞数为1×10个/mL的单细胞悬液,参考文献测定各样品的细胞抑制率(见表3)。结果显示,在等生药量浓度条件下,22批样品的抑制率在0.182~0.989,可见不同来源紫草甲醇提取物对A549细胞的抑制作用存在较大差异,原因可能是不同紫草中所含紫草素类化合物含量存在差异,这种显著性差异为谱效关系研究提供了良好的数据基础。
表3 22批药用紫草提取物的细胞抑制率(n=6)/±s
2.3 谱效关系辨识结果分析
PLSR集成了典型相关分析、主成分分析和多元线性回归分析的基本功能,可以最大限度地利用数据信息,预测精度高,主要用于多因变量对多自变量的回归建模,能较好地解决样本量少于变量的问题,是一种模型拟合度好和预测能力强的数据处理方法,在谱效关系研究中被广泛采用。本研究分别将22批次紫草的57个特征峰的相对峰面积作为自变量X,将A549细胞的抑制率作为因变量Y导入SIMCA-14.1软件,采用PLSR模型将数据X和Y进行回归分析,计算得到57个特征峰与抑制率的标准化回归系数和变量投影重要性系数(VIP)值,见表4。VIP>1时,自变量在解释因变量时差异有重要意义。由图2可知,VIP均大于1且由大到小的顺序为峰59、9、66、32、62、45、46、58、43、71、13、63、41、44、5、39、34、65、49、21、12、3、22和60,说明其对应的物质对A549细胞的抑制作用有重要影响。经过与对照品比对及质谱分析鉴定,确定了各峰代表的化合物(见表5)。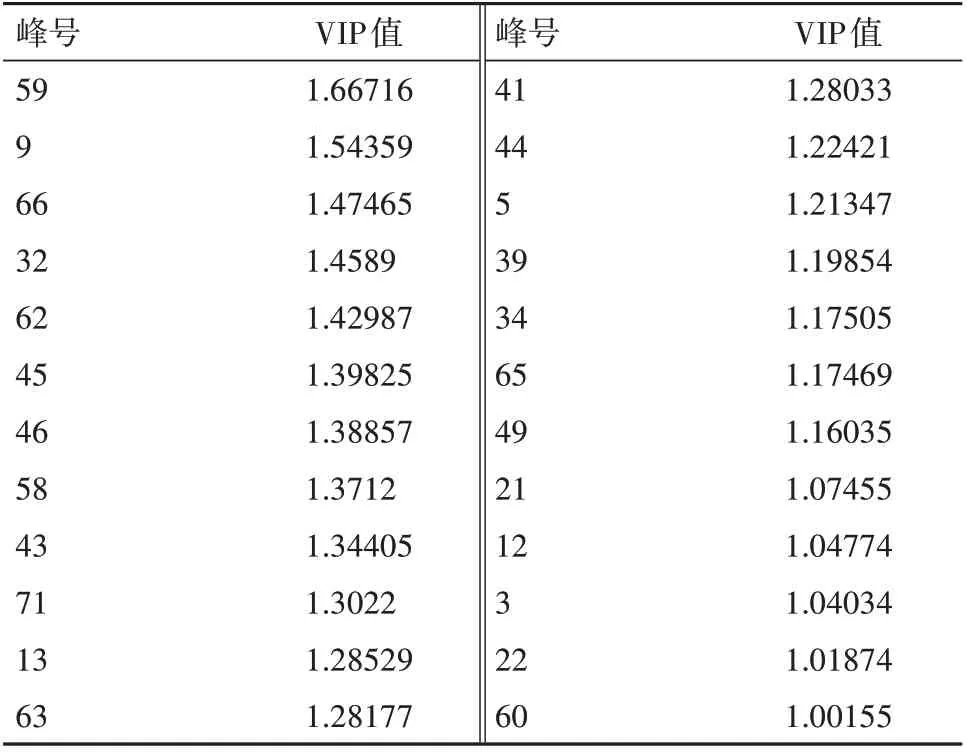
表4 各化合物对药效的变量投影重要性系数(VIP)值

表5 经偏最小二乘回归(PLSR)谱效关系辨识的化合物
2.4 体外抗肿瘤验证试验
对于有标准品的化合物,笔者采用MTT法验证其对A549细胞的体外抑制活性,以紫杉醇为阳性对照。分别称取各化合物适量,加DMSO溶解配成100 mmol/L的储备液,临用前培养基稀释成0、0.1、0.5、1、5、10、25、50μmol/L的含药培养基,最后取100μL含药培养基加入100μL细胞液中,每个样品设6个复孔。按“2.2.2”项下方法操作并计算化合物的IC值,结果见表6。结果显示各化合物的IC值在0.74~22.60μmol/L之间,其细胞抑制率随着浓度升高而增强,可能是紫草发挥体外抗肿瘤作用的重要成分。
表6 化合物的体外抗肿瘤活性
3 讨论
紫草中的紫草素类成分同分异构体多样,由于几个主要成分的干扰,其他微量成分根本无法在常规的紫外检测器上显示,色谱分离分析困难,目前关于如何有效建立紫草中的紫草素类成分指纹图谱还未见文献报导。本实验采用UHPLC-QTRAPMS/MS(MRM)技术建立的紫草特征轮廓谱能同时对化合物进行定量和定性分析,有助于后期谱效关系研究对化合物的指认和鉴定。
目前,中药谱效关系研究中多采用1个指标,或者将几个药效指标同时评价起到相互补充、相互佐证的作用,但有时却会因几个药效指标同时评价得到相互矛盾的结果。因此,选择有针对性、能代表药物主要作用的指标至关重要。紫草素及其衍生物对A549细胞的抗肿瘤作用已有多篇文献报导,药效确切。课题组进一步通过MTT法确证了药用紫草甲醇提取物也具有相当强的抗A549细胞活性;在相同生药剂量时,不同来源紫草药材对细胞的抑制率不同;相同来源的药材其抑制率呈剂量依赖性。因此选择对紫草提取物反应灵敏的A549细胞抑制率作为药效指标对于评价紫草体外抗肿瘤活性是可行的。
目前谱效关系研究的数据处理方法众多,具有各自的优势和应用范围。本研究采用PLSR法分析了紫草药材样品特征峰与其抗肿瘤作用的相关性。结果辨识出24种紫草素类成分与其抗肿瘤作用呈正相关,说明紫草的抗肿瘤效应是多种成分共同作用的结果。活性验证结果显示紫草呋喃A(5)、紫草素(9)、紫草呋喃E(21)、乙酰紫草素(32)、去氧紫草素(46)、异丁酰紫草素(58)、β,β-二甲基丙烯酰紫草素(65)和α-甲基丁酰紫草素(66)均对A549细胞有一定抑制作用,其IC值为0.74-22.60μmol/L,在一定程度上验证了上述谱效关系研究结果。由于分离纯化工作仍在进行,对于辨识出的其他化合物是否具有确切的药效还有待课题组进一步深入探讨。
综上所述,本研究通过药用紫草的谱效关系初步明确了与其抗肿瘤活性相关的物质,为紫草后续研究和开发提供了科学依据。
