高效液相色谱法测定甘草流浸膏中赭曲霉毒素A的含量
2021-07-06欧阳吉德邓湘波康乐刘冠琼
欧阳吉德 邓湘波 康乐 刘冠琼
郴州市食品药品检验检测中心,湖南 423000
赭曲霉毒素A是赭曲霉毒素家族中最重要的毒素,由多种曲霉菌(赭曲霉)和青霉菌(疣孢青霉)产生。赭曲霉毒素普遍存在于热带和气候温和的地区,污染范围广,常出现在燕麦、大麦、小麦和玉米农作物上,导致赭曲霉毒素A广泛分布于各种谷物和中药材中,从而侵害动物及人体肝脏与肾脏[1-3]。
甘草流浸膏主要用于止咳、化痰,适用于感冒、咳嗽、多痰、支气管性气喘等。赭曲霉毒素在甘草流浸膏质量安全有着重要的关联性,在国家大力推动中药材标准化建设的形势下,从源头上加强中药材质量安全控制,系统研究中药材毒素存量情况很有必要,研究甘草流浸膏中赭曲霉毒素是判断该药品质量合格与否的重要指标。目前针对赭曲霉毒素的检测方法主要集中于谷物、大豆、小麦等粮食制品,方法主要有液相色谱法、液相色谱串联质谱法、酶联免疫吸附测定法、薄层色谱法[2-6],然而此类方法均存在设备昂贵、操作过程繁琐、试剂耗费大、灵敏度低等特点。免疫亲和层析净化与高效液相色谱法相结合的方法,较好地克服了以上缺点,具有快速高效、操作简便等优点,已被广泛应用于食品等领域。但中国药典中尚未建立甘草流浸膏中赭曲霉毒素相关检验检测方法[7],免疫亲和层析净化液相色谱法用于中药材中赭曲霉毒素测定的研究也罕见于报道[8-10]。
本文首次采用免疫亲和层析净化-高效液相色谱法对甘草流浸膏中赭曲霉毒素A进行分析测定。以Hypersil BDC-C18色谱柱(250.0 mm×4.6 mm,5μm)为分析柱,以乙腈为流动相A,以2%冰乙酸溶液为流动相B,按梯度洗脱程序,激发波长(Ex)=333 nm,发射波长(Em)=460 nm,流速1.0 ml/min,柱温35℃,进样量10μl,对赭曲霉毒素A的测定。建立了1种测定甘草流浸膏中赭曲霉毒素A的简便、快速的方法。
1 仪器与试药
1.1 仪器 LC-20AT高效液相色谱仪,包括CBM-20A系统控制器、DGU-20As真空脱气机、LC-20AT溶液传输单元、SIL-20A自动进样器、CTO-20A柱温箱、RF-20A荧光检测器、LCsolution工作站(日本Shimadzu公司);免疫层析净化系统;METTLER TOLEDO ML204电子分析天平(瑞士METTLERTOLEDO公司);0.1~1.0 ml可调移液枪(德国艾本德有限公司);PriboFast赭曲霉毒素A免疫亲和柱(青岛普瑞邦生物工程有限公司,2~8℃)。
1.2 试药 赭曲霉毒素A对照品(青岛普瑞邦生物工程有限公司,批号:1I00H06,浓度:100.3μg/ml);甘草流浸膏由南开制药有限公司提供。试验用水为自制超纯水:SMART2 PURE智能一体化超纯水系统(美国赛默飞世尔科技公司)制备。其他试剂:甲醇(色谱纯)、冰乙酸、氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾均采购于国药集团。磷酸缓冲溶液:称取8.00 g氯化钠,1.20 g磷酸氢二钠、0.20 g磷酸二氢钾、0.20 g氯化钾,用990 ml蒸馏水溶解,然后用盐酸调节pH值至7.0,最后用蒸馏水稀释定容至1 000 ml。甲醇-水(80∶20)提取液:移取800 ml甲醇,加蒸馏水200 ml混合。
2 方法与结果
2.1 样品净化
2.1.1 样品取样 将样品混合均匀,精密称取(精确到0.1 g)5.0 g至均质器中,加提取液甲醇-水(80∶20)溶液混匀,定容至50 ml容量瓶中,涡旋混匀并超声提取5 min。移取10 ml滤液于50 ml容量瓶中,用水定容至刻度,混匀;用玻璃纤维滤纸过滤至澄清,取滤液备用。
2.1.2 样品净化 将低温下的免疫亲和柱提前恢复至室温。将泵流操作架的注射器下端用力插穿免疫亲和柱上盖中间圆孔,使其连通;准确移取10 ml样品提取液转移至注射器内,打开下端堵头;将空气压力泵与注射器连接,调节压力使样品提取液缓慢通过免疫亲和柱,建议重力过柱;先用10 ml PBS加压清洗1次,再用10 ml蒸馏水加压清洗1次,弃去全部流出液,并使2~3 ml空气通过柱体。
2.1.3 样品洗脱 首先将免疫亲和柱内液体排干,下端盖上堵头,加1.0 ml洗脱液(色谱甲醇∶乙酸=98∶2)洗脱液于柱管内孵育60 s以上,重力过柱,当溶剂通过柱子后,再加入1.0 ml洗脱液重复上述洗脱步骤,最后轻微加压排净洗脱液,合并洗脱液,将洗脱液在45℃下氮气吹干,用1.0 ml流动相溶解,既得样品待测溶液。同时制备空白溶液。将样品溶液和空白溶液注入高效液相色谱仪中,按照绘制校准曲线相同的仪器工作条件进行测定。
2.2 色谱条件 对赭曲霉毒素A的测定采用Hypersil BDC-C18色谱柱(250.0 mm×4.6 mm,5μm);以乙腈-2%冰醋酸(48∶52),Ex=333μm,Em=460μm,流速1.0 ml/min,柱温35℃,进样量10μl。分别配制对照品溶液、供试品溶液和阴性样品溶液,按上述色谱条件进样测定,记录色谱图,结果见图1。
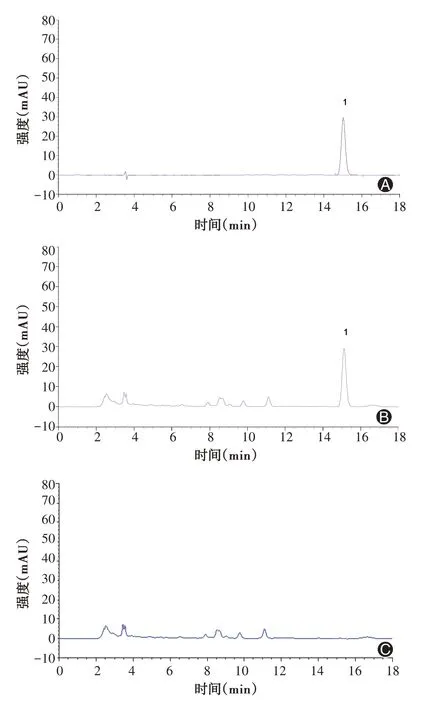
图1 赭曲霉毒素A的高效液相色谱法图(A为标准品,B为供试品,C为阴性样品)
2.3 线性关系考察 将赭曲霉毒素A标准品用色谱纯甲醇充分溶解,配制成1 000.0μg/ml标准溶液。定量移取标准溶液于10.0 ml容量瓶中,分别配制成1.0、2.0、5.0、10.0、20.0、50.0μg/ml标准工作液,通过0.22μm微孔滤膜,上机测定。重复测定2次,结果取平均值,以峰面积为纵坐标,浓度为横坐标,绘制标准曲线,线性回归方程Y=221.23X+170.72,r=0.998 7。
2.4 回收率试验 精密称取3份甘草流浸膏样品5.0 g,按上述2.1实验方法净化,以2.2梯度洗脱方法对样品中赭曲霉毒素A测定,每份样品平行测定2次,取其平均值,得到甘草流浸膏样品中赭曲霉毒素A本底结果。再另外精密称取同批次甘草流浸膏样品3份(每份约5.0 g),分别加入5.0μg、10.0μg、25.0μg赭曲霉毒素A标准溶液,按照前述试验方法进行净化、测定。经计算,样品中赭曲霉毒素加样回收率分别为90.10%、94.85%、92.48%,平均回收率为92.48%,相对标准差为2.57%,结果表明回收率良好,平均回收率为92.48%。
3 讨 论
3.1 样品处理条件的选择 称取样品时应注意,真菌毒素分析的最大误差来源是样品的收集和取样过程,所以要保证样品收集和取样的均匀性和代表性。
为了样品净化过程对测定结果的影响,课题组研究了甲醇-水提取液的比例,试验结果表明,甲醇-水(80∶20)体系较优;洗涤时洗涤液既可以用蒸馏水也可以用PBS,但考虑到在洗脱前更好地防止亲和柱中单克隆抗体变性,使用PBS清洗液更好;由于糖浆剂含糖量在75.00%以上,基质效应复杂。含糖量严重影响免疫亲和柱的柱容,从而对样品回收率产生较大的影响。课题组进一步研究了该赭曲霉毒素A免疫亲和柱,将不同浓度的标准工作液1.0 ml分别通过免疫亲和柱,保持压力稳定,将流速控制为1滴/s,净化过程同样品处理,收集洗脱液测定。结果表明当样品量小于5 g,加标浓度小于100.0μg时,回收率较为稳定。
3.2 色谱检测条件优化 由于甘草流浸膏含糖量高,内容物成分复杂、杂质多,易造成样品背景高、分离度差等情况。试验针对色谱条件,分别对等度洗脱及梯度洗脱两方面进行了优化研究。试验将等度洗脱程序:色谱柱柱温设定为35℃,流速1.0 ml/min,以48%乙腈(A)-52%冰乙酸(2%)水溶液(B)为流动相,Ex=333μm,Em=460μm,进样量10.0μl。梯度洗脱程序:色谱柱柱温设定为35℃,流速1.0 ml/min,以乙腈为流动相A,以2%冰乙酸溶液为流动相B,按梯度洗脱条件,Ex=333μm,Em=460μm,进样量10.0μl。两者进行对比,结果显示,梯度洗脱程序能够较好地分离样品中各成分,并得到较低的本底。
综上所述,甘草流浸膏是我国常用的止咳化痰处方药,在全国应用市场非常广泛。本研究选取甘草流浸膏作为研究对象,试验方法通过一系列预处理方法的优化和方法验证,排除了基质干扰,建立了测定甘草流浸膏中赭曲霉毒素A的免疫亲和层析净化高效液相色谱分析方法。采用的处理方法简单、可靠,该方法线性关系、精密度、回收率良好,可适用于甘草流浸膏等中成药测定赭曲霉毒素A,为甘草流浸膏的安全性质量控制检查提供了方法依据。
利益冲突:作者已申明文章无相关利益冲突。
