2型糖尿病合并股骨骨折老年患者骨代谢指标及凝血指标变化的研究
2021-07-05芦虎严瀚
芦虎 严瀚
2型糖尿病(Type 2 diabetes mellitus,T2DM)是机体葡萄糖代谢障碍性疾病,患者血糖的升高以及自身胰岛素分泌障碍很大程度上影响了葡萄糖对机体组织细胞的供能,小肠上皮细胞葡萄糖供能障碍易影响机体对钙磷的吸收,目前有大量研究证实老年糖尿病患者易发生骨折及骨质疏松[1]。同时,有研究证实糖尿病患者机体的葡萄糖供能障碍易影响组织细胞中糖蛋白的合成,糖蛋白是血管内皮细胞以及其他各组织细胞重要的膜结构蛋白,糖蛋白合成障碍易影响血管内皮细胞修复功能,继而加剧微血管基底膜的损伤,造成凝血障碍[2,3]。因此,为有效预防T2DM患者骨代谢疾病及凝血障碍的发生,本研究对骨折合并T2DM患者及非骨折T2DM患者的体内骨代谢指标及凝血指标实施对比监测,现报道如下。
1 材料与方法
1.1 一般资料选取2019年1月~2020年12月我院收治的60例老年T2DM患者为研究对象。纳入标准:①入选患者均对本研究知情且签订知情同意书;②入选前2周内未接受骨代谢药物治疗、血栓治疗及止血治疗;③无其他血液代谢障碍疾病;④无肝肾功能障碍及骨代谢性疾病。排除标准:①精神障碍或沟通障碍者;②先天性骨代谢障碍者;③近期接受骨代谢药物治疗者;④骨折病程在2周以上者。依据是否有股骨骨折将患者分为T2DM合并骨折组(30例)和T2DM无骨折组(30例),同时选取同期健康体检者(30例)作为对照组。T2DM合并骨折组中,男18例,女12例,年龄53~72岁,平均(64.34±4.41)岁,病程1~4年,平均(2.74±0.33)年;T2DM无骨折组中,男19例,女11例,年龄54~71岁,平均(64.10±3.97)岁,病程1~4年,平均(2.53±0.31)年;对照组男16例,女14例,年龄54~70岁,平均(63.78±4.27)岁。三组患者在年龄、性别及病程方面差异无统计学意义(P>0.05),具有可比性。
1.2 方法血液样本采集:血样采集前禁食8h以上,次日早晨空腹采血。每位患者分别使用含有抗凝剂(枸橼酸钠)的血样采集管及无抗凝剂的真空采血管采集5~8ml肘静脉血,抗凝血样颠倒混匀后于3 000r/min离心15min,分离血浆并分装标记;无抗凝剂血样室温(25℃)静置凝固后离心分离血清并分装标记,所有样本采集后2h内检测完成,另一部分置于-20℃保存。
骨代谢指标测定:所有血清样本在采集分离后2h内检测,采用电化学发光法测定骨钙素[BGP,罗氏诊断产品(上海)有限公司],酶联免疫检测I型胶原交联氨基末端肽(NTX,美国RD公司),放射性免疫分析法检测降钙素(CT,北京华英公司),所有检测指标均严格依照试剂盒厂家说明执行。
血凝指标测定:所有血浆样本在采集分离后2h内检测,凝血酶原时间(PT)、活化的部分凝血活酶时间(APTT)及凝血酶时间(TT)采用血浆添加钙离子和组织Ⅲ因子进行血液凝固法测定,纤维蛋白原(FIB)采用血浆添加外源凝血酶的Clauss法测定,以上指标的测定均在CA1500全自动血凝分析仪上执行;D-二聚体(D-D)采用乳胶增强比浊法[试剂盒由罗氏诊断产品(上海)有限公司提供],并在C6000全自动生化分析仪上检测。
1.3 观察及评价指标①骨代谢指标:BGP、NTX及CT;②凝血指标:PT、APTT、TT、FIB及D-D。
1.4 统计学方法本研究采用SPSS 21.0统计学软件对数据进行分析,计量资料以均数±标准差(±s)表示,采用t检验;并进行Pearson相关性分析,P<0.05为差异具有统计学意义。
2 结果
2.1 三组患者的血糖水平及骨代谢指标变化比较对照组的空腹血糖、HbA1c及NTX水平均显著低于其他两组(P<0.05),BGP及CT水平均显著高于其他两组(P<0.05)。T2DM合并骨折组的空腹血糖、HbA1c及NTX水平均显著高于T2DM无骨折组(P<0.05)。见表1。
表1 三组患者的血糖水平及骨代谢指标变化比较(±s)
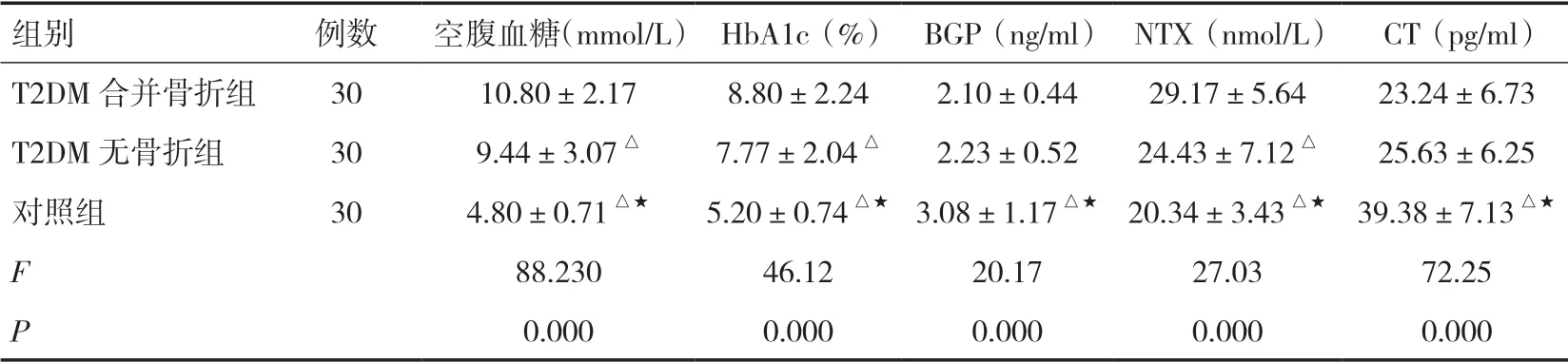
表1 三组患者的血糖水平及骨代谢指标变化比较(±s)
注:与T2DM合并骨折组比较,△P<0.05;与T2DM无骨折组比较,★P<0.05
组别例数空腹血糖(mmol/L)HbA1c(%)BGP(ng/ml)NTX(nmol/L)CT(pg/ml)T2DM合并骨折组3010.80±2.178.80±2.242.10±0.4429.17±5.6423.24±6.73 T2DM无骨折组309.44±3.07△7.77±2.04△2.23±0.5224.43±7.12△25.63±6.25对照组304.80±0.71△★5.20±0.74△★3.08±1.17△★20.34±3.43△★39.38±7.13△★F 88.23046.1220.1727.0372.25 P 0.0000.0000.0000.0000.000
2.2 三组患者的凝血指标变化比较对照组的APTT及TT水平均显著高于其他两组(P<0.05),FIB及D-D水平均显著低于其他两组(P<0.05),PT水平显著高于T2DM合并骨折组(P<0.05);T2DM合并骨折组的APTT水平显著低于T2DM无骨折组(P<0.05),FIB及D-D水平均显著高于T2DM无骨折组(P<0.05)。见表2。
表2 三组患者的凝血指标变化比较(±s)
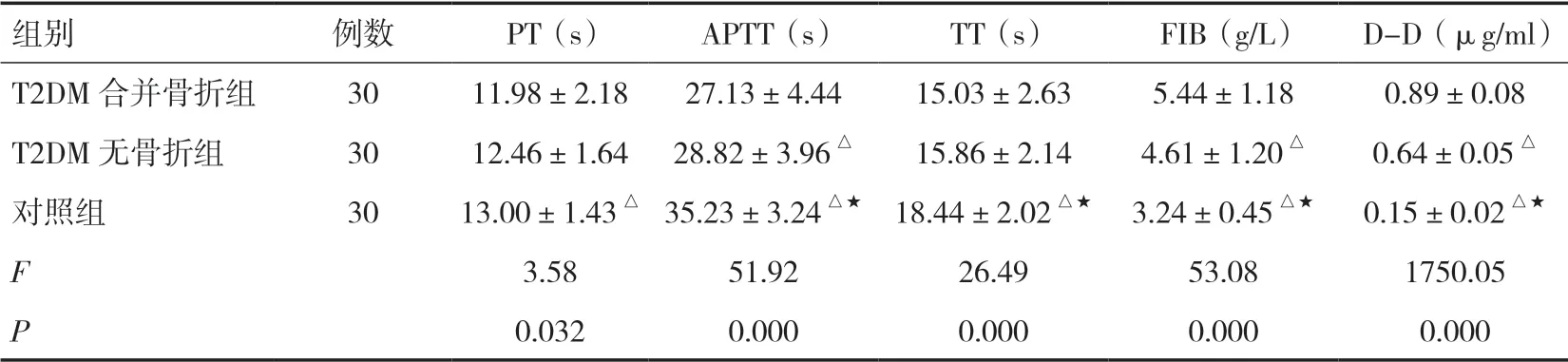
表2 三组患者的凝血指标变化比较(±s)
注:与T2DM合并骨折组比较,△P<0.05;与T2DM无骨折组比较,★P<0.05
组别例数PT(s)APTT(s)TT(s)FIB(g/L)D-D(μg/ml)T2DM合并骨折组3011.98±2.1827.13±4.4415.03±2.635.44±1.180.89±0.08 T2DM无骨折组3012.46±1.6428.82±3.96△15.86±2.144.61±1.20△0.64±0.05△对照组3013.00±1.43△35.23±3.24△★18.44±2.02△★3.24±0.45△★0.15±0.02△★F 3.5851.9226.4953.081750.05 P 0.0320.0000.0000.0000.000
2.3 血糖水平与骨代谢指标及凝血指标的相关性空腹血糖、HbA1c水平与患者的NTX、FIB及D-D水平均呈正相关(P<0.05),与CT及PT呈负相关(P<0.05)。见表3。
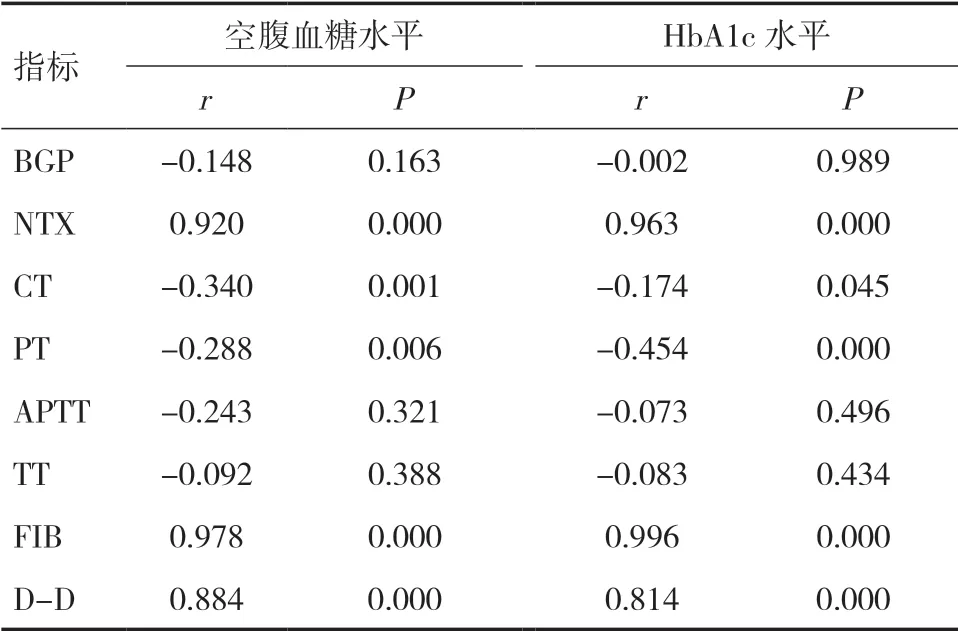
表3 血糖水平与骨代谢指标及凝血指标的相关性
3 讨论
糖尿病患者受机体葡萄糖代谢紊乱以及胰岛素合成不足影响,易出现钙磷吸收障碍及骨质降解[4]。研究发现受糖尿病患者尿量增加影响,机体钙磷的流失加剧,间接导致骨代谢调节因子如CT、BGP及NTX等水平变化,CT在降低骨细胞裂解及维持骨形状方面具有重要作用,BGP参与骨基质形成以保障骨基质的更新,NTX是破骨细胞生长增殖的重要调节因子,破骨细胞清除裂解成骨细胞从而促进骨吸收,这些调节因子的变化会加剧骨代谢异常[5,6]。在糖尿病患者骨代谢异常的同时,有研究发现T2DM患者易出现微血管循环障碍及诱发血栓,有研究证实D-D和FIB水平显著增加,同时凝血时间也相应减少[7]。近年来随着T2DM患者凝血指标变化的深入研究,研究者发现T2DM患者的微血管内皮细胞凋亡显著增加,同时凝血指标出现异常[8,9]。尽管对T2DM患者的凝血指标及骨代谢指标水平变化进行了大量研究,但是在T2DM患者胰岛素或血糖水平与血液循环系统疾病以及骨折发生的相关性方面仍缺乏大量研究。
本研究选取T2DM无骨折患者、T2DM合并骨折患者及健康人群为研究对象,经过对三组患者骨代谢指标以及凝血指标变化比较可知,两组T2DM患者的NTX水平显著高于对照组(P<0.05),BGP及CT水平均显著低于对照组(P<0.05),此结果初步说明老年T2DM患者机体的骨基质更新及骨形状维持能力显著降低。T2DM合并骨折组NTX水平显著高于T2DM无骨折组(P<0.05),说明T2DM合并骨折患者的成骨细胞凋亡数量显著高于T2DM无骨折组。两组T2DM患者的APTT及TT时间均显著短于对照组(P<0.05),同时FIB及D-D水平均显著高于对照组(P<0.05),说明T2DM患者凝血功能增强,更容易加剧血栓的形成,FIB及D-D水平的显著增加进一步说明血管损伤加重。T2DM合并骨折组的APTT水平显著低于T2DM无骨折组(P<0.05),FIB及D-D水平均显著高于T2DM无骨折组(P<0.05),此结果初步说明T2DM合并骨折患者在血栓形成时间以及血管损伤程度方面均比T2DM无骨折患者严重。通过血糖与骨代谢和凝血指标相关性分析可知,空腹血糖、HbA1c水平与患者的NTX、FIB及D-D水平均呈正相关(P<0.05),与CT及PT水平呈负相关(P<0.05),说明血糖水平对骨代谢以及血栓形成有影响。
综上所述,T2DM患者随着血糖水平的增加,其诱发骨折及凝血异常发生率会相应增加,骨代谢指标NTX、凝血指标FIB及D-D水平的显著变化对T2DM患者骨折风险的评估具有重要指导作用。
